我国力争于 2030 年前做到碳达峰,2060 年前实现碳中和。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:反应 I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=akJ·mol-1
反应 II:CO(g)+2H2(g)=CH3OH(g) ΔH2=b kJ·mol-1
反应III:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)原料 CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为 CO2 捕获剂的是_______(填标号)。
(2)根据盖斯定律,反应 III 的ΔH3=_______ kJ·mol-1
(3)对于上述 CO2加氢合成 CH3OH 的体系,下列说法错误的是_______(填标号)。
(4)上述反应平衡常数的自然对数 ln Kp(Kp是以分压表示的平衡常数,分压=总压×物质的量分数)随温度的变化如图所示:
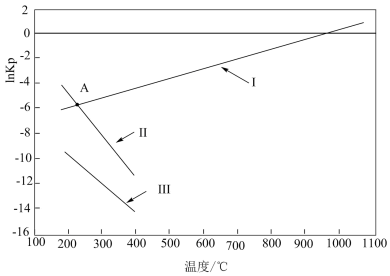
①反应I、II、III 中属于吸热反应的是_______ ,写出推理过程_______ 。
②若图中 A 点时发生反应 CH3OH(g)+CO2(g) ⇌2CO(g)+H2(g)+H2O(g),则lnKp=_______ (填数值)。
③若T0℃时,在密闭容器中加入 6 mol H2、4 molCO2只进行反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),维持压强为 p0kPa不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=_______ 。
已知:反应 I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=akJ·mol-1
反应 II:CO(g)+2H2(g)=CH3OH(g) ΔH2=b kJ·mol-1
反应III:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)原料 CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为 CO2 捕获剂的是_______(填标号)。
| A.NaOH 溶液 | B.浓氨水 | C.CH3CH2OH | D.NH4Cl 溶液 |
(3)对于上述 CO2加氢合成 CH3OH 的体系,下列说法错误的是_______(填标号)。
| A.增大 H2浓度有利于提高 CO2的转化率 |
| B.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| C.体系达平衡后,若压缩体积,则反应 I 平衡不移动,反应 III 平衡逆向移动 |
| D.选用合适的催化剂可以提高 CH3OH 在单位时间内的产量 |

①反应I、II、III 中属于吸热反应的是
②若图中 A 点时发生反应 CH3OH(g)+CO2(g) ⇌2CO(g)+H2(g)+H2O(g),则lnKp=
③若T0℃时,在密闭容器中加入 6 mol H2、4 molCO2只进行反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),维持压强为 p0kPa不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=
2021·全国·模拟预测 查看更多[4]
(已下线)第8周 周测卷-备战2022年高考化学周测与晚练(新高考专用)2020年全国卷Ⅰ理综化学高考真题变式题湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题广东省2022届高三上学期综合能力测试(一)化学试题
更新时间:2021-09-30 12:58:42
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】臭氧(O3)主要分布在大气层的平流层中,能够吸收紫外线,被称为地球的保护伞。回答下列问题:
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=_______ (用K1、K2、K3表示),写出一种保护臭氧层的措施:__________ 。
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H=____ kJ•mol-1。
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4mol•L-1SO3,此时SO2的转化率为_______ ,欲提高O3的利用率可采取的措施有_______ (填字母)。
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入_______ molNa2SO4。
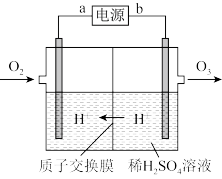
(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为_____ 极,通入O2的电极反应式为_______ 。
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H=
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4mol•L-1SO3,此时SO2的转化率为
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入

(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】船舶柴油机发动机工作时,反应产生的 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。
已知: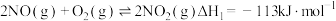 ;
; ;
;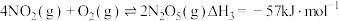
(1) 氧化脱除
氧化脱除 的总反应是
的总反应是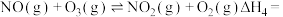
_______ 。
(2)该反应过程有两步: ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数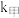
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是 _______ 。  的反应历程分两步:
的反应历程分两步:
①则反应Ⅰ与反应Ⅱ的活化能:
_______ 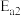 (填“
(填“ ”“
”“ ”或“
”或“ ”)。反应
”)。反应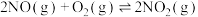 的平衡常数
的平衡常数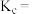
_______ (用 、
、 、
、 、
、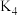 表示)。
表示)。
②在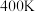 、初始压强为
、初始压强为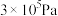 的恒温刚性容器(体积为VL)中,按
的恒温刚性容器(体积为VL)中,按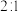 通入
通入 和
和 一定条件下发生反应。达平衡时
一定条件下发生反应。达平衡时 转化率为
转化率为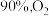 转化率为
转化率为
____________ 。
(4)某研究小组将 、
、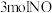 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应
催化剂表面发生反应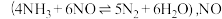 的转化率随温度的变化情况如图所示:
的转化率随温度的变化情况如图所示: 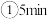 内温度从
内温度从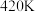 升高到
升高到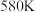 ,此时段内
,此时段内 的平均反应速率
的平均反应速率
_______ (保留 位有效数字)。
位有效数字)。
②无氧条件下, 生成
生成 的转化率较低,原因可能是
的转化率较低,原因可能是 _______ 。
 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。 已知:
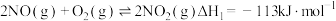 ;
; ;
;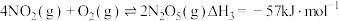
(1)
 氧化脱除
氧化脱除 的总反应是
的总反应是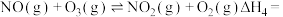
(2)该反应过程有两步:
 ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数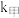
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是 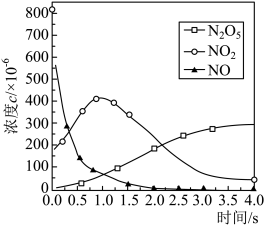
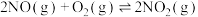 的反应历程分两步:
的反应历程分两步: | 步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
| Ⅰ |  (快) (快) |  | 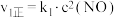 | 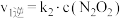 |
| Ⅱ | 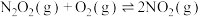 (慢) | 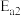 | 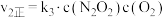 |  |

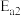 (填“
(填“ ”“
”“ ”或“
”或“ ”)。反应
”)。反应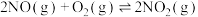 的平衡常数
的平衡常数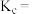
 、
、 、
、 、
、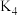 表示)。
表示)。 ②在
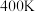 、初始压强为
、初始压强为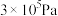 的恒温刚性容器(体积为VL)中,按
的恒温刚性容器(体积为VL)中,按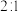 通入
通入 和
和 一定条件下发生反应。达平衡时
一定条件下发生反应。达平衡时 转化率为
转化率为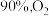 转化率为
转化率为
(4)某研究小组将
 、
、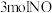 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应
催化剂表面发生反应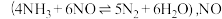 的转化率随温度的变化情况如图所示:
的转化率随温度的变化情况如图所示: 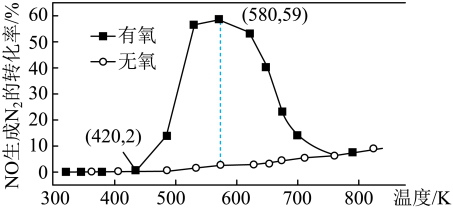
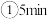 内温度从
内温度从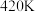 升高到
升高到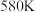 ,此时段内
,此时段内 的平均反应速率
的平均反应速率
 位有效数字)。
位有效数字)。 ②无氧条件下,
 生成
生成 的转化率较低,原因可能是
的转化率较低,原因可能是
您最近一年使用:0次
【推荐3】I、废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为__________ 。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:
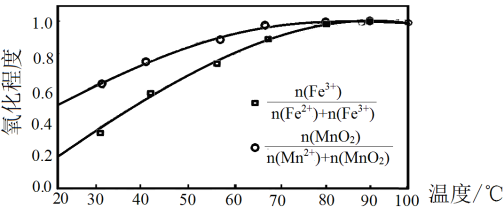
实验过程中应将温度控制在_________ 。
Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_______ 。
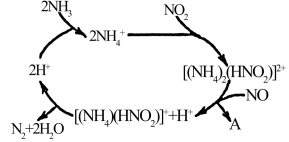
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和__________ 。
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
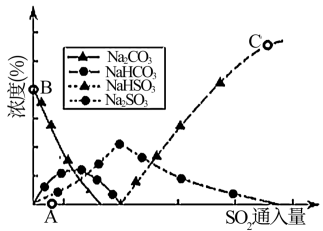
①吸收初期(图中A点以前)反应的化学方程式为__________ 。
②C点高于B点的原因是__________ 。
Ⅱ、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) ΔH=+1805kJ/mol①
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol②
2C(s)+O2(g)=2CO(g) ΔH-221.0kJ/mol③
(4)某反应的平衡常数表达式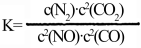 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:__________ 。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______ (填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
(6)2SO(g) 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____ (用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。

(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在
Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。

①吸收初期(图中A点以前)反应的化学方程式为
②C点高于B点的原因是
Ⅱ、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) ΔH=+1805kJ/mol①
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol②
2C(s)+O2(g)=2CO(g) ΔH-221.0kJ/mol③
(4)某反应的平衡常数表达式
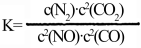 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
(6)2SO(g)
 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果于北京时间9月24日由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用CH4与CO2制备“合成气”(CO、H2),合成气可直接制备甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) △H=-99kJ•mol-1。
CH3OH(g) △H=-99kJ•mol-1。
(1)若要该反应自发进行,_____ (填“高温”或“低温”)更有利。
(2)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_____ (填字母序号)。
(3)T1℃下,在2L恒容密闭容器中充入2molCO和6molH2合成CH3OH(g),测得CO的物质的量浓度随反应时间的变化如图所示:
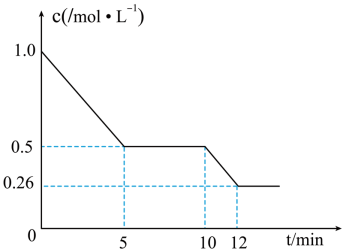
①前5分钟内,v(H2)=_____ 。
②T1℃时,该反应的化学平衡常数K=_____ 。
③10min时,改变的外界条件可能是_____ 。
(4)T1℃下,在1L恒容密闭容器中充入2molCO、2molH2和3molCH3OH(g),此时反应将_____ (填“向左进行”“向右进行”“达到平衡”或“无法判断”)。
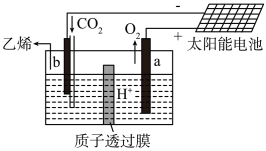
(5)工业上也可以用电解法捕获CO2,如图,CO2在酸性水溶液中用情性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为______ 。
 CH3OH(g) △H=-99kJ•mol-1。
CH3OH(g) △H=-99kJ•mol-1。(1)若要该反应自发进行,
(2)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是
| A.混合气体的平均相对分子质量不再变化 | B.混合气体的密度不再变化 |
| C.CO的百分含量不再变化 | D.CO、H2、CH3OH的物质的量之比为1:2:1 |

①前5分钟内,v(H2)=
②T1℃时,该反应的化学平衡常数K=
③10min时,改变的外界条件可能是
(4)T1℃下,在1L恒容密闭容器中充入2molCO、2molH2和3molCH3OH(g),此时反应将
(5)工业上也可以用电解法捕获CO2,如图,CO2在酸性水溶液中用情性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】苯乙烯是重要的化工原料,可由乙烯、乙炔为原料合成。反应过程如下所示:
乙炔聚合:3C2 H2(g) C6H6 (g) ∆H1
C6H6 (g) ∆H1
合成乙苯:C6H6(g)+C2H4(g) C6H5CH2CH3(g) ∆H2
C6H5CH2CH3(g) ∆H2
乙苯脱氢:C6H5CH2CH3(g) C6H5CH=CH2 (g)+H2 (g) △H3
C6H5CH=CH2 (g)+H2 (g) △H3
(1)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0 L恒容密闭容器中充入0.10 mol C6H5CH2CH3(g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
①计算该温度下的平衡常数K=______ (结果保留至小数点后两位)。
②下列不能说明该温度下反应达到平衡状态的是_____ (填字母代号)。
a.v(C6H5CH2CH3)=v(H2) b.苯乙烯的体积分数不变
c.平衡常数K保持不变 d.混合气体的平均相对分子质量不变
(2)向体积为3.0 L的恒容密闭容器中充入0. 20 mol C6H5CH2CH3(g),当乙苯脱氢反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。
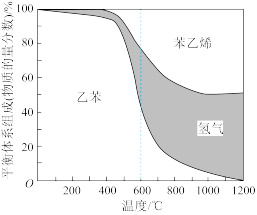
①该反应的∆H3______ 0(填“大于”“等于”或“小于”)。
②该平衡体系在600℃时,乙苯的物质的量分数为50%,则氢气的物质的量分数为_____ 。若在此温度下加入水蒸气作稀释剂,则乙苯的平衡转化率将如何变化并简述理由__________ 。
(3)苯乙烯能与酸性KMnO4溶液混合反应生成苯甲酸(C6H5COOH)。室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,则溶液中c(C6H5COOH):c(C6H5COO-)=___________ 。(已知:苯甲酸的Ka=6.4×l0-5;碳酸的Kal=4.2×l0-7,Ka2=5.6×l0-ll)
乙炔聚合:3C2 H2(g)
 C6H6 (g) ∆H1
C6H6 (g) ∆H1合成乙苯:C6H6(g)+C2H4(g)
 C6H5CH2CH3(g) ∆H2
C6H5CH2CH3(g) ∆H2乙苯脱氢:C6H5CH2CH3(g)
 C6H5CH=CH2 (g)+H2 (g) △H3
C6H5CH=CH2 (g)+H2 (g) △H3(1)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0 L恒容密闭容器中充入0.10 mol C6H5CH2CH3(g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①计算该温度下的平衡常数K=
②下列不能说明该温度下反应达到平衡状态的是
a.v(C6H5CH2CH3)=v(H2) b.苯乙烯的体积分数不变
c.平衡常数K保持不变 d.混合气体的平均相对分子质量不变
(2)向体积为3.0 L的恒容密闭容器中充入0. 20 mol C6H5CH2CH3(g),当乙苯脱氢反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。

①该反应的∆H3
②该平衡体系在600℃时,乙苯的物质的量分数为50%,则氢气的物质的量分数为
(3)苯乙烯能与酸性KMnO4溶液混合反应生成苯甲酸(C6H5COOH)。室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,则溶液中c(C6H5COOH):c(C6H5COO-)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g) CO2(g)+H2(g) ∆H2= –41.2kJ/mol
CO2(g)+H2(g) ∆H2= –41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= _________ 。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
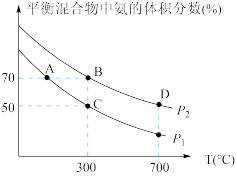
①恒压时,反应一定达到平衡状态的标志是_________ (填序号)
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C. 保持不变 D.
保持不变 D.
②P1_________ P2 (填“>” “<”“=”或“不确定”,下同);反应的平衡常数:B点_________ D点。
③C点 的转化率为
的转化率为_________ ;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)_________ υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为_________ 。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/molb. CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2= –41.2kJ/mol
CO2(g)+H2(g) ∆H2= –41.2kJ/mol则反应CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= (2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A.
 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变C.
 保持不变 D.
保持不变 D.
②P1
③C点
 的转化率为
的转化率为Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g) CH3OH(g) △H,②CO2(g)+3H2(g)
CH3OH(g) △H,②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2=-58 kJ·mol-1,③CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H2=-58 kJ·mol-1,③CO2(g)+H2(g) CO(g)+H2O(g△H3=+41 kJ·mol-1,回答下列问题:
CO(g)+H2O(g△H3=+41 kJ·mol-1,回答下列问题:
(1)利于提高反应①合成甲醇平衡产率的条件有______ 。
A.高温 B.低温 C.低压 D.高压 E.催化剂
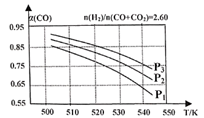
(2)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(a)与温度和压强的关系如图所示。图中的压强最大的是__________ ,解释a(CO)值随温度升高变化的原因__________ 。
(3)氮氧化物会对环境造成影响。
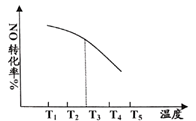
①处理汽车尾气中的氮氧化物可用NH3催化还原法,假设在恒容密闭容器中仅发生反应:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H<0,测得NO的平衡转化率随温度的变化关系如图2所示。已知温度为T3时反应达到平衡所需时间为12分钟。请在图中画出不同温度下,反应都在12分钟时,NO的转化率曲线示意图
4N2(g)+6H2O(g) △H<0,测得NO的平衡转化率随温度的变化关系如图2所示。已知温度为T3时反应达到平衡所需时间为12分钟。请在图中画出不同温度下,反应都在12分钟时,NO的转化率曲线示意图______ 。
②另一用NH3催化还原NOx消除氮氧化物污染的反应原理为:NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g)。在一定温度下,向某恒定压强为P的密闭容器中充入等物质的量的NO、NO2和NH3,达到平衡状态后,NO的转化率25%,请计算此时的平衡常数KP=
2N2(g)+3H2O(g)。在一定温度下,向某恒定压强为P的密闭容器中充入等物质的量的NO、NO2和NH3,达到平衡状态后,NO的转化率25%,请计算此时的平衡常数KP=____ 。(用含P的式子表示,且化至最简式)。【备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的体积分数。】
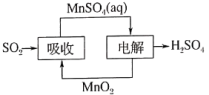
(4)工业生产中产生的SO2废气可用如图方法获得H2SO4。写出电解的阳极反应式____ 。
 CH3OH(g) △H,②CO2(g)+3H2(g)
CH3OH(g) △H,②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2=-58 kJ·mol-1,③CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H2=-58 kJ·mol-1,③CO2(g)+H2(g) CO(g)+H2O(g△H3=+41 kJ·mol-1,回答下列问题:
CO(g)+H2O(g△H3=+41 kJ·mol-1,回答下列问题:(1)利于提高反应①合成甲醇平衡产率的条件有
A.高温 B.低温 C.低压 D.高压 E.催化剂
(2)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(a)与温度和压强的关系如图所示。图中的压强最大的是

(3)氮氧化物会对环境造成影响。
①处理汽车尾气中的氮氧化物可用NH3催化还原法,假设在恒容密闭容器中仅发生反应:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) △H<0,测得NO的平衡转化率随温度的变化关系如图2所示。已知温度为T3时反应达到平衡所需时间为12分钟。请在图中画出不同温度下,反应都在12分钟时,NO的转化率曲线示意图
4N2(g)+6H2O(g) △H<0,测得NO的平衡转化率随温度的变化关系如图2所示。已知温度为T3时反应达到平衡所需时间为12分钟。请在图中画出不同温度下,反应都在12分钟时,NO的转化率曲线示意图
②另一用NH3催化还原NOx消除氮氧化物污染的反应原理为:NO(g)+NO2(g)+2NH3(g)
 2N2(g)+3H2O(g)。在一定温度下,向某恒定压强为P的密闭容器中充入等物质的量的NO、NO2和NH3,达到平衡状态后,NO的转化率25%,请计算此时的平衡常数KP=
2N2(g)+3H2O(g)。在一定温度下,向某恒定压强为P的密闭容器中充入等物质的量的NO、NO2和NH3,达到平衡状态后,NO的转化率25%,请计算此时的平衡常数KP=(4)工业生产中产生的SO2废气可用如图方法获得H2SO4。写出电解的阳极反应式

您最近一年使用:0次
【推荐2】采取高效经济方式利用 对人类社会发展具有重要意义。以
对人类社会发展具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
Ⅰ.

Ⅱ.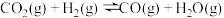
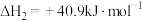
回答以下问题:
(1)已知: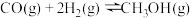
 ,则反应Ⅰ的
,则反应Ⅰ的
___________  。
。
(2)有利于提高 平衡转化率的措施有___________(填标号)。
平衡转化率的措施有___________(填标号)。
(3)在催化剂作用下,测得 平衡转化率(曲线Y)和平衡时
平衡转化率(曲线Y)和平衡时 的选择性(曲线X)随温度变化如图所示。(已知:
的选择性(曲线X)随温度变化如图所示。(已知: 的选择性
的选择性 )
)

① 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为___________ 。
②510K时,往恒容密闭容器中按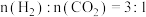 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内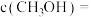
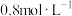 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
___________ (列计算式即可)。
(4) 和
和 在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
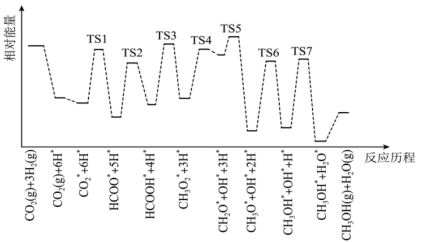
①气体在催化剂表面的吸附是___________ (填“吸热”或“放热”)过程。
②该反应历程中反应速率最快步骤的化学方程式为___________ 。
(5)甲醇催化制取丙烯( )的过程中发生如下反应:
)的过程中发生如下反应:
Ⅰ.
Ⅱ.
反应Ⅰ的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为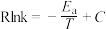 (
( 为活化能,
为活化能,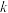 为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是___________ 。

 对人类社会发展具有重要意义。以
对人类社会发展具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):Ⅰ.


Ⅱ.
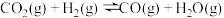
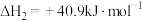
回答以下问题:
(1)已知:
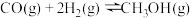
 ,则反应Ⅰ的
,则反应Ⅰ的
 。
。(2)有利于提高
 平衡转化率的措施有___________(填标号)。
平衡转化率的措施有___________(填标号)。A.增大 投料比 投料比 | B.增大压强 |
| C.使用高效催化剂 | D.及时将 分离 分离 |
 平衡转化率(曲线Y)和平衡时
平衡转化率(曲线Y)和平衡时 的选择性(曲线X)随温度变化如图所示。(已知:
的选择性(曲线X)随温度变化如图所示。(已知: 的选择性
的选择性 )
)
①
 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为②510K时,往恒容密闭容器中按
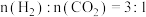 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内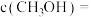
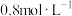 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
(4)
 和
和 在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
①气体在催化剂表面的吸附是
②该反应历程中反应速率最快步骤的化学方程式为
(5)甲醇催化制取丙烯(
 )的过程中发生如下反应:
)的过程中发生如下反应:Ⅰ.

Ⅱ.

反应Ⅰ的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为
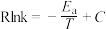 (
( 为活化能,
为活化能,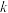 为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】某科研小组欲研究合成新型硝化剂反应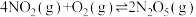 ,ΔH<0的反应。
,ΔH<0的反应。

(1)该反应的ΔS________ 0(填“ ”、“
”、“ ”或“
”或“ ”),在
”),在________ (高温或低温)条件下能自发进行。
(2)在一密闭容器内发生该反应,升高温度,平衡常数________ (填变大、变小或不变,下同),系统内气体的平均分子量________
(3)b,d两点对应的氧气的投入量相同,比较a、b、d点对应的平衡常数 、
、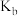 、
、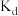 的大小
的大小________ (用 ,
, ,
, 连接)
连接)
(4)比较a、b、c三点所处的平衡状态中,反应物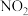 的转化率最大的是
的转化率最大的是________ (填字母),理由是________ 。
(5)若容器体积为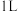 ,二氧化氮与氧气的初始量都为
,二氧化氮与氧气的初始量都为 ,
,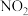 的平衡转化率为50%,起始时
的平衡转化率为50%,起始时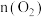 则此条件下
则此条件下 ,反应的平衡常数K=
,反应的平衡常数K=________ 。若保持温度不变,在某一时刻, ,此时平衡
,此时平衡________ (填向正反应方向、逆反应方向或不)移动。
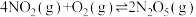 ,ΔH<0的反应。
,ΔH<0的反应。
(1)该反应的ΔS
 ”、“
”、“ ”或“
”或“ ”),在
”),在(2)在一密闭容器内发生该反应,升高温度,平衡常数
(3)b,d两点对应的氧气的投入量相同,比较a、b、d点对应的平衡常数
 、
、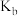 、
、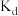 的大小
的大小 ,
, ,
, 连接)
连接)(4)比较a、b、c三点所处的平衡状态中,反应物
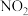 的转化率最大的是
的转化率最大的是(5)若容器体积为
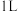 ,二氧化氮与氧气的初始量都为
,二氧化氮与氧气的初始量都为 ,
,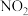 的平衡转化率为50%,起始时
的平衡转化率为50%,起始时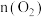 则此条件下
则此条件下 ,反应的平衡常数K=
,反应的平衡常数K= ,此时平衡
,此时平衡
您最近一年使用:0次



