下表为周期表的一部分,其中的字母编号代表对应的元素。
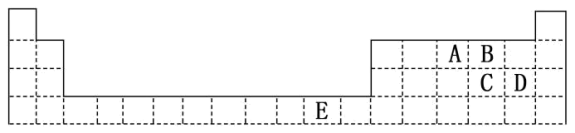
请回答下列问题:
(1)E原子的价层电子排布图为___________ ,其p电子的原子轨道呈___________ 形;
(2)B的氢化物比同族相邻元素氢化物沸点高,原因是___________ ;
(3)C、D的最高价含氧酸中酸性较强的是___________ (填化学式);该酸中阴离子的空间构型是___________ ,中心原子的杂化类型为___________ ;
(4)A和D形成的化合物AD3的电子式为___________ ,该物质水解生成碱性气体和漂白性物质,写出该反应的化学方程式___________ ;
(5)A的氢化物通入到E2+溶液中至过量所发生的离子反应方程式为___________ 、___________ ;

请回答下列问题:
(1)E原子的价层电子排布图为
(2)B的氢化物比同族相邻元素氢化物沸点高,原因是
(3)C、D的最高价含氧酸中酸性较强的是
(4)A和D形成的化合物AD3的电子式为
(5)A的氢化物通入到E2+溶液中至过量所发生的离子反应方程式为
更新时间:2021-10-14 23:01:40
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】Ⅰ.钒( )泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
)泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
(1)基态钒原子的价电子排布式为___________ ;与钒同周期的所有元素的基态原子中,未成对电子数最多的是___________ (填元素符号)。
Ⅱ. 为两性氧化物。
为两性氧化物。 溶解在稀硫酸中时,生成强氧化性的
溶解在稀硫酸中时,生成强氧化性的 ;
; 溶解在NaOH溶液中时,可得到
溶解在NaOH溶液中时,可得到 ,其空间构型与
,其空间构型与 相同。
相同。
(2)写出稀硫酸溶解 的化学方程式:
的化学方程式:___________ 。
(3) 中心原子价层孤电子对数目为___________。
中心原子价层孤电子对数目为___________。
(4)在碱性环境中,溶液中 与
与 可以相互转化。
可以相互转化。
① 转化为
转化为 的离子方程式为:
的离子方程式为:___________ 。
②室温下,当 时,1.0 mol⋅L-1
时,1.0 mol⋅L-1 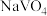 溶液中
溶液中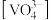 为0.10 mol⋅L-1。可知上述转化反应的平衡常数数值为
为0.10 mol⋅L-1。可知上述转化反应的平衡常数数值为___________ 。
Ⅲ.用活化后的 作催化剂,在有氧条件下氨气将NO还原成
作催化剂,在有氧条件下氨气将NO还原成 的一种反应历程如图所示。
的一种反应历程如图所示。
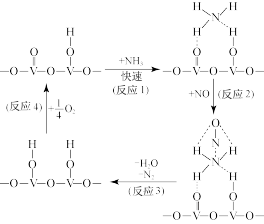
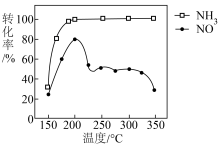
(5)上述历程中,钒元素被氧化的过程是反应___________ (填序号);写出总反应的化学方程式:___________ 。
(6)按上述图中 、NO和
、NO和 的比例进行催化脱硝反应。反应一定的时间,
的比例进行催化脱硝反应。反应一定的时间, 和NO的转化率与温度的关系如图所示。超过200℃后,NO转化率急剧下降,而
和NO的转化率与温度的关系如图所示。超过200℃后,NO转化率急剧下降,而 仍维持较高,原因可能是:
仍维持较高,原因可能是:___________ 。
 )泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。
)泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。(1)基态钒原子的价电子排布式为
Ⅱ.
 为两性氧化物。
为两性氧化物。 溶解在稀硫酸中时,生成强氧化性的
溶解在稀硫酸中时,生成强氧化性的 ;
; 溶解在NaOH溶液中时,可得到
溶解在NaOH溶液中时,可得到 ,其空间构型与
,其空间构型与 相同。
相同。(2)写出稀硫酸溶解
 的化学方程式:
的化学方程式:(3)
 中心原子价层孤电子对数目为___________。
中心原子价层孤电子对数目为___________。| A.0 | B.1 | C.2 | D.3 |
(4)在碱性环境中,溶液中
 与
与 可以相互转化。
可以相互转化。①
 转化为
转化为 的离子方程式为:
的离子方程式为:②室温下,当
 时,1.0 mol⋅L-1
时,1.0 mol⋅L-1 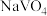 溶液中
溶液中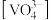 为0.10 mol⋅L-1。可知上述转化反应的平衡常数数值为
为0.10 mol⋅L-1。可知上述转化反应的平衡常数数值为Ⅲ.用活化后的
 作催化剂,在有氧条件下氨气将NO还原成
作催化剂,在有氧条件下氨气将NO还原成 的一种反应历程如图所示。
的一种反应历程如图所示。
(5)上述历程中,钒元素被氧化的过程是反应
(6)按上述图中
 、NO和
、NO和 的比例进行催化脱硝反应。反应一定的时间,
的比例进行催化脱硝反应。反应一定的时间, 和NO的转化率与温度的关系如图所示。超过200℃后,NO转化率急剧下降,而
和NO的转化率与温度的关系如图所示。超过200℃后,NO转化率急剧下降,而 仍维持较高,原因可能是:
仍维持较高,原因可能是:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】 、
、 和
和 均可用作电极材料。请回答下列问题:
均可用作电极材料。请回答下列问题:
(1)基态 的核外电子排布式为
的核外电子排布式为_____ ;在同周期元素中,基态原子的未成对电子数与基态 相同的元素为
相同的元素为_____ (填元素符号)。
(2) 可以与乙二胺(
可以与乙二胺( )形成配离子,如图所示:
)形成配离子,如图所示:
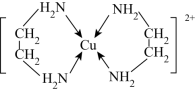
①C、N、O三种元素的第一电离能从大到小的顺序为_____ 。
②该配离子中的配体数与配位数之比为_____ 。
③以下三种分子:a. 、b.
、b. 、c.
、c. 。键角按由大到小的顺序排列:
。键角按由大到小的顺序排列:_____ (用序号表示)。
(3)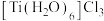 为紫色晶体,其中1mol阳离子中所含
为紫色晶体,其中1mol阳离子中所含 键的数目为
键的数目为_____ ;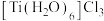 中存在的作用力类型有
中存在的作用力类型有_____ (填字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
(4)已知物质间的转化关系如图甲所示,其中a、c均大于0.
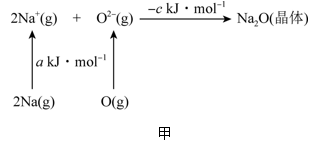
①基态Na原子的第一电离能可表示为_____ 。
②相同条件下, 的晶格能
的晶格能_____ (填“>”“<”或“=”) 。
。
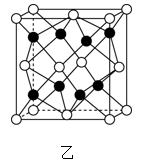
③ 的立方晶胞结构如图乙所示。若紧邻的两个
的立方晶胞结构如图乙所示。若紧邻的两个 之间的距离为dpm,阿伏加德罗常数的值为
之间的距离为dpm,阿伏加德罗常数的值为 ,晶体的密度为
,晶体的密度为 ,则
,则 的摩尔质量可表示为
的摩尔质量可表示为_____  (用含有d、
(用含有d、 、
、 的代数式表示)。
的代数式表示)。
 、
、 和
和 均可用作电极材料。请回答下列问题:
均可用作电极材料。请回答下列问题:(1)基态
 的核外电子排布式为
的核外电子排布式为 相同的元素为
相同的元素为(2)
 可以与乙二胺(
可以与乙二胺( )形成配离子,如图所示:
)形成配离子,如图所示:
①C、N、O三种元素的第一电离能从大到小的顺序为
②该配离子中的配体数与配位数之比为
③以下三种分子:a.
 、b.
、b. 、c.
、c. 。键角按由大到小的顺序排列:
。键角按由大到小的顺序排列:(3)
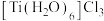 为紫色晶体,其中1mol阳离子中所含
为紫色晶体,其中1mol阳离子中所含 键的数目为
键的数目为 中存在的作用力类型有
中存在的作用力类型有A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
(4)已知物质间的转化关系如图甲所示,其中a、c均大于0.


①基态Na原子的第一电离能可表示为
②相同条件下,
 的晶格能
的晶格能 。
。③
 的立方晶胞结构如图乙所示。若紧邻的两个
的立方晶胞结构如图乙所示。若紧邻的两个 之间的距离为dpm,阿伏加德罗常数的值为
之间的距离为dpm,阿伏加德罗常数的值为 ,晶体的密度为
,晶体的密度为 ,则
,则 的摩尔质量可表示为
的摩尔质量可表示为 (用含有d、
(用含有d、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.硒-钴-镧(La)三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
(1)镧与Sc同族位于第六周期,镧位于元素周期表中_____ 区。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,则与之相反的用-
表示,则与之相反的用- 表示,称为电子的自旋磁量子数。对于基态Co原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Co原子,其核外电子自旋磁量子数的代数和为_____ 。
(3)一种含Se的新型AIE分子Ⅳ的合成路线如图:
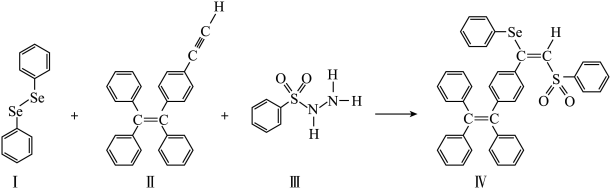
下列说法正确的是_____ 。
A.I中仅有σ键
B.I中Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型有sp、sp2和sp3
E.I~Ⅲ含有的元素中,O电负性最大
F.Ⅳ中具有孤电子对的原子有O和Se
(4)硒的某种氧化物为链状聚合结构,该氧化物的化学式为_____ 。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒,SeO 的立体构型为
的立体构型为_____ 。
Ⅱ.硼是第ⅢA族中唯一的非金属元素,可以形成众多的化合物。
(5)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是_____ 。
(6)氨硼烷(H3N·BH3)是目前最具潜力的储氢材料之一。氮硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N-H…H-B”表示。以下物质之间可能形成双氢键的是_____ 。
(1)镧与Sc同族位于第六周期,镧位于元素周期表中
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,则与之相反的用-
表示,则与之相反的用- 表示,称为电子的自旋磁量子数。对于基态Co原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Co原子,其核外电子自旋磁量子数的代数和为(3)一种含Se的新型AIE分子Ⅳ的合成路线如图:

下列说法正确的是
A.I中仅有σ键
B.I中Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中原子的杂化轨道类型有sp、sp2和sp3
E.I~Ⅲ含有的元素中,O电负性最大
F.Ⅳ中具有孤电子对的原子有O和Se
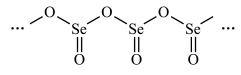
(4)硒的某种氧化物为链状聚合结构,该氧化物的化学式为
 的立体构型为
的立体构型为
Ⅱ.硼是第ⅢA族中唯一的非金属元素,可以形成众多的化合物。
(5)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据表中数据分析其原因是
| 化学键 | B-H | B-O | B-B |
| 键能/(kJ•mol-1) | 389 | 561 | 293 |
| A.H2O2和H2O | B.苯和三氯甲烷 | C.C2H4和C2H2 | D.B2H6和NH3 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是____ ,铜的基态原子核外电子排布式为______ 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________ 。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
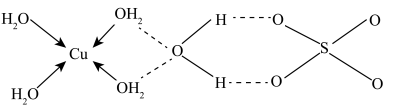
图中虚线表示_____________ ,SO42-的立体构型是__________ ,NO3-中N原子的杂化轨道类型是___________ ;O原子的价电子排布图为__________________ 。
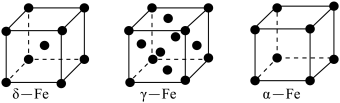
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为______ 。
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为________ 。

(1)铁元素在周期表中的位置是
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:

图中虚线表示
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为

(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的4种微粒,①锌:[Ar]3d104s2;②锌:[Ar]3d104s1;③铜:[Ar]3d104s1;④铜:[Ar]3d10。失去一个电子需要的最低能量由大到小的顺序是___ (填字母)。
A ④②①③ B ④②③① C ①②④③ D ①④③②
(2)砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为__ 。砷酸的酸性弱于硒酸,从分子结构的角度解释原因____ 。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为__ ,画出配离子的结构式__ (不考虑立体构型)。
(3)铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为___ 。
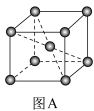
②铬的晶胞结构如图A所示,它的堆积模型为____ ,在该晶胞中铬原子的配位数为_____ 。
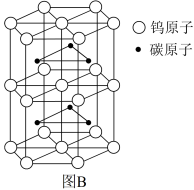
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为___ ,六棱柱的底边长为a cm,高为b cm,设阿伏加 德罗常数的值为NA,则碳化钨晶体的密度是___ g·cm-3(列出计算表达式)。
(1)现有铜锌元素的4种微粒,①锌:[Ar]3d104s2;②锌:[Ar]3d104s1;③铜:[Ar]3d104s1;④铜:[Ar]3d10。失去一个电子需要的最低能量由大到小的顺序是
A ④②①③ B ④②③① C ①②④③ D ①④③②
(2)砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为
(3)铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为
②铬的晶胞结构如图A所示,它的堆积模型为
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为


您最近一年使用:0次
【推荐3】如图为元素周期表的一部分,其中的编号代表对应不同的元素。
请回答下列问题:
(1)上表中属于d区的元素是___________ (填编号);元素⑨的基态原子简化电子排布式为___________ ;与⑩同周期且最外层电子数相同的元素还有___________ (填元素符号)。
(2)元素⑧被誉为“太空金属”,其基态原子核外共有___________ 种不同运动状态的电子,其中最高能层的电子占据能级的电子云轮廓图为___________ 。
(3)上表中某元素的特征电子排布式(价电子排布式)为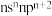 ,写出该元素简单氢化物与⑩的二价离子形成配离子的结构简式,并标出配位键
,写出该元素简单氢化物与⑩的二价离子形成配离子的结构简式,并标出配位键___________ ;该元素的简单氢化物的沸点比同族其它元素高,原因为___________ 。
(4)元素⑨(设为字母X)和Y(质子数为25)两元素的部分电离能数据如表:
比较两元素的 可知,气态
可知,气态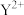 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是___________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | |||||||||||||||
| ⑧ | ⑨ | ⑩ |
(1)上表中属于d区的元素是
(2)元素⑧被誉为“太空金属”,其基态原子核外共有
(3)上表中某元素的特征电子排布式(价电子排布式)为
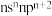 ,写出该元素简单氢化物与⑩的二价离子形成配离子的结构简式,并标出配位键
,写出该元素简单氢化物与⑩的二价离子形成配离子的结构简式,并标出配位键(4)元素⑨(设为字母X)和Y(质子数为25)两元素的部分电离能数据如表:
| 元素 | X | Y | |
电离能/( ) ) |  | 759 | 717 |
 | 1561 | 1509 | |
 | 2957 | 3248 | |
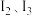 可知,气态
可知,气态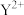 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硒酸铜晶体的分子式是CuSeO4•5H2O,淡蓝色晶体。有毒,能溶于水,微溶于丙酮,不溶于醇。80℃开始失水,150~220℃失去一个结晶水,265℃成为无水化合物。用于铜和铜合金着色,凯氏定氮催化剂,以及电子、仪表工业等。回答下列问题:
(1)铜元素位于元素周期表的____ ;基态Se原子的价电子排布式为____ ,基态Cu原子与基态Se原子核外未成对电子数之比为____ 。
(2)硒酸铜由硝酸铜和硒酸作用制取,硒酸酸性与硫酸比较,酸性较强的是____ (填化学式),S、Se、O电负性由大到小的顺序是____ 。
(3)硒酸铜中阴离子SeO 的空间结构为
的空间结构为____ 。在Cu的d轨道中电子排布成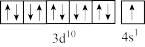 ,而不是
,而不是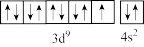 ,原因是
,原因是___ 。
(4)Cu2O熔点为1235℃,红色或暗红色八面立方晶系结晶,几乎不溶于水。Cu2O的晶体类型是___ ,熔点Cu2O>Cu2S的原因是____ 。
(5)铜的某种氧化物的晶胞如图所示,则该氧化物的化学式为___ ,若组成粒子氧、铜的半径分别为rOpm、rCupm,密度为ρg•cm-3,设阿伏加德罗常数值为NA,则该晶胞的空间利用率为___ (用含π的式子表示)。

(1)铜元素位于元素周期表的
(2)硒酸铜由硝酸铜和硒酸作用制取,硒酸酸性与硫酸比较,酸性较强的是
(3)硒酸铜中阴离子SeO
 的空间结构为
的空间结构为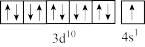 ,而不是
,而不是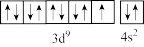 ,原因是
,原因是(4)Cu2O熔点为1235℃,红色或暗红色八面立方晶系结晶,几乎不溶于水。Cu2O的晶体类型是
(5)铜的某种氧化物的晶胞如图所示,则该氧化物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】根据题目要求,回答下列问题:
(1)下列现象和应用与电子跃迁无关的是___ 。
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用__ 形象化描述。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)__ I1(Cu)(填“大于”或“小于”)。原因是__ 。
(4)ZnF2具有较高的熔点(872℃),其化学键类型是___ ;
(5)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为___ ,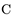 原子的杂化形式为
原子的杂化形式为__ 。
(6)与H2O分子互为等电子体的阴离子为__ 。
(7)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为__ 。
(8)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) ΔH=-313kJ/mol,F—F键的键能为159kJ/mol,Cl—Cl键的键能为242kJ/mol,则ClF3中Cl—F键的平均键能为__ kJ/mol。ClF3的熔、沸点比BrF3的__ (填“高”或“低”)。
(1)下列现象和应用与电子跃迁无关的是
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)
(4)ZnF2具有较高的熔点(872℃),其化学键类型是
(5)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为
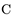 原子的杂化形式为
原子的杂化形式为(6)与H2O分子互为等电子体的阴离子为
(7)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(8)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) ΔH=-313kJ/mol,F—F键的键能为159kJ/mol,Cl—Cl键的键能为242kJ/mol,则ClF3中Cl—F键的平均键能为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】(1)C、N、O元素的第一电离能大小为:_________ 。
(2)Cu的价电子排布式 为______ ,基态Fe原子有_____ 个未成对电子,Fe3+的价电子排布图 为________ 。
(3)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________ 。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______ 。S8易溶于二硫化碳的原因是_________ 。
(4)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
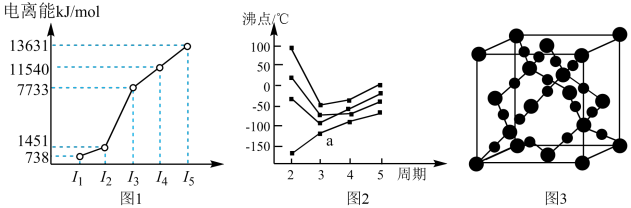
(a)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____ 种不同运动状态的电子。
(b)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于______ 晶体。
(c)如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___ 。判断依据____ 。
(2)Cu的
(3)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为

(4)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:

(a)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有
(b)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于
(c)如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个;F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)F的三种核素表示符号为_______ ,E的名称为_______ ,D的最高价氧化物的水化物的电子式:_______ 。
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是_______ ,离子半径最大的是_______ 。(填离子符号)
(3)A、B、C的氢化物稳定性顺序为_______ (用分子式表示);B的氢化物和B的最高价氧化物的水化物反应生成Z,反应中断裂化学键是_______ ,形成的化学键是_______ 。(填“离子键”、“极性键”、“非极性键”、“氢键”)
(4)F2C和F2E中,沸点较高的是_______ (填化学式),其主要原因是_______ 。
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_______ 。
(1)F的三种核素表示符号为
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是
(3)A、B、C的氢化物稳定性顺序为
(4)F2C和F2E中,沸点较高的是
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为
您最近一年使用:0次
【推荐2】A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多,C、D元素同主族且原子序数D为C的二倍,E元素的价电子排布式为(n-l)dn+6ns1。回答下列问题:
(1)元素B在周期表中的位置是___________________ ;E元素的元素符号为_______ ,
(2)D元素基态原子的价电子轨道排布图为_______ 。
(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,主要原因是_____________________ ;其中一种化合物可在酸性条件下将KMnO4还原为Mn2+,相关反应的离子方程式为____________________ 。
(1)元素B在周期表中的位置是
(2)D元素基态原子的价电子轨道排布图为
(3)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,主要原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子价电子排布式为___________ 。
(2)丁二酮肟( )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
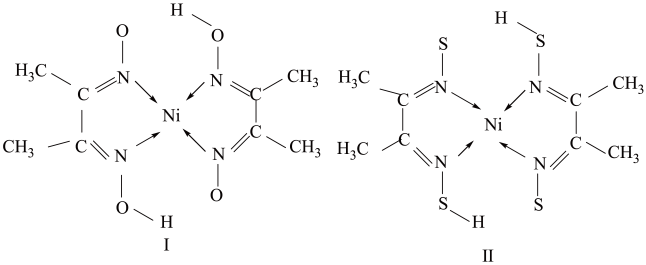
①下列说法正确的有___________ (填字母)。
A.在I中N元素的电负性最大 B.在I中C-C-C键角是180°
C.在II中-SH 上的S原子采取sp3杂化 D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是___________ 。
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。写出与SO 互为等电子体的一种分子
互为等电子体的一种分子___________ 。Fe、Co、Ni三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为___________ 。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。
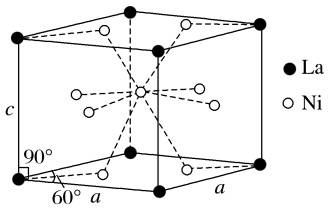
①设该合金的密度为dg/cm3,则该晶胞的体积为___________ cm3(用含 d的代数式表示,NA表示阿伏加德罗常数的值)
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力= 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为___________ (列出最简计算式,计算式不使用小数。NA表示阿伏加德罗常数的值)。
(1)基态镍原子价电子排布式为
(2)丁二酮肟(
 )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
①下列说法正确的有
A.在I中N元素的电负性最大 B.在I中C-C-C键角是180°
C.在II中-SH 上的S原子采取sp3杂化 D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。写出与SO
 互为等电子体的一种分子
互为等电子体的一种分子(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。

①设该合金的密度为dg/cm3,则该晶胞的体积为
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力=
 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
您最近一年使用:0次



