某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是___________ 。
(2)该反应中,发生还原反应的过程是___________ →___________ 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目___________
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为___________ 。
(5)完成并配平化学方程式:Na2Sx+NaClO+NaOH=Na2SO4+NaCl+H2O,___________ 。
(6)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为___________ 。
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(5)完成并配平化学方程式:Na2Sx+NaClO+NaOH=Na2SO4+NaCl+H2O,
(6)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为
更新时间:2021-12-18 16:19:20
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】氧化亚铜( )是一种鲜红色粉末状固体,几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
)是一种鲜红色粉末状固体,几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
①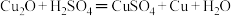
②
③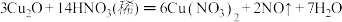
(1) 中
中 的化合价为
的化合价为_______ 。
(2)反应①中氧化剂为_______ ,还原剂为_______ 。
(3)反应②_______ (填“是”或“不是”)氧化还原反应;若是请说明转移电子情况,若不是请说明判断依据:_______
 )是一种鲜红色粉末状固体,几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
)是一种鲜红色粉末状固体,几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:①
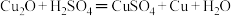
②

③
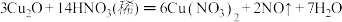
(1)
 中
中 的化合价为
的化合价为(2)反应①中氧化剂为
(3)反应②
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】水是生命之源,保护水资源人人有责。
Ⅰ.高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法是:在强碱性条件下,NaClO溶液和FeCl3溶液反应生成高铁酸钠和氯化钠。
(1)高铁酸钠中铁元素的化合价为_______ 。
(2)反应中高铁酸钠是_______ 产物(填“氧化”或“还原”)。
(3)写出制备高铁酸钠的离子方程式_______ 。
(4)使用氯气对自来水消毒时,氯气与水中的有机物反应生成对人体有害的物质,人们开始使用新的自来水消毒剂,如氯元素的某种氧化物,写出这种新消毒剂的名称_______ 。
Ⅱ.工业酸性废水中含有的重铬酸根离子(Cr2O )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,将Cr2O
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,将Cr2O 转化为Cr3+。
转化为Cr3+。
(5)绿矾是结晶水合物,风化是指在室温和干燥的空气里,结晶水合物失去结晶水的现象,则风化属于_______ 变化(填“物理”或“化学”)。
(6)在溶液中Cr2O 存在反应:Cr2O
存在反应:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+,该反应
+2H+,该反应_______ 氧化还原反应(填“属于”或“不属于”)。
(7)写出处理工业酸性废水时发生反应的离子方程式_______ 。
Ⅰ.高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法是:在强碱性条件下,NaClO溶液和FeCl3溶液反应生成高铁酸钠和氯化钠。
(1)高铁酸钠中铁元素的化合价为
(2)反应中高铁酸钠是
(3)写出制备高铁酸钠的离子方程式
(4)使用氯气对自来水消毒时,氯气与水中的有机物反应生成对人体有害的物质,人们开始使用新的自来水消毒剂,如氯元素的某种氧化物,写出这种新消毒剂的名称
Ⅱ.工业酸性废水中含有的重铬酸根离子(Cr2O
 )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,将Cr2O
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,将Cr2O 转化为Cr3+。
转化为Cr3+。(5)绿矾是结晶水合物,风化是指在室温和干燥的空气里,结晶水合物失去结晶水的现象,则风化属于
(6)在溶液中Cr2O
 存在反应:Cr2O
存在反应:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+,该反应
+2H+,该反应(7)写出处理工业酸性废水时发生反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________ 。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________ 。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________ 。
③已知断裂1mol化学键所需的能量如下:
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________ kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与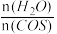 的关系如图2所示。
的关系如图2所示。
由图1可知,催化剂活性最大时对应的温度约为____________ ;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq) Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______ [已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
(1)将H2S通入FeCl3溶液中,该反应的还原产物为
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为
③已知断裂1mol化学键所需的能量如下:
| 化学键 | H—H | C═O | C═S | H—S | C≡O |
| E/kJ•mol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g)
 CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与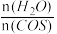 的关系如图2所示。
的关系如图2所示。

由图1可知,催化剂活性最大时对应的温度约为
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq)
 Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=
您最近一年使用:0次
【推荐1】回答下列问题:
(1)①H2+CuO Cu+H2O
Cu+H2O
②CaCO3+2HCl=CaCl2+CO2↑+H2O
③3S+6NaOH=2Na2S+Na2SO3+3H2O
④NH4NO3+Zn=ZnO+N2↑+2H2O
⑤Cu2O+4HCl=2HCuCl2+H2O。
上述反应中, 属于氧化还原反应的是___________ (填序号)。
(2)用双线桥法表示下述反应电子转移的方向和数目___________ 。MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(3)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反成来制备单质碘,其化学方程式为2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
①反应中___________ 元素被氧化,___________ 是氧化剂;
②用单线桥标法出电子转移方向和数目___________ 。
(1)①H2+CuO
 Cu+H2O
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O
③3S+6NaOH=2Na2S+Na2SO3+3H2O
④NH4NO3+Zn=ZnO+N2↑+2H2O
⑤Cu2O+4HCl=2HCuCl2+H2O。
上述反应中, 属于氧化还原反应的是
(2)用双线桥法表示下述反应电子转移的方向和数目
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(3)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反成来制备单质碘,其化学方程式为2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
①反应中
②用单线桥标法出电子转移方向和数目
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒的作用来清洗伤口。针对以下A—D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→NaCl+H2O2
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)上述反应中,H2O2仅体现氧化性的反应是____ (填字母,下同),H2O2仅体现还原性的反应是____ ,H2O2既体现氧化性又体现还原性的反应是____ 。
(2)请将D反应配平,并用单线桥标出D反应中电子转移的方向合数目:____ ,反应中氧化剂是____ ,被氧化的元素是____ ,氧化产物是____ 。
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:Fe3+、Mn2+、MnO 、H2O、Fe2+、H+,则反应的离子方程式为
、H2O、Fe2+、H+,则反应的离子方程式为____ 。
A.Na2O2+HCl→NaCl+H2O2
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)上述反应中,H2O2仅体现氧化性的反应是
(2)请将D反应配平,并用单线桥标出D反应中电子转移的方向合数目:
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:Fe3+、Mn2+、MnO
 、H2O、Fe2+、H+,则反应的离子方程式为
、H2O、Fe2+、H+,则反应的离子方程式为
您最近一年使用:0次
【推荐3】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
(1)用单线桥法分析上述反应(只需标出电子得失的方向和数目)
__________________________________________________________________ 。
(2)上述反应中氧化剂是__________ ,氧化产物是____________ 。
(3)上述反应中氧化剂与还原剂的物质的量之比为____________ 。
(4)若反应中转移了0.9 mol电子,产生的气体在标准状况下的体积是_______ 。
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
(1)用单线桥法分析上述反应(只需标出电子得失的方向和数目)
(2)上述反应中氧化剂是
(3)上述反应中氧化剂与还原剂的物质的量之比为
(4)若反应中转移了0.9 mol电子,产生的气体在标准状况下的体积是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
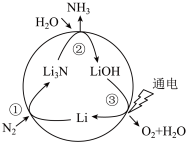
【推荐1】研究氮及其化合物的性质对改善人类的生存环境具有重要意义。回答下列问题:
(1)一种新型人工固氮的原理如图。该转化过程①②③反应中为氧化还原反应的是___________ (填编号)。假设每一步均完全转化,每生成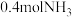 ,同时生成
,同时生成___________ 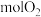 。
。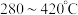 的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出
的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出 消除
消除 的化学反应方程式:
的化学反应方程式:___________ 。
(3)废水中氮的主要存在形态是硝态氮(以 存在)和氨氮(以
存在)和氨氮(以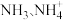 存在),还原法和氧化法是去除废水中氮的重要方法。
存在),还原法和氧化法是去除废水中氮的重要方法。
①还原法:控制其他条件相同,去除 的某含氮废水(废水中总氮
的某含氮废水(废水中总氮 )中的硝态氮,图1为只加过量
)中的硝态氮,图1为只加过量 、图2为同时加过量
、图2为同时加过量 粉与
粉与 时废水中含氮微粒的浓度随时间变化的图像。
时废水中含氮微粒的浓度随时间变化的图像。 的离子方程式为
的离子方程式为___________ ;图2中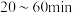 内发生主要反应的离子方程式为
内发生主要反应的离子方程式为___________ 。
②氧化法:利用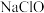 将水体中氨氮氧化为
将水体中氨氮氧化为 。已知氧化性:
。已知氧化性: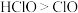 。研究发现,控制其他条件相同,当废水
。研究发现,控制其他条件相同,当废水 为
为 范围内,氨氮去除率随
范围内,氨氮去除率随 降低而升高,分析原因是
降低而升高,分析原因是___________ 。
(1)一种新型人工固氮的原理如图。该转化过程①②③反应中为氧化还原反应的是
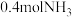 ,同时生成
,同时生成 。
。
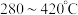 的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出
的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出 消除
消除 的化学反应方程式:
的化学反应方程式:(3)废水中氮的主要存在形态是硝态氮(以
 存在)和氨氮(以
存在)和氨氮(以 存在),还原法和氧化法是去除废水中氮的重要方法。
存在),还原法和氧化法是去除废水中氮的重要方法。①还原法:控制其他条件相同,去除
 的某含氮废水(废水中总氮
的某含氮废水(废水中总氮 )中的硝态氮,图1为只加过量
)中的硝态氮,图1为只加过量 、图2为同时加过量
、图2为同时加过量 粉与
粉与 时废水中含氮微粒的浓度随时间变化的图像。
时废水中含氮微粒的浓度随时间变化的图像。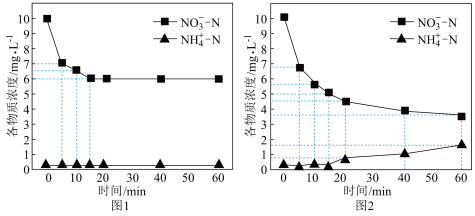
 的离子方程式为
的离子方程式为 内发生主要反应的离子方程式为
内发生主要反应的离子方程式为②氧化法:利用
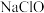 将水体中氨氮氧化为
将水体中氨氮氧化为 。已知氧化性:
。已知氧化性: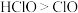 。研究发现,控制其他条件相同,当废水
。研究发现,控制其他条件相同,当废水 为
为 范围内,氨氮去除率随
范围内,氨氮去除率随 降低而升高,分析原因是
降低而升高,分析原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】“环境是民生,青山是美丽,蓝天是幸福”。我们必须正视、着力解决环境污染问题。
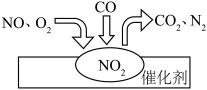
Ⅰ汽车尾气净化装置“催化转化器”是防止尾气(含CO、NOx等气体)污染的有效方法,能使尾气中的一氧化碳和氮氧化物发生反应生成可参与大气生态循环的无毒气体。
(1)汽车尾气中易造成光化学烟雾的物质是_______ 。
a.氮氧化物 b.二氧化碳 c.一氧化碳
(2)汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,反应的化学方程式为_______ 。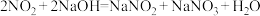 。若反应时消耗了10L0.2mol⋅L-1的NaOH溶液,则反应中转移电子的物质的量
。若反应时消耗了10L0.2mol⋅L-1的NaOH溶液,则反应中转移电子的物质的量_______ mol。
Ⅱ硫有多种化合物,如H2S、SO2等含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(4)煤液化过程中产生的H2S可生产硫酸,部分过程如图a所示,SO2反应器中在催化加热条件下反应的化学方程式是_______ 。 而实现SO2的回收利用,写出Fe3+将SO2氧化成
而实现SO2的回收利用,写出Fe3+将SO2氧化成 反应的离子方程式
反应的离子方程式_______ 。
(6)某企业利用下列流程(如图b)综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。该流程中可循环利用的物质为_______ (填化学式)。
Ⅰ汽车尾气净化装置“催化转化器”是防止尾气(含CO、NOx等气体)污染的有效方法,能使尾气中的一氧化碳和氮氧化物发生反应生成可参与大气生态循环的无毒气体。
(1)汽车尾气中易造成光化学烟雾的物质是
a.氮氧化物 b.二氧化碳 c.一氧化碳
(2)汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,反应的化学方程式为
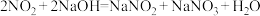 。若反应时消耗了10L0.2mol⋅L-1的NaOH溶液,则反应中转移电子的物质的量
。若反应时消耗了10L0.2mol⋅L-1的NaOH溶液,则反应中转移电子的物质的量Ⅱ硫有多种化合物,如H2S、SO2等含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(4)煤液化过程中产生的H2S可生产硫酸,部分过程如图a所示,SO2反应器中在催化加热条件下反应的化学方程式是

 而实现SO2的回收利用,写出Fe3+将SO2氧化成
而实现SO2的回收利用,写出Fe3+将SO2氧化成 反应的离子方程式
反应的离子方程式(6)某企业利用下列流程(如图b)综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。该流程中可循环利用的物质为
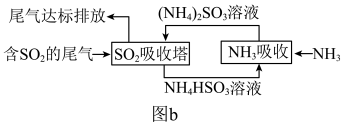
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
| 实验现象 | 离子方程式 |
| 1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | |
| 2.制备氢氧化铁胶体的化学方程式 | |
| 3.二氧化硫使酸性高锰酸钾溶液褪色 | |
| 4.Fe3O4溶于稀硝酸 | |
| 5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | |
| 6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | |
| 7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | |
| 8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | |
| 9.FeI2与Cl2物质的量1∶2反应 | |
| 10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | |
| 11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | |
| 12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | |
| 13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其中加碘盐是氯化钠中添加适量的 ,其他成分未列出)
,其他成分未列出)
(1)请你对表中①~⑦的主要成分进行分类,是电解质的是_______ ,是非电解质的是_______ 。(填序号)
(2)写出④在水中的电离方程式_______ 。
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的化学方程式:_______ 。
(4)已知 的①和CO的混合气体共7.6 g,则①的质量为
的①和CO的混合气体共7.6 g,则①的质量为_______ g。
Ⅱ.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为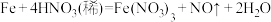 。
。
(5)反应中氧化剂与还原剂的个数之比为_______ ,其中 反应中显示出来的性质是
反应中显示出来的性质是_______
(6)该反应中的氧化产物为_______ ,每生成11.2L(标准状况下)的NO,转移的电子个数为_______ 。
(7)请用双线桥标出电子转移的情况_______ 。
 ,其他成分未列出)
,其他成分未列出)| 名称 | 天然气 | 白酒 | 醋酸 | 小苏打 | 熟石灰 | 铜线 | 加碘盐 |
| 主要成分 | ① | ②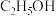 | ③ | ④ | ⑤ | ⑥Cu | ⑦ 和 和 混合 混合 |
(2)写出④在水中的电离方程式
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的化学方程式:
(4)已知
 的①和CO的混合气体共7.6 g,则①的质量为
的①和CO的混合气体共7.6 g,则①的质量为Ⅱ.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为
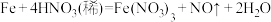 。
。(5)反应中氧化剂与还原剂的个数之比为
 反应中显示出来的性质是
反应中显示出来的性质是(6)该反应中的氧化产物为
(7)请用双线桥标出电子转移的情况
您最近一年使用:0次
【推荐2】将质量为12.64gKMnO4固体加热一段时间后,收集到amol O2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中.(KMnO4 的摩尔质量为158g/mol )
(1)请完成并配平下列化学方程式:
_ K2Mn04+__ HCl﹣﹣﹣﹣__ KCl+__ MnCl2+__ Cl2↑+___
该反应中的还原剂是_____ ,当该反应中转移NA个电子时,氧化产物的物质的量为_____ mol,被氧化的还原剂的物质的量为_____ mol.
(2)用酸性高锰酸钾溶液滴定FeSO4溶液写出该反应的离子方程式:_____ .
(3)当KMnO4固体加热生成O2 amol值最大时,向反应后残留的固体中加入足量的浓盐酸并加热,产生Cl2的物质的量b=_____ mol.(此时Mn元素全部以Mn2+的形式存在于溶液中)
(1)请完成并配平下列化学方程式:
该反应中的还原剂是
(2)用酸性高锰酸钾溶液滴定FeSO4溶液写出该反应的离子方程式:
(3)当KMnO4固体加热生成O2 amol值最大时,向反应后残留的固体中加入足量的浓盐酸并加热,产生Cl2的物质的量b=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)NH3是_____ 剂(填“氧化”或“还原”),在该反应中体现_____ 性(填“氧化”或“还原’);Cl2在该反应中_____ (填”得到“或”失去)电子,发生____ 反应(填“氧化”或“还原”)。
(2)氧化剂与还原剂的分子数之比为_____ 。
(3)当有4个NH3参加反应时,转移的电子个数为____ 。
(4)用双线桥的方法表示该反应的电子转移情况: 8NH3+3Cl2=6NH4Cl+N2____ 。
(5)用单线桥表示此反应中的电子转移情况: 8NH3+3Cl2=6NH4Cl+N2____ 。
(1)NH3是
(2)氧化剂与还原剂的分子数之比为
(3)当有4个NH3参加反应时,转移的电子个数为
(4)用双线桥的方法表示该反应的
(5)用单线桥表示此反应中的
您最近一年使用:0次



