 加氢制甲醇技术既能解决温室效应等环境问题,又能有效提高资源的利用率。回答下列问题:
加氢制甲醇技术既能解决温室效应等环境问题,又能有效提高资源的利用率。回答下列问题:(1)
 加氢分别生成甲醇和CO是最重要的两个基本反应,其反应如下:
加氢分别生成甲醇和CO是最重要的两个基本反应,其反应如下:
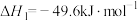 ①
①
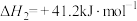 ②
②
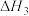 ③
③则反应③的
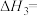
 。
。(2)
 加氢生成甲醇适宜在
加氢生成甲醇适宜在(3)在一恒温、容积可变的密闭容器中,充入1mol
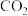 与3mol
与3mol  发生反应:
发生反应: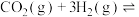
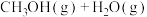 ,
, 在温度T下的平衡转化率与总压强的关系如图1所示,图中M点时
在温度T下的平衡转化率与总压强的关系如图1所示,图中M点时 的物质的量分数为
的物质的量分数为
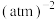 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。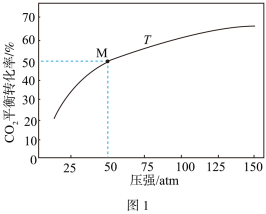
(4)
 也可以通过电化学方法转化为
也可以通过电化学方法转化为 ,装置如图2所示。阴极的电极反应式为
,装置如图2所示。阴极的电极反应式为 。
。
相似题推荐
 CO2(g)+H2(g) △H=-41.2 kJ·mol-1,该反应是当前大规模获取清洁能源H2
CO2(g)+H2(g) △H=-41.2 kJ·mol-1,该反应是当前大规模获取清洁能源H2 的方法之一,也是为合成氨工业提供生产原料的反应。
的方法之一,也是为合成氨工业提供生产原料的反应。(1)实际生产中,考虑生产成本,应提高
若同时提高氢气的产率,可采取的下列措施有
a.增大CO浓度 b.增大H2O(g)浓度 c.增大压强 d.适当降低温度 e.分离出CO2
(2)若在800℃的恒容密闭容器中,充入1 mol CO和3 mol H2O,达平衡时CO转化率为75%。该反应的平衡常数为
(3)一定温度下,向该反应体系投入生石灰可增大H2的体积分数。根据CO2(g)+CaO(s)=CaCO3(s) △H=-178 kJ·mol-1;△S=-169.3 J·mol-1·K-1,用此方法增大H2的体积分数需
(4)上述体系制成的H2含有一定量的CO,若用于合成氨,其中的CO会造成催化剂“中毒”。有人从工业提纯粗镍的反应Ni(s)+4CO(g)
 Ni(CO)4(g) △H<0得到启发,应用金属镍除去H2中的CO,且金属镍可循环使用。查阅资料可知,实际生产中分别在不同条件应用该反应:温度为200℃、50℃;压强为1 MPa、12 MPa。则适宜吸收CO的温度和压强是
Ni(CO)4(g) △H<0得到启发,应用金属镍除去H2中的CO,且金属镍可循环使用。查阅资料可知,实际生产中分别在不同条件应用该反应:温度为200℃、50℃;压强为1 MPa、12 MPa。则适宜吸收CO的温度和压强是(1)已知:
NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1
N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1
2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1
若NO2气体和CO 气体反应生成无污染气体,其热化学方程式为
(2) 由CO生成CO2的化学方程式为CO+O2
 CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=(3)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
①图中a、b 分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是
②T℃时,该反应的化学平衡常数K=
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将x mol NH4NO3溶于水,溶液显酸性,原因是
(1)市售过氧乙酸的浓度一般不超过21%,原因是
(2)利用上述反应制备760 g CH3CO3H,放出的热量为
(3)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。
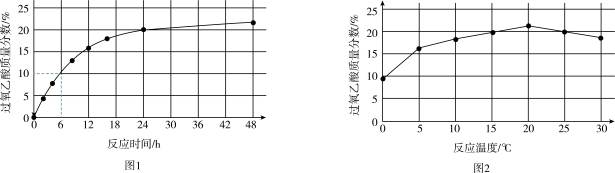
①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间,v(CH3CO3H)=
②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是
(4) SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40 nm和70 nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
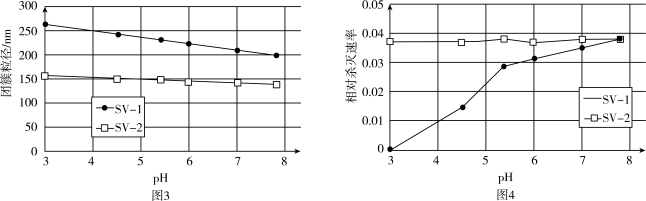
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
Ⅰ.将CO2转化为炭黑进行回收利用,反应原理如图所示。
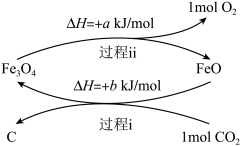
(1)从能量角度分析FeO的作用是
(2)写出炭黑和氧气转化为CO2的热化学方程式:
Ⅱ.以CO2和甲醇为原料直接合成碳酸二甲酯(CH3OCOOCH3)的反应为:
CO2(g)+2CH3OH(g)
 CH3OCOOCH3(g)+H2O(g) ΔH
CH3OCOOCH3(g)+H2O(g) ΔH在不同的实验条件下,测定甲醇的转化率。温度的数据结果为图a,压强的数据结果在图b中未画出。
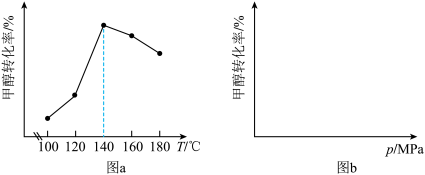
(3)该反应的ΔH
(4)在100~140℃之间,随着温度升高,甲醇转化率增大的原因是
(5)在图b中绘制出压强和甲醇转化率之间的关系(作出趋势即可)。
Ⅲ.利用Al-CO2电池(工作原理如下图所示)能有效地将CO2转化成化工原料草酸铝。
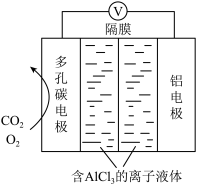
(6)电池的总反应式为
(7)电池的正极反应式:2CO2+2e-=C2O
 (草酸根)正极反应过程中,O2是催化剂,催化过程可表示为:
(草酸根)正极反应过程中,O2是催化剂,催化过程可表示为:①6O2+6e-=6O

②……
写出反应②的离子方程式:
(1)工业上,常用
 检验输送氯气的管道是否泄漏。
检验输送氯气的管道是否泄漏。已知:
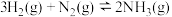
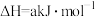
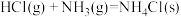
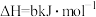


反应
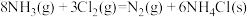 的
的
 。
。(2)氯乙烷是重要的含氯化合物,常用于医药、农药的制造。可用乙烯和氯化氢反应制备氯乙烷,反应方程式为
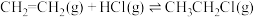 。在1L恒温恒容密闭容器中充入2.5
。在1L恒温恒容密闭容器中充入2.5
 和1.5
和1.5
 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 及
及 的物质的量随时间变化如图1所示:
的物质的量随时间变化如图1所示:
①12.5s时反应恰好达到平衡,则0~12.5s内,
 的平均反应速率为
的平均反应速率为 。
。②第一次平衡时,
 的平衡转化率为
的平衡转化率为③在第20s时,仅改变了某一个条件,则改变的条件是

④在1L的恒温恒容密闭容器中发生上述反应,下列能说明反应已经达到平衡的是
A.容器内气体的总压强不变
B.容器内碳元素的质量分数不变
C.单位时间内,断裂1

 键的同时,有1
键的同时,有1
 键形成
键形成D.容器内气体的密度不变
(3)工业上常用氯苯(
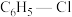 )和硫化氢(
)和硫化氢( )反应来制备一种用途广泛的有机合成中间体苯硫酚(
)反应来制备一种用途广泛的有机合成中间体苯硫酚( ),但会有副产物苯(
),但会有副产物苯( )生成,发生的反应如下:
)生成,发生的反应如下:I.

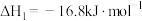 ;
;II.
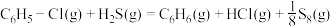
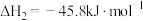 。
。现将一定量的
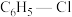 和
和 置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20min,测定生成物的浓度,得到图2和图3(R为
置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20min,测定生成物的浓度,得到图2和图3(R为 与
与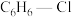 的起始物质的量之比)。
的起始物质的量之比)。
结合图2和图3,该模拟工业生产制备
 的适宜条件为
的适宜条件为(1)已知相关反应的热力学数据如下表所示:
| 反应 | 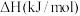 | 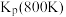 | |
| Ⅰ |  |  | |
| Ⅱ | 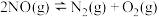 |  | |
| Ⅲ | 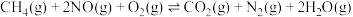 | a | |
| Ⅳ |  | b |
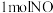 时,反应
时,反应 的能量;
的能量;②
 时,另一脱硝反应
时,另一脱硝反应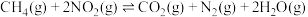 的
的
(2)模拟工业尾气脱硝:一定条件下,将
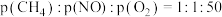 的气体与
的气体与 混合,均匀通过催化脱硝反应器,测得
混合,均匀通过催化脱硝反应器,测得 内
内 去除率与
去除率与 转化率随反应温度的变化如图所示.
转化率随反应温度的变化如图所示.
 的去除率最高的原因是
的去除率最高的原因是②若只考虑反应Ⅰ和Ⅲ,则温度为T时,
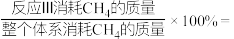
③
 时,为提高反应Ⅲ中
时,为提高反应Ⅲ中 的平衡转化率,理论上能采取的措施是
的平衡转化率,理论上能采取的措施是A.适当降低温度 B.加入少量生石灰
C.恒容充入更多
 D.使用更高效的催化剂
D.使用更高效的催化剂
(1)亚磷酸是
(2)PCl3水解可制取亚磷酸,反应的化学方程式是
(3)在H3PO3溶液中存在电离平衡: H3PO3
 H++H2PO
H++H2PO
①某温度下0.10mol·L-1H3PO3溶液pH=1.6,即溶液中c(H+)=2.5
 10-2 mol·L-1,求该温度下,上述电离平衡的平衡常数K=
10-2 mol·L-1,求该温度下,上述电离平衡的平衡常数K= 只考虑H3PO3的第一步电离,结果保留两位有效数字
只考虑H3PO3的第一步电离,结果保留两位有效数字 。
。②Na2HPO3溶液中离子浓度由大到小的顺序是
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:

①阴极的电极反应为
②产品室中反应的离子方程式为
(5)亚磷酸具有强还原性,可将
 还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为
还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为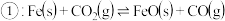 ,其平衡常数为
,其平衡常数为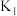 ,化学反应
,化学反应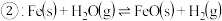 ,其平衡常数为
,其平衡常数为 ,在温度
,在温度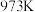 和
和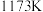 情况下,
情况下,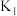 、
、 的值分别如下:
的值分别如下:| 温度 | 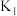 |  |
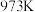 | 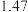 | 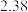 |
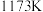 |  | 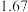 |
(1)通过表格中的数值可以推断:反应
 是
是 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。(2)现有反应
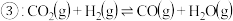 ,请你写出该反应的平衡常数
,请你写出该反应的平衡常数 的表达式:
的表达式: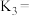
(3)在相同温度下,根据反应
 与
与 可推导出
可推导出 与
与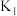 、
、 之间的关系式
之间的关系式 是
是(4)要使反应
 在一定条件下建立的平衡向正反应方向移动,可采取的措施有_______(填写字母序号,下同)。
在一定条件下建立的平衡向正反应方向移动,可采取的措施有_______(填写字母序号,下同)。| A.增大压强 | B.体积不变时充入稀有气体 | C.升高温度 | D.使用合适的催化剂 |
 的可逆反应
的可逆反应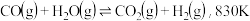 时,若起始时:
时,若起始时: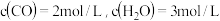 ,平衡时
,平衡时 的转化率为
的转化率为 ,水蒸气的转化率为
,水蒸气的转化率为 的数值为
的数值为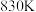 ,若只将起始时
,若只将起始时 改为
改为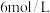 ,则水蒸气的转化率为
,则水蒸气的转化率为【推荐3】氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用。回答下列问题:
(1)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
在恒温、恒容的密闭容器中,合成氨反应的各物质浓度的变化曲线如图所示。
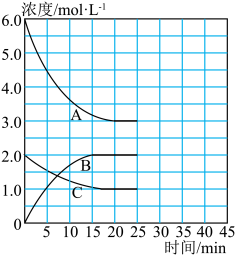
①计算在该温度下反应2NH3(g) N2(g)+3H2(g)的平衡常数K=
N2(g)+3H2(g)的平衡常数K=
②在第25min末,保持其它条件不变,若将温度降低,在第35min末再次达到平衡。在平衡移动过程中N2浓度变化了0.5mol/L,请在图中画出25-40minNH3浓度变化曲线。
③已知:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g)△H=+1530.0kJ/mol,则氢气的热值为
4NH3(g)+3O2(g)△H=+1530.0kJ/mol,则氢气的热值为
(2)① N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,请解释为什么用过量氨气反应的原因:
②用NaClO与NH3制N2H4的反应是相当复杂的,主要分为两步:
已知第一步:NH3+ClO-=OH-+NH2Cl
请写出第二步离子方程式:
③ N2H4易溶于水,是与氨相类似的弱碱,已知其常温下电离常数K1=1.0×10-6,常温下,将0.2 mol/L N2H4·H2O与0.lmol/L,盐酸等体积混合(忽略体积变化)。则此时溶液的pH等于
| 元素 | 元素相关信息 |
 | 原子获得2个电子达到 原子结构 原子结构 |
 | 同周期主族元素中原子半径最大 |
 | 最高价氧化物既可以与酸反应,又可以与碱反应 |
 | 原子最外层电子数是 原子最外层电子数的2倍 原子最外层电子数的2倍 |
 | 原子核内所含质子数比 多6 多6 |
(1)W在元素周期表中的位置是
 组成的化合物所含化学键类型为
组成的化合物所含化学键类型为 与
与 的最高价氧化物对应水化物酸性强弱比较
的最高价氧化物对应水化物酸性强弱比较(2)
 最高价氧化物对应水化物相互反应的离子方程式为
最高价氧化物对应水化物相互反应的离子方程式为(3)将
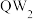 通入氯化钡溶液中,无明显现象,再向其中通入
通入氯化钡溶液中,无明显现象,再向其中通入 单质,观察到的现象是
单质,观察到的现象是(4)无隔膜电解海水制
 ,生产过程中阳极生成HRW,则阳极的电极反应为
,生产过程中阳极生成HRW,则阳极的电极反应为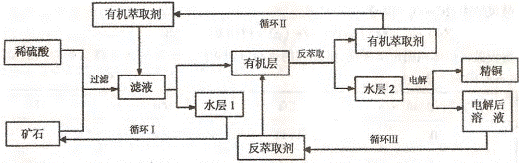
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
(2)将有机层和水层分离的操作方法叫
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是
(4)写出电解过程中(两电极都是惰性电极)阴极发生反应的电极反应式
(5)“循环Ⅲ”中反萃取剂的主要成分是
⑴NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为
⑵汽车尾气中催化剂可将NO、CO转化成无害气体。
| 化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
| 键能/kJ·mol1 | 1076 | 630 | 945 | 803 |
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH
①ΔH=
②该反应的平衡常数与外界因素X(代表温度、压强、
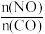 或催化剂接触面)关系如下图所示。
或催化剂接触面)关系如下图所示。
X是
⑶在一定温度和催化剂作用下,8NH3(g)+8NO(g)+2NO2(g)⇌9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1。
①n=
②υ(NO)=
③NH3的平衡转化率为
⑷用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将




