氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运;氨气及铵盐同时也是空气和水体污染物,需用化学方法除去。
Ⅰ.氨热分解法制氢气:
(1)已知反应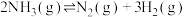
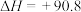 kJ/mol,在
kJ/mol,在___________ (较高/较低)温度下反应能自发进行。
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
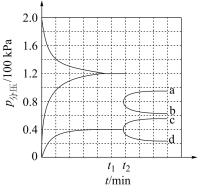
①若保持容器体积不变, 时反应达到平衡,用H2的浓度变化表示0~
时反应达到平衡,用H2的浓度变化表示0~ 时间内的反应速率v(H2)
时间内的反应速率v(H2)______  (用含
(用含 的代数式表示)
的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是______ (用图中a、b、c、d表示)。
③下列措施一定可以提高平衡体系中 的体积分数,又能加快反应速率的是
的体积分数,又能加快反应速率的是___________ 。
a.适当升高温度 b.适当降低温度 c.加入催化剂 d.降低压强 e.将生成物中的氮气液化分离出体系
(3)Ⅱ:某研究小组用NaClO氧化法处理氨氮废水,使氨氮(包含 、
、 等微粒)完全氧化成氮气而减少水污染。氧化过程中进水pH对氨氮去除率的影响如图所示:
等微粒)完全氧化成氮气而减少水污染。氧化过程中进水pH对氨氮去除率的影响如图所示:
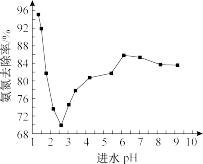
(已知:HClO的氧化性比NaClO强;NH3比 更易被氧化)
更易被氧化)
①氨氮去除率随进水pH的增大先降低后升高的原因为___________ 。
②电化学除氨原理为:氨氮被电极表面产生的强氧化性物质氧化而去除,实际过程中在氨氮废水中投加氯离子,能显著提高去除效率,其原因是___________ 。(排除导电性变化原因)
Ⅰ.氨热分解法制氢气:
(1)已知反应
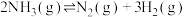
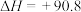 kJ/mol,在
kJ/mol,在(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol
 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,
 时反应达到平衡,用H2的浓度变化表示0~
时反应达到平衡,用H2的浓度变化表示0~ 时间内的反应速率v(H2)
时间内的反应速率v(H2) (用含
(用含 的代数式表示)
的代数式表示)②
 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是③下列措施一定可以提高平衡体系中
 的体积分数,又能加快反应速率的是
的体积分数,又能加快反应速率的是a.适当升高温度 b.适当降低温度 c.加入催化剂 d.降低压强 e.将生成物中的氮气液化分离出体系
(3)Ⅱ:某研究小组用NaClO氧化法处理氨氮废水,使氨氮(包含
 、
、 等微粒)完全氧化成氮气而减少水污染。氧化过程中进水pH对氨氮去除率的影响如图所示:
等微粒)完全氧化成氮气而减少水污染。氧化过程中进水pH对氨氮去除率的影响如图所示:
(已知:HClO的氧化性比NaClO强;NH3比
 更易被氧化)
更易被氧化)①氨氮去除率随进水pH的增大先降低后升高的原因为
②电化学除氨原理为:氨氮被电极表面产生的强氧化性物质氧化而去除,实际过程中在氨氮废水中投加氯离子,能显著提高去除效率,其原因是
更新时间:2022-03-29 18:41:39
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】近几个月,古城西安的大街上新添了很多橙黄色的汽车。这款被称作“小黄蜂”的出租车是由清洁的甲醇燃料驱动的。使用甲醇燃料可以有效的减少汽车尾气的排放,对西安市治污减霾工作有重要的意义。工业上常用CO和 合成甲醇,反应方程式为
合成甲醇,反应方程式为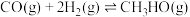
 。
。
(1)在T1时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数
的体积分数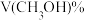 与
与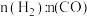 的关系如图1所示。
的关系如图1所示。
①当起始 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则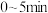 内平均反应速率
内平均反应速率
_______ 。若此时再向容器中加入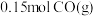 和
和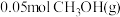 ,达新平衡时
,达新平衡时 的转化率将
的转化率将_______ (填“增大”“减小”或“不变”)。
②当起始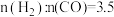 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图象中的
的体积分数可能是图象中的_______ 点(填“D”“E”或“F”)。
(2)若CO2的转化率与压强、温度的关系可由图2表示。
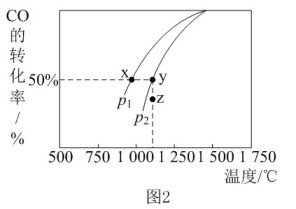
①由图2可知该反应的
_______ 0(填“ ”“
”“ ”或“
”或“ ”,下同),压强p1
”,下同),压强p1_______ p2;当压强为p2时,在y点:v正_______ v逆。
②以甲醇为燃料、强碱溶液作电解质溶液的新型手机电池,充满电后可连续使用一个月,试写出放电时,负极的电极反应为:_______ 。
 合成甲醇,反应方程式为
合成甲醇,反应方程式为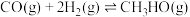
 。
。(1)在T1时,体积为2L的恒容容器中充入物质的量之和为3mol的
 和CO,达到平衡时
和CO,达到平衡时 的体积分数
的体积分数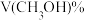 与
与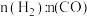 的关系如图1所示。
的关系如图1所示。
①当起始
 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则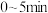 内平均反应速率
内平均反应速率
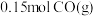 和
和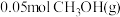 ,达新平衡时
,达新平衡时 的转化率将
的转化率将②当起始
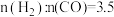 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图象中的
的体积分数可能是图象中的(2)若CO2的转化率与压强、温度的关系可由图2表示。

①由图2可知该反应的

 ”“
”“ ”或“
”或“ ”,下同),压强p1
”,下同),压强p1②以甲醇为燃料、强碱溶液作电解质溶液的新型手机电池,充满电后可连续使用一个月,试写出放电时,负极的电极反应为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】I.1mol CO2与足量的碳在恒容密闭容器中反应:C(s)+CO2(g)  2CO(g)。测得平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。测得平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(p分)=气体总压(p总)×体积分数。
请回答:
(1)判断该反应的自发性并说明理由___________ 。
(2)下列说法正确的是___________。
(3)1×103K时,起始压强为100KPa,反应一段时间达到平衡,用平衡分压p(B)代替平衡浓度表示的化学平衡常数Kp=___________ KPa (保留三位有效数字)。【p(B)= p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数】
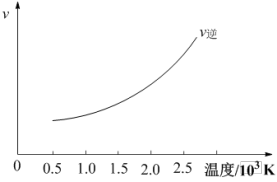
(4)已知,在上述条件下(初始投料为1molCO2与足量的碳,恒容密闭容器中),在给定CO2的转化率为25.0 %时,V逆随温度的变化曲线如下图所示,画出V正随温度(0.5×103K至2.5×103K)的变化曲线___________ 。
II.碘酸盐型碘钟的实验方法:向用H2SO4酸化的KIO3溶液中加入NaHSO3溶液(以及少量淀粉溶液)。实验现象:“无色→蓝黑色→无色→蓝黑色→……”的周期性变化。
(5)可用一组离子方程式表示每一个周期内的反应进程,请补充其中的2个离子方程式。
①___________ ;②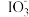 +5I -+ 6H+ = 3I2+3H2O;③
+5I -+ 6H+ = 3I2+3H2O;③___________ 。
 2CO(g)。测得平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。测得平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数。
请回答:
(1)判断该反应的自发性并说明理由
(2)下列说法正确的是___________。
| A.1×103K时,若充入惰性气体,v正、v逆均减小,v逆变化幅度更大 |
| B.1×103K时,突然升温,v正、v逆均增大,v正变化幅度更大 |
| C.1×103K时,反应达平衡后CO2的转化率为25.0 % |
| D.T×103K时,若充入等体积的CO2和CO,平衡向逆反应方向移动 |
(4)已知,在上述条件下(初始投料为1molCO2与足量的碳,恒容密闭容器中),在给定CO2的转化率为25.0 %时,V逆随温度的变化曲线如下图所示,画出V正随温度(0.5×103K至2.5×103K)的变化曲线

II.碘酸盐型碘钟的实验方法:向用H2SO4酸化的KIO3溶液中加入NaHSO3溶液(以及少量淀粉溶液)。实验现象:“无色→蓝黑色→无色→蓝黑色→……”的周期性变化。
(5)可用一组离子方程式表示每一个周期内的反应进程,请补充其中的2个离子方程式。
①
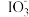 +5I -+ 6H+ = 3I2+3H2O;③
+5I -+ 6H+ = 3I2+3H2O;③
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】实现碳中和方法之是 二氧化碳捕捉再利用。
(1)二氧化碳可用于重整天然气制合成气(CO和H2)。
①已知下列热化学方程式:
CH4(g)+H2O(g) CO(g) +3H2(g) ∆H1= +206 kJ ·mol-1
CO(g) +3H2(g) ∆H1= +206 kJ ·mol-1
CO2(g)+4H2(g) CH4(g)+2H2O(g) ∆H2=-165 kJ· mol-1
CH4(g)+2H2O(g) ∆H2=-165 kJ· mol-1
则反应CH4(g) + CO2(g) 2CO(g)+ 2H2(g)的∆H =
2CO(g)+ 2H2(g)的∆H =___________ kJ·mol-1
②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为___________ 。

(2)在体积为2 L的恒容密闭容器中,起始充入1 mol CO2(g)和3 mol H2(g),发生反应:2CO2(g) +6H2(g) C2H4(g) +4H2O(g) ∆H<0;该反应在不同温度下达到平衡时,各组分的体积分数随温度的变化如图所示。
C2H4(g) +4H2O(g) ∆H<0;该反应在不同温度下达到平衡时,各组分的体积分数随温度的变化如图所示。

①若513K时,反应达到平衡所用时间为2 min,则该温度下,从开始到平衡时的平均反应速率 v(CO2)=___ ;H2 (g)的平衡转化率为 ___________ 。
②630 K时,该反应的化学平衡常数K=___________ (用分数表示)L3·mol-3;A、B、C三点对应的化学平衡常数KA、KB、KC从大到小的顺序为___________ 。
(3)用二氧化碳与氢气催化加氢制乙醇,其反应原理为2CO2(g) +6H2(g)=CH3CH2OH(g)+3H2O(g) △H<0。 经实验测定在不同投料比x1、x2、x3时CO2的平衡转化率与温度的关系如图曲线所示[x=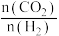 ]:
]:
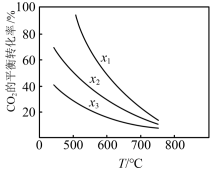
①x1、x2、x3由大到小的顺序为___________ 。
②从平衡角度分析,随温度升高,不同投料比时CO2的平衡转化率趋于相近的原因是___________ 。
(1)二氧化碳可用于重整天然气制合成气(CO和H2)。
①已知下列热化学方程式:
CH4(g)+H2O(g)
 CO(g) +3H2(g) ∆H1= +206 kJ ·mol-1
CO(g) +3H2(g) ∆H1= +206 kJ ·mol-1CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ∆H2=-165 kJ· mol-1
CH4(g)+2H2O(g) ∆H2=-165 kJ· mol-1则反应CH4(g) + CO2(g)
 2CO(g)+ 2H2(g)的∆H =
2CO(g)+ 2H2(g)的∆H =②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为

(2)在体积为2 L的恒容密闭容器中,起始充入1 mol CO2(g)和3 mol H2(g),发生反应:2CO2(g) +6H2(g)
 C2H4(g) +4H2O(g) ∆H<0;该反应在不同温度下达到平衡时,各组分的体积分数随温度的变化如图所示。
C2H4(g) +4H2O(g) ∆H<0;该反应在不同温度下达到平衡时,各组分的体积分数随温度的变化如图所示。
①若513K时,反应达到平衡所用时间为2 min,则该温度下,从开始到平衡时的平均反应速率 v(CO2)=
②630 K时,该反应的化学平衡常数K=
(3)用二氧化碳与氢气催化加氢制乙醇,其反应原理为2CO2(g) +6H2(g)=CH3CH2OH(g)+3H2O(g) △H<0。 经实验测定在不同投料比x1、x2、x3时CO2的平衡转化率与温度的关系如图曲线所示[x=
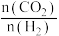 ]:
]:
①x1、x2、x3由大到小的顺序为
②从平衡角度分析,随温度升高,不同投料比时CO2的平衡转化率趋于相近的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】丙烯是重要的石油化工中间体,工业上常用丙烷催化脱氢和甲醇催化分解等方法制备。回答下列问题:
I.丙烷催化脱氢法制丙烯:C3H8(g) C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
(1)该反应在___________ (填“高温”、“低温”或“任意温度”)时可自发进行。
(2)570℃、100kPa,用n(C3H8):n(H2O)=1:9的混合气进行直接脱氢反应,3h后达到平衡,(C3H8的平衡转化率为 80%,脱氢反应的)Kp=________ kPa。(结果保留3位有效数字,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压-总压×物质的量分数)
Ⅱ. 二氧化碳耦合丙烷脱氢制丙烯:
CO2(g)+H2(g)=H2O(g)+CO(g) ΔH2
CO2(g)+C3H8(g) C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
(3)相同温度下的恒压密闭容器中,在丙烷催化脱氢法的基础上充入CO2,即为二氧化碳耦合丙烷脱氢法,该方法的优点为___________ 。
(4)下列能说明该体系在恒温恒压密闭容器中反应达到平衡状态的是___________(填序号)。
Ⅲ. 甲醇催化分解:3CH3OH(g)=C3H6(g)+3H2O(g)
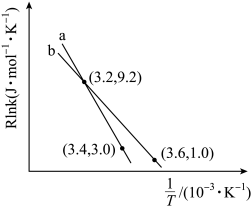
(5)该反应的实验数据遵循 Arhenius 经验公式: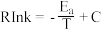 (Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
(Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得___________ 。(填“越多”或“越少”)。根据如图曲线a计算该反应的活化能E,为___________ kJ·mol-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是___________ 。
I.丙烷催化脱氢法制丙烯:C3H8(g)
 C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。(1)该反应在
(2)570℃、100kPa,用n(C3H8):n(H2O)=1:9的混合气进行直接脱氢反应,3h后达到平衡,(C3H8的平衡转化率为 80%,脱氢反应的)Kp=
Ⅱ. 二氧化碳耦合丙烷脱氢制丙烯:
CO2(g)+H2(g)=H2O(g)+CO(g) ΔH2
CO2(g)+C3H8(g)
 C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol(3)相同温度下的恒压密闭容器中,在丙烷催化脱氢法的基础上充入CO2,即为二氧化碳耦合丙烷脱氢法,该方法的优点为
(4)下列能说明该体系在恒温恒压密闭容器中反应达到平衡状态的是___________(填序号)。
| A.CO2的物质的量分数保持不变 |
| B.n(H2O):n(CO)保持不变 |
| C.气体密度保持不变 |
| D.速率关系:v(C3H8)=c(C3H6) |
Ⅲ. 甲醇催化分解:3CH3OH(g)=C3H6(g)+3H2O(g)
(5)该反应的实验数据遵循 Arhenius 经验公式:
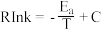 (Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
(Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】我国提出努力争取实现在2060年前实现碳中和,充分体现了为解决环境问题的大国担当,为此科研工作者进行了不懈的努力,研究了多种转化 的技术,请回答下列问题:
的技术,请回答下列问题:
(1) 转化为
转化为 :反应原理为
:反应原理为
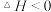 。若该反应自发进行,反应适宜条件是
。若该反应自发进行,反应适宜条件是______ (填“低温”或“高温”)。
(2)二氧化碳到淀粉的人工合成第一步为用无机催化剂将二氧化碳还原为甲醇,反应方程式为 。一定温度下,恒容密闭容器中投入3mol
。一定温度下,恒容密闭容器中投入3mol 和1mol
和1mol ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的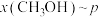 、在
、在 下的
下的 如图所示。请回答:
如图所示。请回答:______ (填“a”或“b”)代表 下的
下的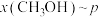 ;该反应为
;该反应为______ 反应(填“放热”或“吸热”)
②下列不能说明该反应达平衡的是:______ 。
a.单位时间内断裂 个碳氧双键同时断裂
个碳氧双键同时断裂 个氢氧键
个氢氧键
b.密度不再改变
c.平均相对分子质量不变
d. 不变
不变
③下列措施既能加快反应速率,又能提高 的是
的是______ 。
a.升高温度 b.分离出水蒸气
c.温度不变缩小容器体积 d.增大 的浓度
的浓度
④计算在250℃,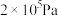 下达平衡后,
下达平衡后, 的转化率
的转化率
______ 。(保留三位有效数字)
(3)据文献报道, 可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是______ 。
(4) 超干重整
超干重整 得到的CO经偶联反应可制得草酸
得到的CO经偶联反应可制得草酸 。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中
。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中 ,则此时溶液的
,则此时溶液的
______ 。(已知常温下 的
的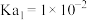 ,
, )
)
 的技术,请回答下列问题:
的技术,请回答下列问题:(1)
 转化为
转化为 :反应原理为
:反应原理为
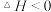 。若该反应自发进行,反应适宜条件是
。若该反应自发进行,反应适宜条件是(2)二氧化碳到淀粉的人工合成第一步为用无机催化剂将二氧化碳还原为甲醇,反应方程式为
 。一定温度下,恒容密闭容器中投入3mol
。一定温度下,恒容密闭容器中投入3mol 和1mol
和1mol ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的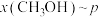 、在
、在 下的
下的 如图所示。请回答:
如图所示。请回答: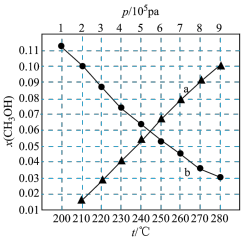
 下的
下的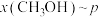 ;该反应为
;该反应为②下列不能说明该反应达平衡的是:
a.单位时间内断裂
 个碳氧双键同时断裂
个碳氧双键同时断裂 个氢氧键
个氢氧键b.密度不再改变
c.平均相对分子质量不变
d.
 不变
不变③下列措施既能加快反应速率,又能提高
 的是
的是a.升高温度 b.分离出水蒸气
c.温度不变缩小容器体积 d.增大
 的浓度
的浓度④计算在250℃,
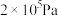 下达平衡后,
下达平衡后, 的转化率
的转化率
(3)据文献报道,
 可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是(4)
 超干重整
超干重整 得到的CO经偶联反应可制得草酸
得到的CO经偶联反应可制得草酸 。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中
。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中 ,则此时溶液的
,则此时溶液的
 的
的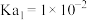 ,
, )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题。
(1)已知石灰石分解反应CaCO3(s)=CaO(s)+CO2(g)的ΔH>0,该反应能够自发进行的反应条件是___________ (填“高温”或“低温”)。
(2)合成氨在工业生产中具有重要意义。在合成氨工业中I2O5常用于定量测量CO的含量。已知:2I2(s)+5O2(g)=2I2O5(s) ΔH=-76 kJ·mol-1;2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1.则该测定反应的热化学方程式为___________ 。
(3)实现“碳中和”,综合利用CO2具有重要的意义。一定条件下,CO2与H2制备气态甲醇CH3OH的反应方程式为 。在容积为
。在容积为 的恒温密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
的恒温密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
①3~6min内,v(H2)=___________ 。
②12min末时,混合气体中CH3OH的物质的量分数为___________ 。
③第3min时v正(CH3OH)___________ 第9min时v逆(CH3OH)(填“>”、“<”或“=”,),第12min时,v正(CH3OH)___________ v逆(H2)(填“>”、“<”或“=”)。
(4)保持压强为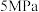 ,向密闭容器中投入一定量CO2和H2发生上述反应,若投料比
,向密闭容器中投入一定量CO2和H2发生上述反应,若投料比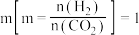 ,一定温度下发生上述反应,下列说法不能作为反应是否达到平衡的判断依据的是
,一定温度下发生上述反应,下列说法不能作为反应是否达到平衡的判断依据的是___________ (填标号)。
a.容器内气体的密度不再变化 b.容器内气体的平均相对分子质量不再变化
c.CO2的体积分数不再变化 d.断裂3NA个H-H键的同时生成NA个水分子
(5)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ: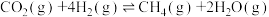
反应Ⅱ: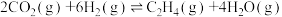
为分析催化剂对反应的选择性,在1 L密闭容器中充入2 mol CO2和4 mol H2,测得有关物质的物质的量随温度变化如图所示:
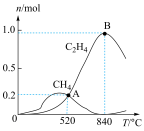
该催化剂在较低温度时主要选择___________ (填“反应Ⅰ”或“反应Ⅱ”)。520 ℃时,反应Ⅰ的平衡常数K=___________ (只列算式不计算)。
(6)温度为T时,将NH4HS(s)置于抽真空的容器中,当反应 达到平衡时,测得总压强为p,则该反应的压强平衡常数Kp为
达到平衡时,测得总压强为p,则该反应的压强平衡常数Kp为___________ 。
(1)已知石灰石分解反应CaCO3(s)=CaO(s)+CO2(g)的ΔH>0,该反应能够自发进行的反应条件是
(2)合成氨在工业生产中具有重要意义。在合成氨工业中I2O5常用于定量测量CO的含量。已知:2I2(s)+5O2(g)=2I2O5(s) ΔH=-76 kJ·mol-1;2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1.则该测定反应的热化学方程式为
(3)实现“碳中和”,综合利用CO2具有重要的意义。一定条件下,CO2与H2制备气态甲醇CH3OH的反应方程式为
 。在容积为
。在容积为 的恒温密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
的恒温密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
| n(CH3OH)/mol | 0 | 0.50 | a | 0.75 | 0.75 |
| n(CO2)/mol | 1 | 0.50 | 0.35 | 0.25 | 0.25 |
②12min末时,混合气体中CH3OH的物质的量分数为
③第3min时v正(CH3OH)
(4)保持压强为
 ,向密闭容器中投入一定量CO2和H2发生上述反应,若投料比
,向密闭容器中投入一定量CO2和H2发生上述反应,若投料比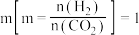 ,一定温度下发生上述反应,下列说法不能作为反应是否达到平衡的判断依据的是
,一定温度下发生上述反应,下列说法不能作为反应是否达到平衡的判断依据的是a.容器内气体的密度不再变化 b.容器内气体的平均相对分子质量不再变化
c.CO2的体积分数不再变化 d.断裂3NA个H-H键的同时生成NA个水分子
(5)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:
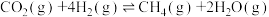
反应Ⅱ:
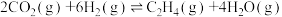
为分析催化剂对反应的选择性,在1 L密闭容器中充入2 mol CO2和4 mol H2,测得有关物质的物质的量随温度变化如图所示:

该催化剂在较低温度时主要选择
(6)温度为T时,将NH4HS(s)置于抽真空的容器中,当反应
 达到平衡时,测得总压强为p,则该反应的压强平衡常数Kp为
达到平衡时,测得总压强为p,则该反应的压强平衡常数Kp为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】H2、CO、CH4等都是重要的能源,也是重要的化工原料。
(1)25℃,101kPa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:_______ 。
(2)水煤气中的CO和H2在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入2molCO和10molH2,一定温度下发生反应:CO(g) +3H2(g) ⇌CH4 (g) +H2O(g)。测得CO和H2的转化率随时间变化如图所示。

①从反应开始到6分钟,CO的平均反应速率_______ ,6分钟时,H2的转化率为_______ 。
②下列叙述中能说明上述反应达到化学平衡状态的是_______ 。(填字母)
a.容器中CH4的质量分数保持不变 b.容器中混合气体的总压强保持不变
c.容器中混合气体的密度保持不变 d.单位时间内每消耗1molCO,同时生成1mol CH4
(3)甲烷燃料电池装置图如图所示。现用此燃料电池电解饱和食盐水。
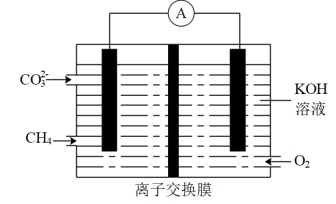
①通入氧气的电极的电极反应_______
②用该电池电解饱和食盐水的化学方程式为_______
③若通入0.1mol CH4充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积为_______ (标准状况下)。(写计算过程)
(1)25℃,101kPa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
(2)水煤气中的CO和H2在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入2molCO和10molH2,一定温度下发生反应:CO(g) +3H2(g) ⇌CH4 (g) +H2O(g)。测得CO和H2的转化率随时间变化如图所示。

①从反应开始到6分钟,CO的平均反应速率
②下列叙述中能说明上述反应达到化学平衡状态的是
a.容器中CH4的质量分数保持不变 b.容器中混合气体的总压强保持不变
c.容器中混合气体的密度保持不变 d.单位时间内每消耗1molCO,同时生成1mol CH4
(3)甲烷燃料电池装置图如图所示。现用此燃料电池电解饱和食盐水。

①通入氧气的电极的电极反应
②用该电池电解饱和食盐水的化学方程式为
③若通入0.1mol CH4充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如下所示:

(1)酸浸过程中,HCl的作用是_______________________ 。
(2)已知Sc3++3HTBP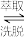 Sc(TBP)3+3H+,则上述洗脱剂最好选择
Sc(TBP)3+3H+,则上述洗脱剂最好选择___________ (选填“酸性”、“碱性”或“中性”)溶液。在实验室模拟完成上述操作Ⅰ和操作Ⅱ所涉及的玻璃仪器有______________ 。
(3)草酸“沉钪”得到草酸钪的化学反应类型为____________________________ 。
(4)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为__________________________ 。
(5)“水相”的主要离子有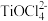 、H+、Cl- 及
、H+、Cl- 及________ ,写出加入大量的水并加热发生的相关离子反应方程式__________________________ 。
(6)钛的冶炼新法是剑桥电解法(如右图)。

以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。写出阳极电极主要反应方程式:__________________________ ;利用中学所学知识可以预测CaCl2的作用包含增强导电性、___________ ;F=96500C/mol,当I=0.5A,通电80分钟,理论上获得Ti的质量为__________ g(计算表达式)。

(1)酸浸过程中,HCl的作用是
(2)已知Sc3++3HTBP
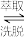 Sc(TBP)3+3H+,则上述洗脱剂最好选择
Sc(TBP)3+3H+,则上述洗脱剂最好选择(3)草酸“沉钪”得到草酸钪的化学反应类型为
(4)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为
(5)“水相”的主要离子有
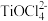 、H+、Cl- 及
、H+、Cl- 及(6)钛的冶炼新法是剑桥电解法(如右图)。

以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。写出阳极电极主要反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】倡导生态文明建设,环境问题一直是我们关注的焦点。运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)为了高效利用能源并且减少 的排放,可用下列方法把
的排放,可用下列方法把 转化成乙醇燃料:
转化成乙醇燃料:
①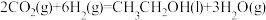
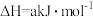
②

③
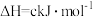
则表示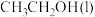 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(2)NO的氧化反应 分两步进行;
分两步进行;
I.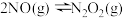 II.
II.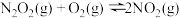
其反应过程能量变化如图所示

①决定NO氧化反应速率的步骤是_______ (填“I”或“II”),其理由是_______ 。
②一定温度下,在刚性密闭容器中,起始充入一定量的 气体(
气体( 转化为
转化为 忽略不计),此时压强为36kPa,在5min达到平衡,此时容器的压强为46kPa,则0~5min用
忽略不计),此时压强为36kPa,在5min达到平衡,此时容器的压强为46kPa,则0~5min用 的分压表示反应速率为
的分压表示反应速率为_______ 。该温度下,此反应的平衡常数
_______  (
( 是平衡分压代替平衡浓度计算的平衡常数)。
是平衡分压代替平衡浓度计算的平衡常数)。
③恒温恒容条件下,能说明该反应达到平衡状态的是_______ (填字母)。
A.压强不再变化
B.混合气体的密度不再变化
C.生成NO的速率与消耗 的速率相等
的速率相等
D.混合气体的平均相对分子质量不再变化
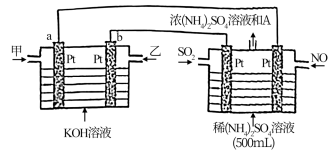
(3)利用 燃料电池电解,可将雾霾中的NO、
燃料电池电解,可将雾霾中的NO、 分别转化为
分别转化为 和
和 如下图装置所示。则物质甲为
如下图装置所示。则物质甲为_______ (填名称),阴极的电极反应式_______ ;当电路中转移2.5mol电子时,A的浓度为_______  (电解过程中忽略溶液体积变化)。
(电解过程中忽略溶液体积变化)。
(1)为了高效利用能源并且减少
 的排放,可用下列方法把
的排放,可用下列方法把 转化成乙醇燃料:
转化成乙醇燃料:①
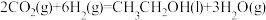
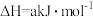
②


③

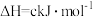
则表示
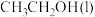 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)NO的氧化反应
 分两步进行;
分两步进行;I.
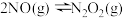 II.
II.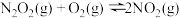
其反应过程能量变化如图所示

①决定NO氧化反应速率的步骤是
②一定温度下,在刚性密闭容器中,起始充入一定量的
 气体(
气体( 转化为
转化为 忽略不计),此时压强为36kPa,在5min达到平衡,此时容器的压强为46kPa,则0~5min用
忽略不计),此时压强为36kPa,在5min达到平衡,此时容器的压强为46kPa,则0~5min用 的分压表示反应速率为
的分压表示反应速率为
 (
( 是平衡分压代替平衡浓度计算的平衡常数)。
是平衡分压代替平衡浓度计算的平衡常数)。③恒温恒容条件下,能说明该反应达到平衡状态的是
A.压强不再变化
B.混合气体的密度不再变化
C.生成NO的速率与消耗
 的速率相等
的速率相等D.混合气体的平均相对分子质量不再变化
(3)利用
 燃料电池电解,可将雾霾中的NO、
燃料电池电解,可将雾霾中的NO、 分别转化为
分别转化为 和
和 如下图装置所示。则物质甲为
如下图装置所示。则物质甲为 (电解过程中忽略溶液体积变化)。
(电解过程中忽略溶液体积变化)。
您最近一年使用:0次



