已知X、Y、Z、W、Q是原子序数依次增大的前四周期元素。X原子核外有6种不同运动状态的电子;Y基态原子中s电子总数与p电子总数相等;Z最高价氧化物对应水化物的碱性在同周期元素中最强;W基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反。
(1)基态X原子中电子占据的最高能级的原子轨道形状为_______ 。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为_______ 。
(2)Y、Z、W的简单离子半径由大到小的顺序为_______ 。(用离子符号表示)
(3)Q是生活中使用最广泛的一种金属。
①Q的原子结构示意图为_______ 。
②检验溶液中是否含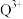 离子的试剂是
离子的试剂是_______ (填化学式),现象为_______ 。
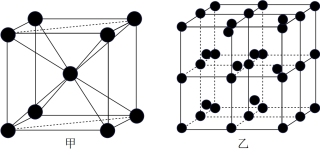
③Q的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是_______ (填字母序号)。
A.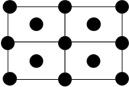 B.
B.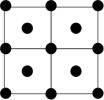 C.
C.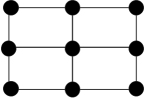 D.
D.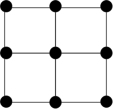
(1)基态X原子中电子占据的最高能级的原子轨道形状为
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为(2)Y、Z、W的简单离子半径由大到小的顺序为
(3)Q是生活中使用最广泛的一种金属。
①Q的原子结构示意图为
②检验溶液中是否含
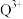 离子的试剂是
离子的试剂是③Q的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是

A.
 B.
B. C.
C. D.
D.
更新时间:2022-04-08 11:15:04
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知铍的原子半径为0.089 nm,下面是几种短周期元素的相关信息(该题中大写字母均为元素代号,不是元素符号)
(1)C元素的简单阴离子结构示意图________ ,F元素在周期表中的位置____________ 。
(2)D的单质与水反应的离子方程式_____________ ,该反应生成的含氧酸的电子式________ 。
(3)F元素与半径最小的元素形成的最简单有机化合物的结构式___________ 。
(4)钠元素与E元素形成的所有化合物中,可能含有的化学键类型_______ (填字母代号)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键
(5)B、C、E三种元素的简单离子半径由大到小顺序________________ (填离子符号)。
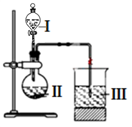
(6)某同学选取稀硫酸、过量碳酸氢钠溶液和过量硅酸钠溶液,并设计了下图装置完成硫、碳、硅三种元素非金属性强弱比较的实验研究。下图中装置Ⅰ的名称_______ ,装置Ⅲ中反应的离子方程式_________________ 。
| 元素代号 | A | B | C | D | E | F |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 | 0.077 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 | +4,-4 |
(1)C元素的简单阴离子结构示意图
(2)D的单质与水反应的离子方程式
(3)F元素与半径最小的元素形成的最简单有机化合物的结构式
(4)钠元素与E元素形成的所有化合物中,可能含有的化学键类型
a.离子键 b.极性共价键 c.非极性共价键 d.金属键
(5)B、C、E三种元素的简单离子半径由大到小顺序
(6)某同学选取稀硫酸、过量碳酸氢钠溶液和过量硅酸钠溶液,并设计了下图装置完成硫、碳、硅三种元素非金属性强弱比较的实验研究。下图中装置Ⅰ的名称

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素,回答下列问题:
(1)A元素在周期表中的位置_______ 化学性质最稳定的是_______ (填元素符号);
(2)A元素中子数为8的核素的符号:_______ ,写出E的离子结构示意图:_______ ;
(3)上表短周期元素中,金属性最强的是_______ (填元素符号);最高价氧化物对应水化物中酸性最强的物质_______ (填化学式);A、B、C的的气态氢化物稳定性由强到弱的顺序_______ (填化学式)
(4)表中E、F、G三元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径最大的是_______ (用离子符号表示):
(5)O、D的最高价氧化物对应水化物之间能发生反应,其离子方程式为。_______ 。
(6)用一个离子方程式说明元素E、F非金属性强弱_______ 。
| A | B | C | |||||||||||||||
| D | O | E | F | M | |||||||||||||
| G | H | I |
(2)A元素中子数为8的核素的符号:
(3)上表短周期元素中,金属性最强的是
(4)表中E、F、G三元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径最大的是
(5)O、D的最高价氧化物对应水化物之间能发生反应,其离子方程式为。
(6)用一个离子方程式说明元素E、F非金属性强弱
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】元素周期表是学习化学的基础,元素周期表的一部分如图。

请回答下列问题:
(1)比较①②形成最简单气态氢化物的稳定性_______ >_______ (填化学式)。
(2)③、⑤、⑥三种元素对应的简单离子半径由大到小的顺序为_______ (用元素的离子符号表示)。
(3)写出①的最高价氧化物的电子式:_______ 。
(4)④⑤的最高价氧化物对应的水化物反应的化学方程式为_______ 。
(5)下列各项能说明非金属性⑥<⑦的是_______(填字母标号)。

请回答下列问题:
(1)比较①②形成最简单气态氢化物的稳定性
(2)③、⑤、⑥三种元素对应的简单离子半径由大到小的顺序为
(3)写出①的最高价氧化物的电子式:
(4)④⑤的最高价氧化物对应的水化物反应的化学方程式为
(5)下列各项能说明非金属性⑥<⑦的是_______(填字母标号)。
| A.含氧酸的酸性;⑥<⑦ |
| B.⑦的单质能与⑥的最简单气态氢化物反应,置换出⑥的单质 |
| C.单质与Fe发生化合反应,生成物中Fe的化合价:⑥<⑦ |
| D.单质的熔、沸点:⑥>⑦ |
您最近一年使用:0次
【推荐1】下图是元素周期表中的前四周期,回答下列问题。

(1)a元素的基态原子的电子排布图是图①、②中的一个。
① ②
②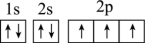
另一个电子排布图错误的原因是它不符合_______ (填字母)。
A.构造原理 B.泡利原理 C.洪特规则
b元素的正二价离子的价层电子排布图是_______ 。
(2)b、e两种元素的第四电离能大小关系为I4(Fe)_______ I4(Co) (填“>”“<”或“=”),原因是_______ 。
(3)已知元素c、f的最简单的化合物中共用电子对偏向f,元素c、g的最简单的化合物中共用电子对偏向c,则元素c、f、g的电负性由大到小的顺序为_______ (填元素符号)。
(4)某元素的原子价层电子排布式为nsn-1npn+1,该基态原子核外电子空间运动状态有_______ 种。
(5)d元素的下列粒子中,电离最外层一个电子所需能量最大的是_______(填字母)。
(6)下列现象与原子核外电子跃迁有关的是_______(填字母)

(1)a元素的基态原子的电子排布图是图①、②中的一个。
①
 ②
②
另一个电子排布图错误的原因是它不符合
A.构造原理 B.泡利原理 C.洪特规则
b元素的正二价离子的价层电子排布图是
(2)b、e两种元素的第四电离能大小关系为I4(Fe)
(3)已知元素c、f的最简单的化合物中共用电子对偏向f,元素c、g的最简单的化合物中共用电子对偏向c,则元素c、f、g的电负性由大到小的顺序为
(4)某元素的原子价层电子排布式为nsn-1npn+1,该基态原子核外电子空间运动状态有
(5)d元素的下列粒子中,电离最外层一个电子所需能量最大的是_______(填字母)。
A. | B. | C.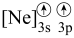 | D.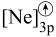 |
| A.激光 | B.LED灯光 | C.金属导电 | D.核辐射 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式______________________________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有________ 个方向,原子轨道呈________ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为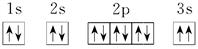 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了_____________________________________ 。
(4)G位于________ 族________ 区,价电子排布式为________ 。
(5)检验F元素的方法是________ ,请用原子结构的知识解释产生此现象的原因是_____________________________________________________________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是 I1=738 kJ/mol;I2=1 451 kJ/mol;I3=7 733 kJ/mol;I4=10 540 kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布为
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(4)G位于
(5)检验F元素的方法是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】关于周期表中前四周期元素的单质及其化合物在诸多领域都有广泛的应用。请回答下列问题:
(1)钠在火焰上灼烧的黄光是一种______ (填字母)。
A.吸收光谱 B.发射光谱
(2)22号元素Ti在周期表中的位置是______ ,基态Ti原子最高能层电子的电子云轮廓形状为______ 。与Ti同周期的过渡元素中,未成对电子数最多的的基态原子的外围电子的轨道表示式______ 。
(3)镍元素基态原子的电子排布式为______ ;元素铜与镍的第二电离能分别为 、
、 ,
,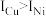 的原因是
的原因是______ 。

(4)某配合物离子结构如右图所示,则该配离子中非金属元素的电负性大小顺序为______ 。
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
(2)22号元素Ti在周期表中的位置是
(3)镍元素基态原子的电子排布式为
 、
、 ,
,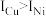 的原因是
的原因是
(4)某配合物离子结构如右图所示,则该配离子中非金属元素的电负性大小顺序为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题:
(1)写出基态溴原子的价电子排布式_______ ,氟、氯、溴、氧四种元素中,电负性由大到小的顺序为_______ (填元素符号)
(2)X射线衍射测定等发现,I3AsF6中存在I 离子。I
离子。I 离子的几何构型为
离子的几何构型为_______ ,中心原子的杂化类型为_______
(3)C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上
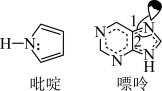
①1 mol吡啶分子中含有σ键数目是_______ NA
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_______
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为_______
(4)CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:

①“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(_______,_______, ),
),_______
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为_______ g·cm-3 (列出计算式即可)
(1)写出基态溴原子的价电子排布式
(2)X射线衍射测定等发现,I3AsF6中存在I
 离子。I
离子。I 离子的几何构型为
离子的几何构型为(3)C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上

①1 mol吡啶分子中含有σ键数目是
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为(4)CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:

①“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(_______,_______,
 ),
),②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】石棉的化学式可表示为3MgO·2SiO2·2H2O,具有高抗张强度、高挠性耐化学和热浸蚀、电绝缘及具有可纺性的硅酸盐类矿物产品。其中IIA族的元素属于碱土金属。回答下列问题:
(1)与Ca同周期的基态Fe原子的价电子排布式为___________ 。
(2)BeCl2易升华,液态时以双聚分子存在的BeCl2结构式为___________ ,其中Be的配位数为___________ 。
(3)化学式3MgO·2SiO2·2H2O中电负性最大的元素为__________ 。
SiO2的熔沸点远高于H2O,说明理由:____________________________________________ 。
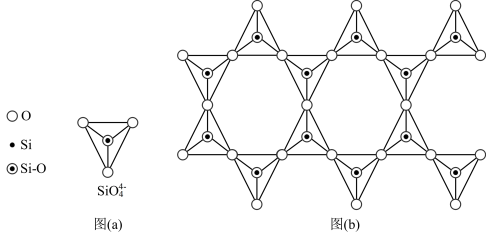
(4)天然硅酸盐组成复杂,阴离子的基本结构单元是SiO44-四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中O与Si的原子数之比为___________ ,化学式为___________ 。
(5)经X射线分析鉴定,某一离子晶体属于立方晶系。晶胞顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,写出此晶体的化学式:___________ 。
(1)与Ca同周期的基态Fe原子的价电子排布式为
(2)BeCl2易升华,液态时以双聚分子存在的BeCl2结构式为
(3)化学式3MgO·2SiO2·2H2O中电负性最大的元素为
SiO2的熔沸点远高于H2O,说明理由:
(4)天然硅酸盐组成复杂,阴离子的基本结构单元是SiO44-四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中O与Si的原子数之比为

(5)经X射线分析鉴定,某一离子晶体属于立方晶系。晶胞顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,写出此晶体的化学式:
您最近一年使用:0次
【推荐1】研究物质的微观结构,有助于人们理解物质变化的本质。
(1)已知NixO晶体的晶胞结构为NaCl型(如图),由于晶体缺陷,x值小于1.测知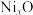 晶体密度
晶体密度 为
为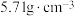 ,晶胞边长为
,晶胞边长为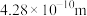 。求:(已知:
。求:(已知: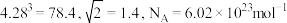 )
)
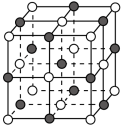
①晶胞中两个 原子之间的最短距离为
原子之间的最短距离为___________ m(精确至0.01)。
②与 距离最近且等距离的
距离最近且等距离的 离子围成的几何体形状是
离子围成的几何体形状是___________ 。
③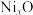 中x的值为
中x的值为___________ 。
(2)金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为 ,求:
,求:
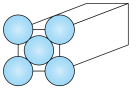
①金晶体中最小的一个立方体含有___________ 个金原子。
②金的密度为___________  。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为 ,用含a的代数式表示,不必化简)
,用含a的代数式表示,不必化简)
③金原子空间占有率为___________ (列出计算式即可,不必化简)。
(1)已知NixO晶体的晶胞结构为NaCl型(如图),由于晶体缺陷,x值小于1.测知
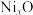 晶体密度
晶体密度 为
为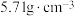 ,晶胞边长为
,晶胞边长为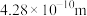 。求:(已知:
。求:(已知: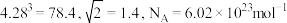 )
)
①晶胞中两个
 原子之间的最短距离为
原子之间的最短距离为②与
 距离最近且等距离的
距离最近且等距离的 离子围成的几何体形状是
离子围成的几何体形状是③
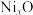 中x的值为
中x的值为(2)金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为
 ,求:
,求:
①金晶体中最小的一个立方体含有
②金的密度为
 。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为 ,用含a的代数式表示,不必化简)
,用含a的代数式表示,不必化简)③金原子空间占有率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】金属晶体的原子堆积方式常有以下四种,请认真观察模型(见图),回答下列问题:
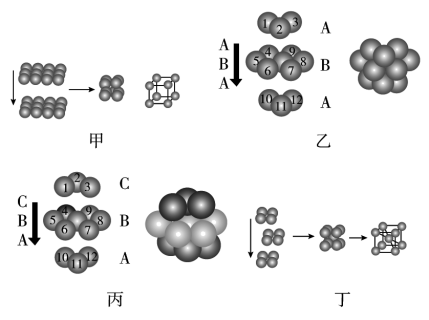
(1)四种堆积模型的堆积名称依次是________ 、________ 、________ 、________ 。
(2)甲堆积方式中的空间利用率为________ ,只有金属________ 采用这种堆积方式。
(3)乙与丙中两种堆积方式中金属原子的配位数________ (填“相同”或“不相同”);乙中的空间利用率为________ 。
(4)采取丁中堆积方式的金属通常有________ (任写三种金属元素的符号),每个晶胞中所含有的原子数为________ 。

(1)四种堆积模型的堆积名称依次是
(2)甲堆积方式中的空间利用率为
(3)乙与丙中两种堆积方式中金属原子的配位数
(4)采取丁中堆积方式的金属通常有
您最近一年使用:0次

 与
与 的结构相似,和过渡金属更容易形成配合物的是
的结构相似,和过渡金属更容易形成配合物的是 ②
② ③
③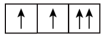 ④
④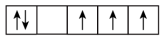 ⑤
⑤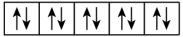 ⑥
⑥