铁在成人体中的含量约为4~5g,是入体必需的微量元素中含量最多的一种,回答下列问题:
(1)基态Fe原子的核外电子排布式为_______ ,用原子结构知识解释Fe2+易被氧化为Fe3+的原因_______ 。
(2)甘氨酸亚铁[(H2NCH2COO)2Fe]的主要生理功能是预防和改善缺铁性贫血。
①甘氨酸H2NCH2COOH中C原子的杂化形式为_______ ,C、N、O三种原子第一电离能由小到大的顺序是_______ 。
②甘氨酸易溶于水,原因为_______ 。
(3)五羰基合铁[Fe(CO)5]的配位体是_______ ;已知配位原子是C而不是O,其可能的原因是_______ 。
(4)已知Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓,利用该离子方程式可以检验溶液中的Fe3+。[Fe(CN)6]4-中σ键、π键数目之比为_______ 。
(5)Fe3O4晶体的晶胞如下图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中。
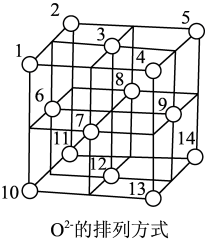
①O2-周围紧邻的O2-数目为_______ 。
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为___ g·cm-3(用含a和NA的代数式表示)。
③晶体中正四面体空隙数与正八面体空隙数之比为_______ 。
(1)基态Fe原子的核外电子排布式为
(2)甘氨酸亚铁[(H2NCH2COO)2Fe]的主要生理功能是预防和改善缺铁性贫血。
①甘氨酸H2NCH2COOH中C原子的杂化形式为
②甘氨酸易溶于水,原因为
(3)五羰基合铁[Fe(CO)5]的配位体是
(4)已知Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓,利用该离子方程式可以检验溶液中的Fe3+。[Fe(CN)6]4-中σ键、π键数目之比为
(5)Fe3O4晶体的晶胞如下图所示(阳离子略去),O2-围成正四面体空隙(1、3、6、7号O2-围成)和正八面体空隙(3、6、7、8、9、12号O2-围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中。

①O2-周围紧邻的O2-数目为
②已知晶胞参数为apm,阿伏加德罗常数为NA,则晶体密度为
③晶体中正四面体空隙数与正八面体空隙数之比为
更新时间:2022-04-22 08:10:35
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】(1)硼的研究在无机化学发展中占有独特的位置。硼元素有10B 和11B 两种天然稳定的同位素,在基态11B 原子中,核外存在______ 对自旋状态相反的电子,有_______ 种不同空间运动状态的电子。根据对角线规则,硼元素许多性质与_____ 元素相似;
(2)NH3能通过配位键与硼元素的某种氢化物作用得到化合物M,M是一种新的储氢材料,加热M会缓慢释放出H2,并转化为化合物N,M、N分别是乙烷、乙烯的等电子体。 M的结构式为______________ (须标出配位键),N分子中的π键和σ键数目之比为_______________ ;
(3)O 和 S 两种元素是自然界最常见的两种元素。均能与 H 形成 H2O2和 H2S2,结构如图所示。请说明 H2O2中 ∠H-O-O = 97° 略大于 ∠H-S-S = 95° 的原因:______________ ;

(4)下图为DNA结构局部图。双链通过氢键使它们的碱基(A • • • T 和 C • • • G )相互配对形成双螺旋结构,请写出图中存在的两种氢键的表示式____________ ,_____________ ;

(5)通常认为含氧酸的通式可写成 (HO)mROn,n值越高,则酸性越强。可实际上,二氧化碳的水溶液酸性很弱,通常认为是弱酸,但磷酸(H3PO4)的非羟基氧个数与碳酸(H2CO3)相同,却是中强酸,请解释原因:____________________ ;
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2‾作密置单层排列,Ni2+填充其中;已知O2‾的半径为am,阿伏加 德罗常数NA,则每平方米上分散的该晶体的质量为_______________ g。(写出表达式即可。图中大白球表示O2‾,小黑球表示 Ni2+)

(2)NH3能通过配位键与硼元素的某种氢化物作用得到化合物M,M是一种新的储氢材料,加热M会缓慢释放出H2,并转化为化合物N,M、N分别是乙烷、乙烯的等电子体。 M的结构式为
(3)O 和 S 两种元素是自然界最常见的两种元素。均能与 H 形成 H2O2和 H2S2,结构如图所示。请说明 H2O2中 ∠H-O-O = 97° 略大于 ∠H-S-S = 95° 的原因:

(4)下图为DNA结构局部图。双链通过氢键使它们的碱基(A • • • T 和 C • • • G )相互配对形成双螺旋结构,请写出图中存在的两种氢键的表示式

(5)通常认为含氧酸的通式可写成 (HO)mROn,n值越高,则酸性越强。可实际上,二氧化碳的水溶液酸性很弱,通常认为是弱酸,但磷酸(H3PO4)的非羟基氧个数与碳酸(H2CO3)相同,却是中强酸,请解释原因:
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2‾作密置单层排列,Ni2+填充其中;已知O2‾的半径为am,阿伏加 德罗常数NA,则每平方米上分散的该晶体的质量为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】过渡金属在生产、生活、科技等方面有着广泛的应用。例如仿生簇化合物Mn4XO4(X=Ca2+/Y3+/Gd3+)有望为实现利用太阳能和水获取清洁能源(氢能)开辟新途径,MnOx·Na2WO4·SiO2、钴(Co)的合金及其化合物材料等广泛应用于化工催化剂等领域。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为_______ 。
(2)基态Co原子核外有_______ 种运动状态不同的电子,其3d能级上有_______ 对成对电子。
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。已知:[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-。[Co(CN)6]4-中含有σ键与π键的数目之比为_______ ,[Co(CN)6]3-中C的杂化方式为_______ 。
(4)[Mn(NH3)2]2+中配体分子的立体构型是_______ 。[Mn(NH3)2]2+中键角∠HNH_______ (填“大于” 、“小于”或“等于”)NH3中键角∠HNH。
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是_______ 。
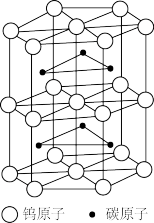
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是_______ ;已知:碳化钨晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,六棱柱高为a cm,则底边长为_______ (用含ρ、a、N的表达式表示)nm。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为
(2)基态Co原子核外有
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是
(4)[Mn(NH3)2]2+中配体分子的立体构型是
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】完成下列问题。
(1)甲醇( )空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为:
)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为: 2
2

①HCHO分子内σ键与π键个数之比为_______ ,HCHO的空间结构为_______ 。
② 和HCHO分子中碳原子的杂化轨道类型分别为
和HCHO分子中碳原子的杂化轨道类型分别为_______ 和_______ 。
③甲醇氧化生成HCHO时,会产生CO、 、
、 等副产物。相同条件下,
等副产物。相同条件下, 的沸点比
的沸点比 的高,主要原因为
的高,主要原因为_______ 。
(2)金属镍是电池制造过程中重要的原材料,未来十年新能源汽车领域镍需求增长将达8~16倍。一种制备金属镍的方法为 。回答下列问题:
。回答下列问题:
①已知 熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有
熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有____ 种。
②丁二酮肟( )是检验
)是检验 的灵敏试剂,可与
的灵敏试剂,可与 生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有_______ (填标号)。

A.金属键 B.氢键 C.π键 D.配位键 E.离子键
③镧镍合金是稀土系储氢合金的典型代表,其晶胞参数分别为apm、bpm、cpm,阿伏加德罗常数的值为 ,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存
,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存_______ mol氢气。储氢前,该合金的密度为_______  (列出含a、b、c和
(列出含a、b、c和 的计算式即可)。
的计算式即可)。

(1)甲醇(
 )空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为:
)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为: 2
2

①HCHO分子内σ键与π键个数之比为
②
 和HCHO分子中碳原子的杂化轨道类型分别为
和HCHO分子中碳原子的杂化轨道类型分别为③甲醇氧化生成HCHO时,会产生CO、
 、
、 等副产物。相同条件下,
等副产物。相同条件下, 的沸点比
的沸点比 的高,主要原因为
的高,主要原因为(2)金属镍是电池制造过程中重要的原材料,未来十年新能源汽车领域镍需求增长将达8~16倍。一种制备金属镍的方法为
 。回答下列问题:
。回答下列问题:①已知
 熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有
熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有②丁二酮肟(
 )是检验
)是检验 的灵敏试剂,可与
的灵敏试剂,可与 生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
A.金属键 B.氢键 C.π键 D.配位键 E.离子键
③镧镍合金是稀土系储氢合金的典型代表,其晶胞参数分别为apm、bpm、cpm,阿伏加德罗常数的值为
 ,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存
,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存 (列出含a、b、c和
(列出含a、b、c和 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】烯烃的加氢甲酰化反应是醛合成中重要的均相催化工业反应之一。我国科学家利用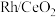 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题: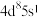 ,位于周期表第五周期第
,位于周期表第五周期第_____ 族,位于_____ 区。
(2)基态O原子核外电子有_____ 种不同的空间运动状态。
(3)乙中C原子的杂化类型是_____ 。
(4)丙分子中所含元素电负性由大到小顺序为_____ 。丙分子有_____ 个手性碳原子。
(5)已知: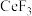 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是_____ 。
(6) 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。_____ 。该晶体密度为_____  。
。
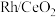 催化剂实现烯烃甲酰化。回答下列问题:
催化剂实现烯烃甲酰化。回答下列问题:
 ,位于周期表第五周期第
,位于周期表第五周期第(2)基态O原子核外电子有
(3)乙中C原子的杂化类型是
(4)丙分子中所含元素电负性由大到小顺序为
(5)已知:
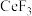 、
、 的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是
的熔点分别为1640℃、650℃,其熔点差异很大的主要原因是(6)
 的立方晶胞结构如图所示。已知
的立方晶胞结构如图所示。已知 为阿伏加德罗常数的值,晶胞参数为
为阿伏加德罗常数的值,晶胞参数为 。
。
 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】硅、锗(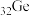 ,熔点937℃)和镓(
,熔点937℃)和镓( )都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
(1)硅的基态原子价层电子轨道表示式_______ ,镓的基态原子电子排布式_______ 。
(2)硅和锗与氯元素都能形成氯化物,沸点 ,解释原因。
,解释原因。_______ 。
(3)镓( )的同族元素
)的同族元素 ,其气态单个
,其气态单个 分子的空间构型为
分子的空间构型为_______ ,事实证明熔融态氯化铝可挥发出二聚分子 ,其结构如图所示,请在图上用“→”标出其配位键
,其结构如图所示,请在图上用“→”标出其配位键_______ 。 和
和 都是第3周期元素,在第3周期所有元素中,第一电离能比
都是第3周期元素,在第3周期所有元素中,第一电离能比 高的有
高的有_______ 种。

(4)自然界矿石中锗浓度非常低,因此从锗加工废料(含游离态锗)中回收锗是一种非常重要的方法。下面是一种提取锗的流程:

① 溶液浸取含锗废料中的锗时发生反应的离子方程式为
溶液浸取含锗废料中的锗时发生反应的离子方程式为_______ ,为了加快 溶液浸取含锗废料的速率可以采取的措施有
溶液浸取含锗废料的速率可以采取的措施有_______ 。
②操作1和操作2是_______ 。
③ 的熔点为1086℃,利用氢气还原
的熔点为1086℃,利用氢气还原 ,每生成
,每生成 的
的 放出
放出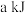 的热量,该反应的热化学方程式为
的热量,该反应的热化学方程式为_______ 。
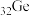 ,熔点937℃)和镓(
,熔点937℃)和镓( )都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。(1)硅的基态原子价层电子轨道表示式
(2)硅和锗与氯元素都能形成氯化物,沸点
 ,解释原因。
,解释原因。(3)镓(
 )的同族元素
)的同族元素 ,其气态单个
,其气态单个 分子的空间构型为
分子的空间构型为 ,其结构如图所示,请在图上用“→”标出其配位键
,其结构如图所示,请在图上用“→”标出其配位键 和
和 都是第3周期元素,在第3周期所有元素中,第一电离能比
都是第3周期元素,在第3周期所有元素中,第一电离能比 高的有
高的有
(4)自然界矿石中锗浓度非常低,因此从锗加工废料(含游离态锗)中回收锗是一种非常重要的方法。下面是一种提取锗的流程:

①
 溶液浸取含锗废料中的锗时发生反应的离子方程式为
溶液浸取含锗废料中的锗时发生反应的离子方程式为 溶液浸取含锗废料的速率可以采取的措施有
溶液浸取含锗废料的速率可以采取的措施有②操作1和操作2是
③
 的熔点为1086℃,利用氢气还原
的熔点为1086℃,利用氢气还原 ,每生成
,每生成 的
的 放出
放出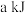 的热量,该反应的热化学方程式为
的热量,该反应的热化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的简化核外电子排布式是____ ,原子核外电子占据最高能级的电子云轮廓图为____ 。
(2)硒的含氧酸有H2SeO3、H2SeO4。酸性:H2SeO3____ H2SeO4(填“>”“<”或“=”)。SeO 的空间构型是
的空间构型是____ 。
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____ 。写出和该阴离子互为等电子体的一种分子的结构式____ 。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____ 。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN—的结构式可以表示为[S=C=N]—或[S-C≡N]—,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN—中提供孤电子对的原子可能是_____ 。
(6)某离子晶体XY2的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有____ 个。
②设该晶体的摩尔质量为Mg•mol-1,晶胞的密度为ρg•cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为____ cm。
(1)基态Ga原子的简化核外电子排布式是
(2)硒的含氧酸有H2SeO3、H2SeO4。酸性:H2SeO3
 的空间构型是
的空间构型是(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN—的结构式可以表示为[S=C=N]—或[S-C≡N]—,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN—中提供孤电子对的原子可能是
(6)某离子晶体XY2的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有
②设该晶体的摩尔质量为Mg•mol-1,晶胞的密度为ρg•cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】环烷酸金属(Cu、Ni、Co、Sn、Zn)盐常作为合成聚氨酯过程中的有效催化剂。回答下列问题:
(1)基态Cu原子的价电子排布____ ,金属Cu晶体采取的是以下____ (填序号)面心立方最密堆积方式。

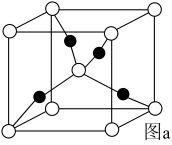
如图a所示,(●代表Cu原子,○代表O原子),一个Cu2O晶胞中Cu原子的数目为___ 。
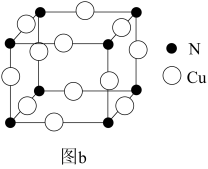
N和Cu形成的化合物的晶胞结构如图所示,该化合物的相对分子质量为M,NA为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是____ g•cm-3。
(2)镍的氨合离子[Ni(NH3)6]2+中存在的化学键有___ 。
A.离子键B.共价键C.配位键D.氢键E.σ键F.π键
(3)Ni、Co的第五电离能:I5(Ni)=73339kJ·mol-1,I5(Co)=7670kJ·mol-1,I5(Ni)<I5(Co),其原因是____ 。橙红色晶体羰基钴[Co2(Co)8]的熔点为52℃,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为___ (填元素符号)。配体CO中σ键与π键数目之比是___ 。
(4)硒化锌晶胞结构如图所示,其晶胞参数为apm。

①相邻的Se2+与Zn2+之间的距离为___ pm。
②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标___ 。
(1)基态Cu原子的价电子排布

如图a所示,(●代表Cu原子,○代表O原子),一个Cu2O晶胞中Cu原子的数目为

N和Cu形成的化合物的晶胞结构如图所示,该化合物的相对分子质量为M,NA为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是

(2)镍的氨合离子[Ni(NH3)6]2+中存在的化学键有
A.离子键B.共价键C.配位键D.氢键E.σ键F.π键
(3)Ni、Co的第五电离能:I5(Ni)=73339kJ·mol-1,I5(Co)=7670kJ·mol-1,I5(Ni)<I5(Co),其原因是
(4)硒化锌晶胞结构如图所示,其晶胞参数为apm。

①相邻的Se2+与Zn2+之间的距离为
②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】钒是重要的战略资源,以硫酸工业产生的废钒催化剂为原料(含V2O5、VOSO4、K2SO4、SiO2以及少量的Fe2O3等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下: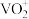 、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
(1)“水浸”前,通常需要将催化剂粉碎,其目的是___________ 。
(2)“滤渣2”转化为Na2SiO3的化学方程式是___________ 。
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,pH需保持在1.2以下的原因是___________ 。
②过程中除了有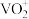 被还原成VO2+,还涉及的反应离子方程式为
被还原成VO2+,还涉及的反应离子方程式为___________ 。
③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供___________ (选填“孤对电子”或“空轨道”)。 2H++VOR(有机层),“反萃取”应选择在
2H++VOR(有机层),“反萃取”应选择在___________ 环境中进行(选填“酸性”、“中性”或“碱性”)。
(5)加氨水生成VO(OH)2沉淀,若经焙烧得到1molV2O5产品,则消耗空气中O2______ mol。
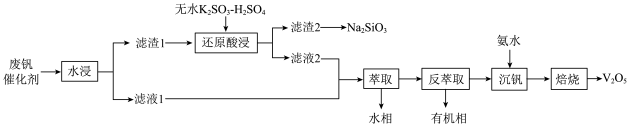
 、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。(1)“水浸”前,通常需要将催化剂粉碎,其目的是
(2)“滤渣2”转化为Na2SiO3的化学方程式是
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,pH需保持在1.2以下的原因是
②过程中除了有
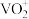 被还原成VO2+,还涉及的反应离子方程式为
被还原成VO2+,还涉及的反应离子方程式为③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供
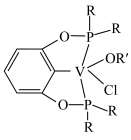
 2H++VOR(有机层),“反萃取”应选择在
2H++VOR(有机层),“反萃取”应选择在(5)加氨水生成VO(OH)2沉淀,若经焙烧得到1molV2O5产品,则消耗空气中O2
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】三氯化铬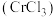 是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。 沸点为
沸点为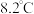 ,有毒,易水解。
,有毒,易水解。
(1)“热分解”发生反应的化学方程式为___________ 。
(2)“热反应”制无水 的实验装置如图所示(
的实验装置如图所示( 中加热装置略)。
中加热装置略)。 的目的是
的目的是___________ 。
②A中仪器X的名称是___________ ,其作用是___________ 。
③E中收集的物质含有___________ (写化学式)。
④尾气经___________ 处理后可循环使用。
(3)已知 配合物
配合物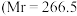 ,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取
溶于水,一定条件下结晶析出暗绿色晶体。称取 该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.
溶液,得到2. 白色沉淀。
白色沉淀。
① 中存在的化学键有
中存在的化学键有___________ (填序号)。
a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为___________ 。
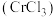 是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
 沸点为
沸点为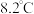 ,有毒,易水解。
,有毒,易水解。(1)“热分解”发生反应的化学方程式为
(2)“热反应”制无水
 的实验装置如图所示(
的实验装置如图所示( 中加热装置略)。
中加热装置略)。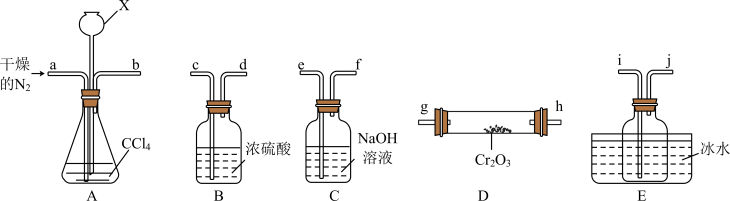
 的目的是
的目的是②A中仪器X的名称是
③E中收集的物质含有
④尾气经
(3)已知
 配合物
配合物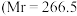 ,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取
溶于水,一定条件下结晶析出暗绿色晶体。称取 该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.
溶液,得到2. 白色沉淀。
白色沉淀。①
 中存在的化学键有
中存在的化学键有a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】2022年北京冬季奥运会场馆建设使用了大量不锈钢材质,不锈钢属于铁碳合金,常含铬(Cr)、镍(Ni)等元素。回答下列问题:
(1)某钛酸盐晶体结构模型如图1所示。该晶体的化学式是_______ ,在晶体中1个Co原子周围距离最近的O原子数目为_______ 个。

(2)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图2所示。晶体中每个镁原子周围距离最近的铁原子有_______ 个,该铁镁合金中原子个数比Fe:Mg=_______ ;原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),C为( ,
, ,0),B点坐标参数为
,0),B点坐标参数为_______ 。

(3)金属铬晶胞如图3,已知其密度为ag•cm-3,阿伏加德罗常数的值为NA,则晶体中铬原子的半径为_______ cm(用含NA的表达式表示)。

(1)某钛酸盐晶体结构模型如图1所示。该晶体的化学式是

(2)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图2所示。晶体中每个镁原子周围距离最近的铁原子有
 ,
, ,0),B点坐标参数为
,0),B点坐标参数为
(3)金属铬晶胞如图3,已知其密度为ag•cm-3,阿伏加德罗常数的值为NA,则晶体中铬原子的半径为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】选修原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________ 种不同运动状态的电子,基态T原子有________ 种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________ (用元素符号表示)
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为________ 。
(4)Z与R能形成化合物甲,1mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为________ ,________ 。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为________ 。
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为
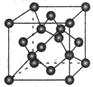
(7)X单质的晶胞如图所示,一个X晶胞中有________ 个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为________ cm(用代数式表示)。
(1)Y原子核外共有
(2)X、Y、Z的第一电离能由小到大的顺序为
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为
(4)Z与R能形成化合物甲,1mol甲中含
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为
(7)X单质的晶胞如图所示,一个X晶胞中有

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】回答下列问题
(1)Li2O是离子晶体,其晶格能可通过图甲的Born-Haber循环计算得到。

①由图甲可知,Li原子的第一电离能为______ kJ/mol,O=O键键能为______ kJ/mol,Li2O晶格能为______ kJ/mol。
②Li2O具有反萤石结构,晶胞如图乙所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为______ g/cm3 (列出计算式)。

(2)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对分子质量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______ g/cm3;晶胞中Fe2+位于S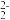 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为______ nm。

(3)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为______ g/cm3 (列出计算式)。

(4)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________ ;其最高价氧化物对应水化物的化学式是________ 。
(1)Li2O是离子晶体,其晶格能可通过图甲的Born-Haber循环计算得到。

①由图甲可知,Li原子的第一电离能为
②Li2O具有反萤石结构,晶胞如图乙所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为

(2)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对分子质量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
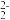 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
(3)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为

(4)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为
您最近一年使用:0次



