碲(Te)广泛用于太阳能、电子、医药等领域,对碲的综合回收利用尤为重要。工业上,从含碲化亚铜的废渣(主要成分Cu2Te,还有少量的Ag、Cu)中提取碲的流程如图:

回答下列问题:
(1)写出碲元素在元素周期表中的位置____ 。
(2)“酸浸”过程中生成TeOSO4的离子方程式为____ 。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明____ 。
(4)电解除铜时,铜、碲沉淀的关系如表。
①电解初始阶段阴极的电极反应式是____ 。
②最佳电解时间为30min,原因是____ 。
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式____ ,其中Te元素的回收率为____ (忽略溶液体积变化,结果用百分数表示,保留二位有效数字)。
(6)整个过程中可循环利用的物质为____ (填化学式)。

回答下列问题:
(1)写出碲元素在元素周期表中的位置
(2)“酸浸”过程中生成TeOSO4的离子方程式为
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明
(4)电解除铜时,铜、碲沉淀的关系如表。
| 电解时间(min) | 铜沉淀率 | 碲沉淀率 |
| 10 | 25% | 0.1% |
| 20 | 40% | 0.2% |
| 30 | 62% | 0.4% |
| 40 | 65% | 2.0% |
②最佳电解时间为30min,原因是
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式
(6)整个过程中可循环利用的物质为
2022·江西·二模 查看更多[3]
江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题
更新时间:2022-05-05 11:34:24
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某地有软锰矿和闪锌矿两座矿山,它们的组成如下:
软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;
闪锌矿: 含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。
含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
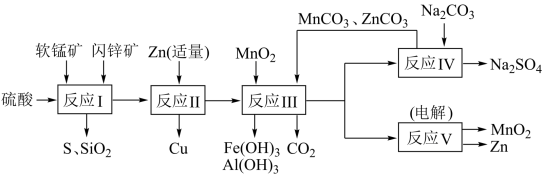
请回答下列问题:
(1)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试完成反应I中生成CuSO4和MnSO4的化学方程式:_______
MnO2+CuS+_______=_______↓+MnSO4+CuSO4+_____+_____。
(2)反应II加入适量锌的作用是___ ;如果锌过量,还会进一步发生反应的离子方程式为____ 。
(3)反应III中加入MnO2的作用是____ ,加入MnCO3、ZnCO3调节溶液的pH,则调节的pH范围是____ (pH数据见下表)。
软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;
闪锌矿:
 含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。
含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。

请回答下列问题:
(1)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试完成反应I中生成CuSO4和MnSO4的化学方程式:
MnO2+CuS+_______=_______↓+MnSO4+CuSO4+_____+_____。
(2)反应II加入适量锌的作用是
(3)反应III中加入MnO2的作用是
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
您最近一年使用:0次
【推荐2】Ⅰ.镀镍废水中的Ni2+可用还原铁粉除去。25℃时,部分氢氧化物在废水中开始沉淀和沉淀完全的pH如表所示:
(1)还原铁粉制备:向FeSO4溶液中加入碱性NaBH4溶液(其中H为-1价)可得还原铁粉,同时生成B(OH) 和H2。理论上制备1molFe,需NaBH4的物质的量为
和H2。理论上制备1molFe,需NaBH4的物质的量为___ mol。
(2)还原铁粉除镍:向废水中加入还原铁粉,可置换出镍。某小组通过实验研究废水中镍的去除效果。
①取五份废水样品各100mL,加酸或碱调节其初始pH不等,再加入等量且过量的铁粉,充分反应后测得废水中镍含量随溶液初始pH的变化如图1所示。pH太小,残留的镍含量较高,原因是___ ;pH>6.6时,残留的镍含量随溶液初始pH增大而增多的原因是___ 。
②取100mL废水样品,向其中加入适量铁粉,测得溶液的pH、Fe(Ⅱ)的含量和总铁含量变化如图2所示,Fe(Ⅱ)含量表示溶液及沉淀中+2价的铁元素,总铁表示溶液及沉淀中化合态的铁元素。40~60min内,溶液pH约为6.4,该时间段内引起Fe(Ⅱ)含量降低的反应的离子方程式为__ 。

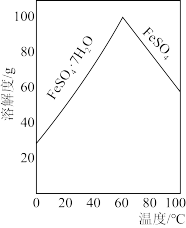
(3)某学习小组欲以废铁泥(主要成分为Fe2O3、FeO和少量Fe)为原料,制备FeSO4·7H2O晶体。请结合如图的溶解度曲线,写出制备FeSO4·7H2O晶体的实验方案____ 。(实验中须使用的试剂:铁粉、稀硫酸、冰水)
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.6 | 7.7 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.2 |
 和H2。理论上制备1molFe,需NaBH4的物质的量为
和H2。理论上制备1molFe,需NaBH4的物质的量为(2)还原铁粉除镍:向废水中加入还原铁粉,可置换出镍。某小组通过实验研究废水中镍的去除效果。
①取五份废水样品各100mL,加酸或碱调节其初始pH不等,再加入等量且过量的铁粉,充分反应后测得废水中镍含量随溶液初始pH的变化如图1所示。pH太小,残留的镍含量较高,原因是
②取100mL废水样品,向其中加入适量铁粉,测得溶液的pH、Fe(Ⅱ)的含量和总铁含量变化如图2所示,Fe(Ⅱ)含量表示溶液及沉淀中+2价的铁元素,总铁表示溶液及沉淀中化合态的铁元素。40~60min内,溶液pH约为6.4,该时间段内引起Fe(Ⅱ)含量降低的反应的离子方程式为

(3)某学习小组欲以废铁泥(主要成分为Fe2O3、FeO和少量Fe)为原料,制备FeSO4·7H2O晶体。请结合如图的溶解度曲线,写出制备FeSO4·7H2O晶体的实验方案

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。
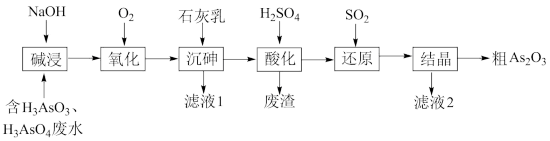
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是___________ 。
(2)“氧化”时,1mol AsO 转化为AsO
转化为AsO 至少需要O2
至少需要O2_____ 。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)△H<0
b.5Ca2++OH-+3AsO ⇌Ca5(AsO4)3OH △H>0
⇌Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。高于85℃后,随温度升高,沉淀率______ (填“提高”或“下降”)。用化学平衡原理解释其原因是___________ 。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是___________ 。
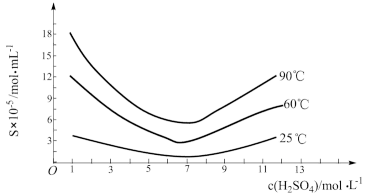
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是___________ 。
(6)下列说法中,正确的是___________ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液1、2和废渣一同弃掉
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是
(2)“氧化”时,1mol AsO
 转化为AsO
转化为AsO 至少需要O2
至少需要O2(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)△H<0
b.5Ca2++OH-+3AsO
 ⇌Ca5(AsO4)3OH △H>0
⇌Ca5(AsO4)3OH △H>0研究表明:“沉砷”的最佳温度是85℃。高于85℃后,随温度升高,沉淀率
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是

(6)下列说法中,正确的是
a.粗As2O3中含有CaSO4
b.工业生产中,滤液1、2和废渣一同弃掉
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
您最近一年使用:0次
【推荐1】Ⅰ.氮的固定是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
(1)分析数据可知:大气固氮反应属于___________ (“吸热”或 “放热”)反应。
(2)分析数据可知:人类___________ ( “适合”或 “不适合”)大规模模拟大气固氮。
(3)从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择 左右的高温,解释其原因:
左右的高温,解释其原因:___________ 。
Ⅱ.已知工业固氮反应: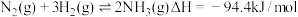 。恒容时,体系中各物质浓度随时间变化的曲线如图所示,各时间段最终均达平衡状态。
。恒容时,体系中各物质浓度随时间变化的曲线如图所示,各时间段最终均达平衡状态。
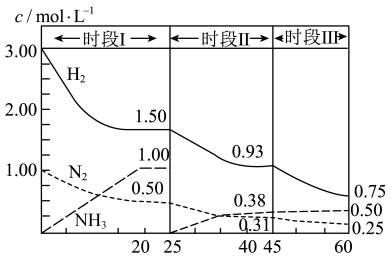
(4)在 容器中发生反应,前
容器中发生反应,前 内,
内,
___________ 。
(5)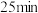 时采取的某种措施是
时采取的某种措施是___________ 。
(6)时段Ⅲ条件下反应的平衡常数为___________ (保留2位小数)。
Ⅲ.20世纪末,科学家采用高质子导电性的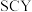 陶瓷(能传递
陶瓷(能传递 )为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如下图所示:
)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如下图所示:
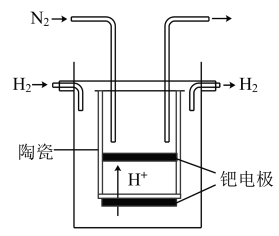
(7)阴极的电极反应式是___________ 。
| 反应 | 大气固氮 | 工业固氮 | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K |  | 0.1 | 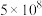 | 0.507 | 0.152 |
(1)分析数据可知:大气固氮反应属于
(2)分析数据可知:人类
(3)从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择
 左右的高温,解释其原因:
左右的高温,解释其原因:Ⅱ.已知工业固氮反应:
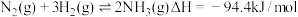 。恒容时,体系中各物质浓度随时间变化的曲线如图所示,各时间段最终均达平衡状态。
。恒容时,体系中各物质浓度随时间变化的曲线如图所示,各时间段最终均达平衡状态。
(4)在
 容器中发生反应,前
容器中发生反应,前 内,
内,
(5)
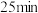 时采取的某种措施是
时采取的某种措施是(6)时段Ⅲ条件下反应的平衡常数为
Ⅲ.20世纪末,科学家采用高质子导电性的
 陶瓷(能传递
陶瓷(能传递 )为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如下图所示:
)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如下图所示:
(7)阴极的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】完成下列问题。
(1)用 溶液吸收烟气中的
溶液吸收烟气中的 ,将所得的
,将所得的 溶液进行电解,可循环再生
溶液进行电解,可循环再生 ,同时得到
,同时得到 ,其原理如图所示,电极材料为石墨。
,其原理如图所示,电极材料为石墨。
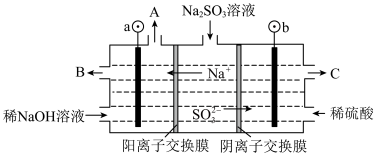
①图中b极要连接电源的______ (填“正”或“负”)极,B物质是________ 。
② 放电的电极反应式为:
放电的电极反应式为:________ 。
(2)已知 ,利用该反应设计电池的装置如图所示,此方法既能有效清除废气中的氮氧化物,减轻环境污染,又能充分利用化学能。
,利用该反应设计电池的装置如图所示,此方法既能有效清除废气中的氮氧化物,减轻环境污染,又能充分利用化学能。
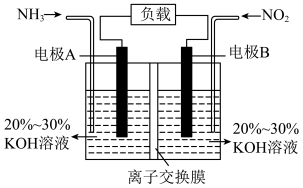
为使电池持续放电,离子交换膜需选用______ (填“阳”或“阴”)离子交换膜;电极A的电极反应式为_______ ;当有 (已折算成标准状况下的体积)
(已折算成标准状况下的体积) 被处理时,转移的电子数为
被处理时,转移的电子数为_______ 。
(1)用
 溶液吸收烟气中的
溶液吸收烟气中的 ,将所得的
,将所得的 溶液进行电解,可循环再生
溶液进行电解,可循环再生 ,同时得到
,同时得到 ,其原理如图所示,电极材料为石墨。
,其原理如图所示,电极材料为石墨。
①图中b极要连接电源的
②
 放电的电极反应式为:
放电的电极反应式为:(2)已知
 ,利用该反应设计电池的装置如图所示,此方法既能有效清除废气中的氮氧化物,减轻环境污染,又能充分利用化学能。
,利用该反应设计电池的装置如图所示,此方法既能有效清除废气中的氮氧化物,减轻环境污染,又能充分利用化学能。
为使电池持续放电,离子交换膜需选用
 (已折算成标准状况下的体积)
(已折算成标准状况下的体积) 被处理时,转移的电子数为
被处理时,转移的电子数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
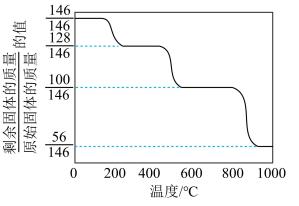
①写出400~600 ℃范围内分解反应的化学方程式:________ 。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________ 。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:________ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________ 。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
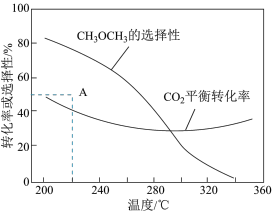
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
CH3OCH3的选择性=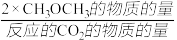 ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________ 。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________ 。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=
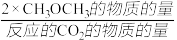 ×100%
×100%①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
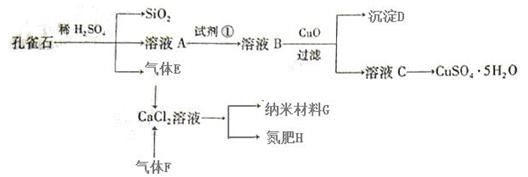
【推荐1】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:
已知:
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲ (填化学式)。写出该反应的化学方程式 ▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲ (填名称);滴定达到终点的现象为 ▲ 。

已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲ (填化学式)。写出该反应的化学方程式 ▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲ (填名称);滴定达到终点的现象为 ▲ 。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】“高压氢还原法”可直接从溶液中提取金属Cu粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
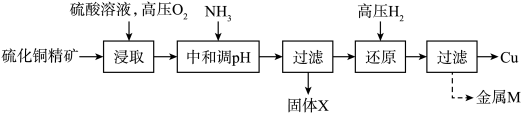
请回答下列问题:
(1)“浸取”时,能够提高浸取率的措施有___________ (任写一条即可)。
(2)“浸取”过程中,1mol CuS参与反应时,转移2NA电子,写出该过程CuS发生的离子反应方程式___________ 。
(3)工业上对硫化铜精矿的预处理有很多方法,相比于高压氢还原法的“浸取”步骤,在空气中“高温焙烧法”最大的缺点是___________ 。
(4)流程图中“中和调pH”一步,氨水调节的pH范围为___________ 。
(5)“过滤”操作用到的玻璃仪器有___________ 。
(6)固体X的主要成分是___________ ,金属M的成分___________ 。

 |  |  | |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 |
(1)“浸取”时,能够提高浸取率的措施有
(2)“浸取”过程中,1mol CuS参与反应时,转移2NA电子,写出该过程CuS发生的离子反应方程式
(3)工业上对硫化铜精矿的预处理有很多方法,相比于高压氢还原法的“浸取”步骤,在空气中“高温焙烧法”最大的缺点是
(4)流程图中“中和调pH”一步,氨水调节的pH范围为
(5)“过滤”操作用到的玻璃仪器有
(6)固体X的主要成分是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
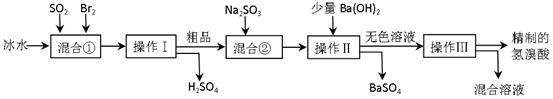
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为_________ 。
(2)混合①中使用冰水的目的是______________ 。
(3)操作Ⅱ和操作Ⅲ的名称分别是________ 、_______ 。
操作Ⅲ一般适用于分离____________ 混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是_______________________________ 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为____________ ,若假设成立可观察到的现象为_________________ 。
乙同学假设工业氢溴酸呈淡黄色是因为_______ ,其用于证明该假设所用的试剂为____________ 。

根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为
(2)混合①中使用冰水的目的是
(3)操作Ⅱ和操作Ⅲ的名称分别是
操作Ⅲ一般适用于分离
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为
乙同学假设工业氢溴酸呈淡黄色是因为
您最近一年使用:0次



