常温下,向一定浓度的H2X溶液中滴加NaOH溶液,混合溶液的的pH与离子浓度变化的关系如图所示。下列叙述不正确的是
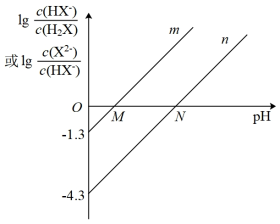
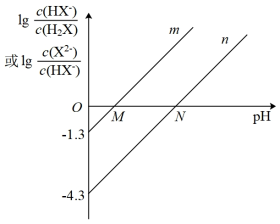
| A.H2X的电离常数Ka2的数量级为10-5 |
B.直线m表示pH与 的关系 的关系 |
| C.当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-) |
| D.N点水电离出的c(H+)=1×10-4.3mol·L-1 |
更新时间:2022-05-27 15:09:41
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,下列说法正确的是
| A.某溶液中,由水电离的H+浓度为10-9mol·L-1,则此溶液呈酸性 |
| B.已知 NH3∙H2O与CH3COOH的电离平衡常数相等,某浓度的NH4Cl溶液的pH=4.3,则相同浓度的CH3COONa溶液的pH=9.7 |
C.N2H4的水溶液呈弱碱性,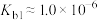 ,则0.01 mol·L-1N2H4水溶液的pH≈11 ,则0.01 mol·L-1N2H4水溶液的pH≈11 |
| D.pH=7的某溶液,溶质对水的电离平衡肯定无影响 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.lmol/L的KOH溶液以测定氯水的浓度。此过程中溶液pH变化的曲线如图所示。

下列叙述中正确的是( )

下列叙述中正确的是( )
| A.滴定过程中,当水电离的c(H+)=10-7mol/L时,溶液显中性 |
| B.滴定过程中宜选用酚酞为指示剂,不宜选用甲基橙为指示剂 |
| C.②点的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-) |
| D.③点溶液中c(K+)+c(H+)=c(OH-)+c(Cl-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知某二元酸H2A电离情况:H2A=H++HA-,HA-⇌H++A2-且0.1mol/LnaHA溶液中c(A2-)=0.01mol/L,下列情况分析正确的是( )
| A.0.1mol/LH2A溶液中c(H+)=0.11mol/L |
| B.在NaHA溶液中只存在1种分子 |
| C.NaHA溶液呈碱性 |
| D.某溶液由1mol/LNaHA溶液与1mol/LNaOH溶液在常温下等体积混合而得,则溶液中离子浓度由大到小顺序为c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】298K时,向  二元弱酸
二元弱酸  溶液中滴加
溶液中滴加  溶液,溶液中的
溶液,溶液中的  ,
, ,
,  的物质的量分数
的物质的量分数
 随 pH的变化如图所示。下列说法错误的是
随 pH的变化如图所示。下列说法错误的是

 已知
已知
 二元弱酸
二元弱酸  溶液中滴加
溶液中滴加  溶液,溶液中的
溶液,溶液中的  ,
, ,
,  的物质的量分数
的物质的量分数
 随 pH的变化如图所示。下列说法错误的是
随 pH的变化如图所示。下列说法错误的是 
 已知
已知
A.加入  时, 时, |
B.当  , ,  |
C. |
D.当混合溶液呈中性时, |
您最近一年使用:0次




