单晶边缘纳米催化剂技术为工业上有效利用二氧化碳提供了一条经济可行的途径,其中单晶氧化镁负载镍催化剂表现出优异的抗积碳和抗烧结性能。
(1)基态镍原子的价层电子排布图为___________ 。
(2)氧化镁载体及镍催化反应中涉及到CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为___________ ;在上述三种物质的分子中碳原子杂化类型不同于其他两种的是______ ,立体构型为正四面体的分子是___________ ,三 种物质中沸点最高的是CH3OH,其原因是___________ 。
(3)Ni与CO在60~80°C时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是___________ ,Ni(CO)4晶体类型是___________ 。
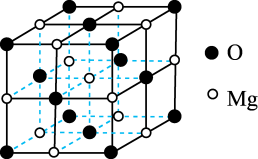
(4)已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgO晶胞棱长为0.42nm,则MgO的密度为___________ g·cm-3(保留小数点后一位,下同);相邻Mg2+之间的最短距离为___________ nm。(已知 =1.414,
=1.414, 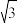 =1.732)
=1.732)
(1)基态镍原子的价层电子排布图为
(2)氧化镁载体及镍催化反应中涉及到CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为
(3)Ni与CO在60~80°C时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是
(4)已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgO晶胞棱长为0.42nm,则MgO的密度为
 =1.414,
=1.414, 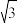 =1.732)
=1.732)
更新时间:2022-06-09 21:05:30
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为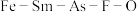 组成的化合物。回答下列问题:
组成的化合物。回答下列问题:
①基态Fe原子中,核外存在___________ 个运动状态不同的电子,Sm的价电子排布式为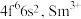 价电子排布式为
价电子排布式为___________ 。
②基态F原子的价电子轨道表达式为___________ 。基态As电子排布式为___________ 。
(2)基态硫原子核外电子的空间运动状态有___________ 种;其核外电子运动最高能级的电子云轮廓图的形状为___________ 。
(3)现有四种元素的基态原子的电子排布式如下:①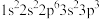 ;②
;②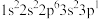 ;③
;③ ;④
;④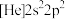 。有关原子半径由大到小的顺序正确的是
。有关原子半径由大到小的顺序正确的是___________ (填序号)
(4)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填选项)。
(1)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为
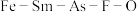 组成的化合物。回答下列问题:
组成的化合物。回答下列问题:①基态Fe原子中,核外存在
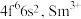 价电子排布式为
价电子排布式为②基态F原子的价电子轨道表达式为
(2)基态硫原子核外电子的空间运动状态有
(3)现有四种元素的基态原子的电子排布式如下:①
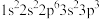 ;②
;②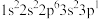 ;③
;③ ;④
;④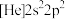 。有关原子半径由大到小的顺序正确的是
。有关原子半径由大到小的顺序正确的是(4)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填选项)。
A.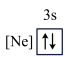 | B.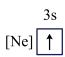 | C.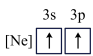 | D. |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】镁合金的典型含量为大于90%的Mg、2~9%的Al、1~3%的Zn、0.2%的Mn,若熔进稀土金属(如镨、钍),可以大大提高镁合金在高温条件保持其强度的能力。Zn的熔点为419.5℃,Mg的熔点为650℃。回答下列问题:
(1)基态Mn原子的价电子排图(轨道表示式)为_______ 。
(2)Mg、Zn的晶体结构相同(如图a),下列叙述正确的是_______(填标号)。
(3)工业上均采用碳酸盐分解法制取氧化镁与生石灰,MgCO3的分解温度_______ (填“高于”或“低于”) CaCO3,原因是_______ 。
(4)人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。_______ ;写出两个与CO2互为等电子体的阴离子的化学式_______ 。
②碳酸酐酶的部分结构如图b所示,为Zn2+提供电子对形成配位键的原子有_______ 个,图b中碳原子的杂化类型为_______ 。
(5)一种锌镁合金的六方晶胞如图c所示,除棱心和顶角外,晶胞内还有六个 原子,所有的Mg均在晶胞内部。则合金密度为
原子,所有的Mg均在晶胞内部。则合金密度为_______ g▪ cm-3 (写出计算式即可,阿伏加德常数用NA表示)。
(1)基态Mn原子的价电子排图(轨道表示式)为
(2)Mg、Zn的晶体结构相同(如图a),下列叙述正确的是_______(填标号)。
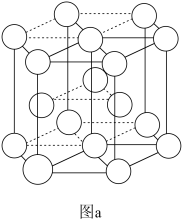
| A.金属键:Mg强于Zn | B.原子的配位数为8 |
| C.晶胞的空间利用率为68% | D.晶体中既存在四面体空隙又存在八面体空隙 |
(4)人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。
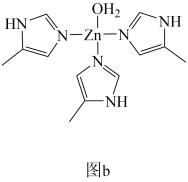
②碳酸酐酶的部分结构如图b所示,为Zn2+提供电子对形成配位键的原子有
(5)一种锌镁合金的六方晶胞如图c所示,除棱心和顶角外,晶胞内还有六个
 原子,所有的Mg均在晶胞内部。则合金密度为
原子,所有的Mg均在晶胞内部。则合金密度为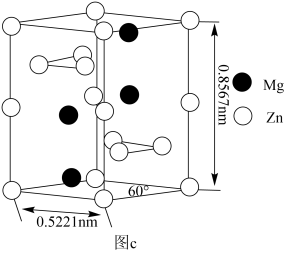
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
(1)TY2的结构式是__________ 是__________ (填“极性分子”或“非极性分子”),1mol该分子中存在________ 个σ键。

(2)基态Y原子中,电子占据的最高能层符号为__________ ,该能层具有的原子轨道数为_____________ 、电子数为_________ 。Y、氧、W元素的电负性由大到小的顺序为_________ (用元素符号作答)。
(3)已知Z的晶胞结构如图所示,又知Z的密度为a g/cm3,则Z 的半径为___________ pm;ZYO4常作电镀液,其中YO42-的等电子体是__________ ,其中Y原子的杂化轨道类型是___________ 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是___________ 。
A.O2是氧化剂 B.HO2是氧化产物
C.HO2在碱中能稳定存在 D.1 mol Z参加反应有1 mol电子发生转移
| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一离能至第四电离能分别I1=578 kJ/mol; I2= l817 kJ/mol; I3=2745 kJ/mol;I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |

(2)基态Y原子中,电子占据的最高能层符号为
(3)已知Z的晶胞结构如图所示,又知Z的密度为a g/cm3,则Z 的半径为
A.O2是氧化剂 B.HO2是氧化产物
C.HO2在碱中能稳定存在 D.1 mol Z参加反应有1 mol电子发生转移
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】1985年,Rousssin研究发现了第一个金属原子簇类配位化合物,其结构如图所示,金属原子簇类化合物与金属原子表面性质相似,具有良好的催化活性等功能。
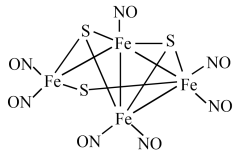
请回答下列问题:
(1)基态Fe的价电子轨道表达式为___________ 。
(2)在周期表中,O元素属于___________ 区。
(3)上述原子簇类配合物,中心原子铁的配位原子为___________ 。
(4)该配合物中存在的作用力有___________(填字母)。
(5)配合物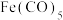 的熔点为-20℃,沸点为103℃。可用于制备纯铁。
的熔点为-20℃,沸点为103℃。可用于制备纯铁。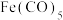 的结构(正八面体)如图所示。下列关于
的结构(正八面体)如图所示。下列关于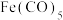 的说法正确的是___________(填字母)。
的说法正确的是___________(填字母)。
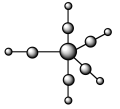

请回答下列问题:
(1)基态Fe的价电子轨道表达式为
(2)在周期表中,O元素属于
(3)上述原子簇类配合物,中心原子铁的配位原子为
(4)该配合物中存在的作用力有___________(填字母)。
| A.配位键 | B.离子键 | C.氢键 | D.范德华力 |
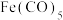 的熔点为-20℃,沸点为103℃。可用于制备纯铁。
的熔点为-20℃,沸点为103℃。可用于制备纯铁。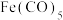 的结构(正八面体)如图所示。下列关于
的结构(正八面体)如图所示。下列关于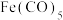 的说法正确的是___________(填字母)。
的说法正确的是___________(填字母)。
A.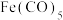 是非极性分子,CO是极性分子 是非极性分子,CO是极性分子 |
B.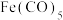 中Fe原子以sp3杂化方式与CO成键 中Fe原子以sp3杂化方式与CO成键 |
C.1mol 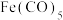 含有10mol配位键 含有10mol配位键 |
D.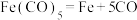 反应中没有新化学键生成 反应中没有新化学键生成 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】近期,福建物构所钙钛矿太阳能电池研究获得重大进展。某种钙钛矿由Ca、Ti和O三种元素组成。回答下列问题:
(1)基态Ti原子3d电子占据的轨道数目为___________ ,原因是___________ 。
(2)第一电离能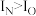 ,原因是
,原因是___________ 。
(3)以O原子为中心的 经常作为配合物的配体;但是
经常作为配合物的配体;但是 不能做为配体,
不能做为配体, 中O原子的杂化方式为
中O原子的杂化方式为___________ ; 不能作为配体的原因是
不能作为配体的原因是___________ 。
(4)某种钙钛矿晶胞结构如下图,晶体的化学式为___________ ;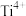 的配位数为
的配位数为___________ ;若以 为晶胞的顶点,则
为晶胞的顶点,则 位于晶胞的
位于晶胞的___________ 。
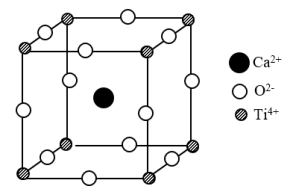
(5)若从二维平面角度观察钙钛矿,可以发现 与
与 构成了密置层,请在上图中用虚线表示出该密置层。
构成了密置层,请在上图中用虚线表示出该密置层。___________
(1)基态Ti原子3d电子占据的轨道数目为
(2)第一电离能
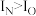 ,原因是
,原因是(3)以O原子为中心的
 经常作为配合物的配体;但是
经常作为配合物的配体;但是 不能做为配体,
不能做为配体, 中O原子的杂化方式为
中O原子的杂化方式为 不能作为配体的原因是
不能作为配体的原因是(4)某种钙钛矿晶胞结构如下图,晶体的化学式为
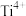 的配位数为
的配位数为 为晶胞的顶点,则
为晶胞的顶点,则 位于晶胞的
位于晶胞的
(5)若从二维平面角度观察钙钛矿,可以发现
 与
与 构成了密置层,请在上图中用虚线表示出该密置层。
构成了密置层,请在上图中用虚线表示出该密置层。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】A、B、C、D四种常见元素的结构信息如下表。试根据信息回答有关问题。
(1)写出基态B原子的电子排布式:_______________ 。
(2)向CSO4的溶液中逐滴加入过量X的水溶液,可生成的配合物的化学式为_____ ,该物质中不存在的作用类型为___________ (填字母)。
a.离子键 b.配位键 c.极性键 d.氢键
(3)下列几种氢化物分子:
① AH3 ②D2H2③H2B ④DH4
中心原子采用sp3杂化形成化学键的是_______ (填序号);在②的分子中有 ___ 个σ键,该分子中电子运动状态共有 _________ 种。
| 元素 | A | B | C | D |
| 性质结构信息 | 最常见氢化物X为三角锥分子且能与 HCl发生化合反应生成盐 | 原子的 M 层上电子数比L层电子数少2个 | ds区元素,N 层上有一个电子 | 原子的s电子数是p电子数的2倍 |
(1)写出基态B原子的电子排布式:
(2)向CSO4的溶液中逐滴加入过量X的水溶液,可生成的配合物的化学式为
a.离子键 b.配位键 c.极性键 d.氢键
(3)下列几种氢化物分子:
① AH3 ②D2H2③H2B ④DH4
中心原子采用sp3杂化形成化学键的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___ ,基态Ga原子核外电子排布式为___ 。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____ 。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___ ,提供孤电子对的成键原子是___ 。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___ 。
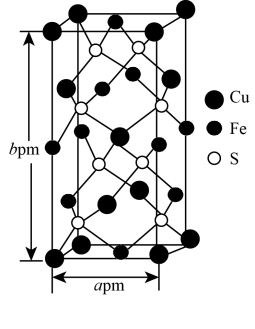
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____ 个S原子相连,含铜化合物的化学式为____ 。设NA为阿伏加 德罗常数的值,则该晶胞的密度为___ g•cm‑3(用含a、b、NA的代数式表示)。
(1)晶体硅中Si原子的杂化方式是
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】ⅣA族元素及其化合物在材料等方面有重要用途 回答下列问题:
回答下列问题:
(1)碳的一种单质的结构如图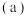 所示
所示 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为______
(2) 分子的立体构型为
分子的立体构型为______ ,属于______ 分子(填“极性”或“非极性”)
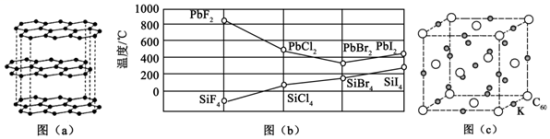
(3)四卤化硅 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图
的熔点如图 所示.
所示.
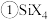 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是______
 结合
结合 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键的离子性
中的化学键的离子性______ (填“增强”“不变”或“减弱)
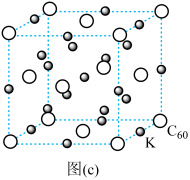
(4)碳的另一种单质 可以与钾形成低温超导化合物,晶体结构如图
可以与钾形成低温超导化合物,晶体结构如图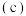 所示
所示 位于立方体的棱上和立方体的内部,此化合物的化学式为
位于立方体的棱上和立方体的内部,此化合物的化学式为______ ,其晶胞参数为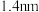 ,晶体密度为
,晶体密度为______  (列计算式)
(列计算式)
 回答下列问题:
回答下列问题:(1)碳的一种单质的结构如图
 所示
所示 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为
(2)
 分子的立体构型为
分子的立体构型为(3)四卤化硅
 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图
的熔点如图 所示.
所示.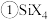 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是 结合
结合 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键的离子性
中的化学键的离子性(4)碳的另一种单质
 可以与钾形成低温超导化合物,晶体结构如图
可以与钾形成低温超导化合物,晶体结构如图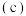 所示
所示 位于立方体的棱上和立方体的内部,此化合物的化学式为
位于立方体的棱上和立方体的内部,此化合物的化学式为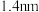 ,晶体密度为
,晶体密度为 (列计算式)
(列计算式)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】KZnF3被认为是良好的光学基质材料,可由K2CO3、ZnF2、NH4HF2制备。
回答下列问题:
(1)基态F原子的价电子轨道表达式为_________ ;基态Zn原子核外占据最高能层电子的电子云轮廓图形状为____________ 。
(2)K与Zn属于同一周期,K的第一电离能_____ (填“大于”或“小于”)Zn的第一电离能,原因为______________ 。
(3) K2CO3中阴离子的立体构型为______ 。
(4)NH4HF2的组成元素的电负性由大到小的顺序为_______ (用元素符号表示);其中N原子的杂化方式为______ ;HF能形成分子缔合体(HF)n的原因为_____________ 。
(5)ZnF2具有金红石型四方结构,KZnF3具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
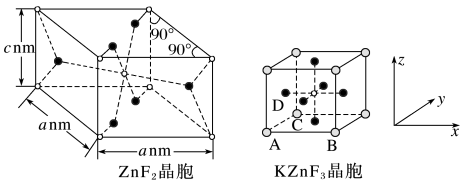
①ZnF2和KZnF3晶体(晶胞顶点为K+ )中,Zn的配位数之比为_______
②若NA表示阿伏加 德罗常数的值,则ZnF2晶体的密度为_____ g/cm3(用含a、c、NA的代数式表示)。
③KZnF3晶胞中原子坐标参数A为(0,0,0);B为(1,0,0);C为(0,1,0),则D的原子坐标参数为_________ 。
回答下列问题:
(1)基态F原子的价电子轨道表达式为
(2)K与Zn属于同一周期,K的第一电离能
(3) K2CO3中阴离子的立体构型为
(4)NH4HF2的组成元素的电负性由大到小的顺序为
(5)ZnF2具有金红石型四方结构,KZnF3具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:

①ZnF2和KZnF3晶体(晶胞顶点为K+ )中,Zn的配位数之比为
②若NA表示阿伏加 德罗常数的值,则ZnF2晶体的密度为
③KZnF3晶胞中原子坐标参数A为(0,0,0);B为(1,0,0);C为(0,1,0),则D的原子坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
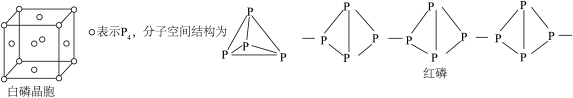
【推荐1】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)白磷晶胞属于面心立方最密堆积,每个 周围距离最近的
周围距离最近的 个数为
个数为___________ ;白磷隔绝空气加热转化为红磷,红磷是巨型分子,无定型结构,能证明白磷是晶体的实验验证方法是___________ 。
(2)黑磷晶体是一种新型材料,其中正交型黑磷具有类似石墨的片层结构。每一层内P原子形成六元环彼此相接,每个空间六元环中平均含有的P原子个数为___________ 。白磷和正交型黑磷相比,熔点较高的是___________ ,原因是___________ 。
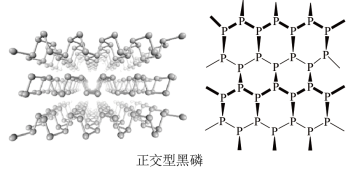
(3)BP是一种超硬耐磨涂层材料,晶胞结构与金刚石晶胞相似,其晶胞可看作金刚石晶胞内部的C原子被B原子替代,顶点和面心的C原子被P原子替代,晶胞参数为apm。沿z轴从上往下俯视的晶胞投影图如下所示。
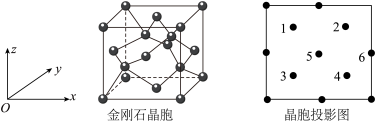
①投影图中原子5代表___________ 原子(填“P”或“B”)。
②若投影图中原子1的分数坐标是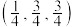 ,则原子6的分数坐标是
,则原子6的分数坐标是___________ ,原子1、6之间的距离为___________ pm。
(1)白磷晶胞属于面心立方最密堆积,每个
 周围距离最近的
周围距离最近的 个数为
个数为
(2)黑磷晶体是一种新型材料,其中正交型黑磷具有类似石墨的片层结构。每一层内P原子形成六元环彼此相接,每个空间六元环中平均含有的P原子个数为

(3)BP是一种超硬耐磨涂层材料,晶胞结构与金刚石晶胞相似,其晶胞可看作金刚石晶胞内部的C原子被B原子替代,顶点和面心的C原子被P原子替代,晶胞参数为apm。沿z轴从上往下俯视的晶胞投影图如下所示。

①投影图中原子5代表
②若投影图中原子1的分数坐标是
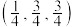 ,则原子6的分数坐标是
,则原子6的分数坐标是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
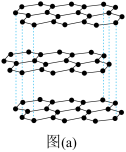
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为________ ,依据电子云的重叠方式,原子间存在的共价键类型有________ ,碳原子的杂化轨道类型为________ 。
(2)石墨烯是从石墨材料中剥离出来的、由单质碳原子组成的二维晶体。将氢气加入石墨烯中可制得一种新材料石墨烷。下列判断错误的是________ (填字母)。
a.石墨烯是一种强度很高的材料
b.石墨烯是电的良导体而石墨烷则为绝缘体
c.石墨烯与石墨烷均为高分子化合物
d.石墨烯与H2制得石墨烷的反应属于加成反应
(3)CH4、SiH4、GeH4的熔、沸点依次________ (填“增大”或“减小”),其原因是_________ 。
(4)SiO2比CO2熔点高的原因是____________________________________________________ 。
(5)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
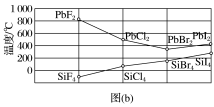
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_____________________________________ 。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性________ 、共价性________ 。(填“增强”“不变”或“减弱”)
(6)水杨酸第一级电离形成离子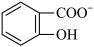 ,相同温度下,水杨酸的Ka2
,相同温度下,水杨酸的Ka2________ (填“>”“=”或“<”)苯酚(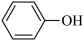 )的Ka,其原因是
)的Ka,其原因是__________________________ 。
(7)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为________ ;其晶胞参数为1.4 nm,阿伏加 德罗常数用NA表示,则晶体的密度为__________ g·cm-3。(只需列出式子)
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为

(2)石墨烯是从石墨材料中剥离出来的、由单质碳原子组成的二维晶体。将氢气加入石墨烯中可制得一种新材料石墨烷。下列判断错误的是
a.石墨烯是一种强度很高的材料
b.石墨烯是电的良导体而石墨烷则为绝缘体
c.石墨烯与石墨烷均为高分子化合物
d.石墨烯与H2制得石墨烷的反应属于加成反应
(3)CH4、SiH4、GeH4的熔、沸点依次
(4)SiO2比CO2熔点高的原因是
(5)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。

①SiX4的沸点依F、Cl、Br、I次序升高的原因是
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性
(6)水杨酸第一级电离形成离子
 ,相同温度下,水杨酸的Ka2
,相同温度下,水杨酸的Ka2 )的Ka,其原因是
)的Ka,其原因是(7)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】判断:
(1)冰和碘晶体中相互作用力相同________
(2)固体SiO2一定是晶体________
(3)在晶体中只要有阴离子就一定有阳离子________
(4)在晶体中只要有阳离子就一定有阴离子________
(5)原子晶体的熔点一定比金属晶体的高________
(6)离子晶体一定都含有金属元素________
(7)金属元素和非金属元素组成的晶体不一定是离子晶体________
(8)冰和固体碘晶体中相互作用力相同________
(9)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块________
(1)冰和碘晶体中相互作用力相同
(2)固体SiO2一定是晶体
(3)在晶体中只要有阴离子就一定有阳离子
(4)在晶体中只要有阳离子就一定有阴离子
(5)原子晶体的熔点一定比金属晶体的高
(6)离子晶体一定都含有金属元素
(7)金属元素和非金属元素组成的晶体不一定是离子晶体
(8)冰和固体碘晶体中相互作用力相同
(9)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块
您最近一年使用:0次



