回收利用 是目前解决空间站供氧问题的有效途径,其物质转化如下图:
是目前解决空间站供氧问题的有效途径,其物质转化如下图:
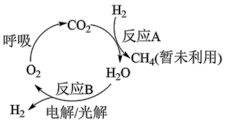
(1)反应A为 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。
已知:
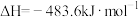
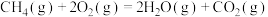
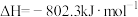
反应A的
_______  。
。
(2)将原料气按 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
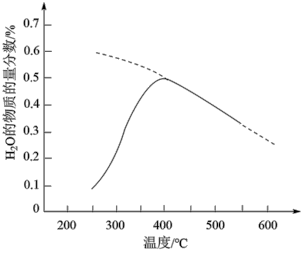
①理论上,能提高 平衡转化率的措施有
平衡转化率的措施有_______ (写出一条即可)。
②温度过高或温度过低均不利于该反应的进行,原因是_______ 。
(3)下列关于空间站内物质和能量变化的说法中,不正确 的是_______ (填字母)。
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用
(4)用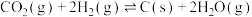 代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是_______ 。
(5)利用电解可以实现 和
和 的耦合转化,其原理如图所示:
的耦合转化,其原理如图所示:

①电极A与电源的_______ 相连。
②电极B上的反应式为_______ 。
③若导线上转移电子数 个,理论上A极产生CO的体积为
个,理论上A极产生CO的体积为_______ L(标准状况下)。
 是目前解决空间站供氧问题的有效途径,其物质转化如下图:
是目前解决空间站供氧问题的有效途径,其物质转化如下图:
(1)反应A为
 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。已知:

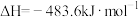
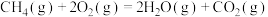
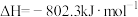
反应A的

 。
。(2)将原料气按
 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高
 平衡转化率的措施有
平衡转化率的措施有②温度过高或温度过低均不利于该反应的进行,原因是
(3)下列关于空间站内物质和能量变化的说法中,
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用
 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用(4)用
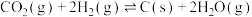 代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是(5)利用电解可以实现
 和
和 的耦合转化,其原理如图所示:
的耦合转化,其原理如图所示:
①电极A与电源的
②电极B上的反应式为
③若导线上转移电子数
 个,理论上A极产生CO的体积为
个,理论上A极产生CO的体积为
更新时间:2022-07-01 19:45:11
|
相似题推荐
【推荐1】 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
(1) 甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的
甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的 和
和 通过装有催化剂的反应器可得到甲烷。已知:
通过装有催化剂的反应器可得到甲烷。已知:

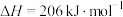 ;
;

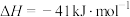 。
。
则反应 的
的
___________  ,
,
___________ 0(填“>”、“<”或“=”)。
(2)催化剂的选择是 甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得
甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得 转化率和生成
转化率和生成 选择性随温度变化的影响如下图所示。
选择性随温度变化的影响如下图所示。
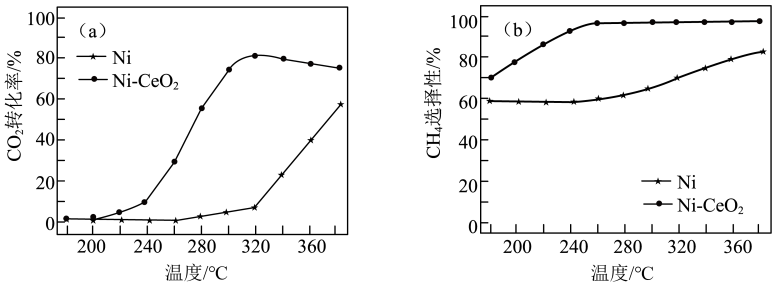
①高于320℃后,以Ni- 为催化剂,
为催化剂, 转化率略有下降,而以Ni为催化剂,
转化率略有下降,而以Ni为催化剂, 转化率却仍在上升,其原因是
转化率却仍在上升,其原因是___________ 。
②对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(3)近年来新兴的生物电催化技术运用微生物电解池也可实现 甲烷化,其工作原理如图所示。
甲烷化,其工作原理如图所示。
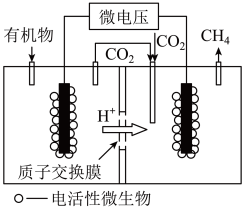
①微生物电解池实现 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为___________ 。
②如果处理有机物[ ]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为___________ 。
 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变。(1)
 甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的
甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力条件下,将按一定比例混合的 和
和 通过装有催化剂的反应器可得到甲烷。已知:
通过装有催化剂的反应器可得到甲烷。已知:
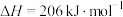 ;
;
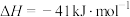 。
。则反应
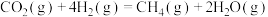 的
的
 ,
,
(2)催化剂的选择是
 甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得
甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得 转化率和生成
转化率和生成 选择性随温度变化的影响如下图所示。
选择性随温度变化的影响如下图所示。
①高于320℃后,以Ni-
 为催化剂,
为催化剂, 转化率略有下降,而以Ni为催化剂,
转化率略有下降,而以Ni为催化剂, 转化率却仍在上升,其原因是
转化率却仍在上升,其原因是②对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(3)近年来新兴的生物电催化技术运用微生物电解池也可实现
 甲烷化,其工作原理如图所示。
甲烷化,其工作原理如图所示。
①微生物电解池实现
 甲烷化的阴极电极反应式为
甲烷化的阴极电极反应式为②如果处理有机物[
 ]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
]产生标准状况下56L的甲烷,则理论上导线中通过的电子的物质的量为
您最近一年使用:0次
【推荐2】(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应 2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 ΔH=____ kJ/mol。
(2)SO2是形成酸雨的主要污染物,燃煤脱硫原理为 2CaO(s)+2SO2(g)+O2(g)⇌2CaSO4(s)。向 10L 恒温恒容密闭容器中加入 3mol CaO,并通入 2mol SO2和 lmol O2发生上述反应,2min时达平衡,此时 CaSO4为1.8mol。0〜2min 内,用 SO2表示的该反应的速率v(SO2)=____ ,其他条件保持不变,若上述反应在恒压条件下进行,达到平衡时 SO2的转化率____ (填“增大”、“减小”或“不变”)。
(3)NO 的排放主要来自于汽车尾气,净化原理为:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH=−746.8kJ/mol。实验测得,v正=k正·c2(NO)·c2(CO),v 逆=k逆·c(N2)·c2(CO2)(k 正、k 逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____ (填“>”“<”或“=”)k逆增大的倍数。
②若在 1L 的密闭容器中充入 1molCO 和 1mol NO,在一定温度下达到平衡时,CO 的转化率为 40%,则k正︰k逆=____ 。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
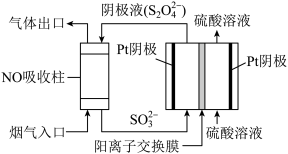
①阴极区的电极反应式为____ 。
②NO 吸收转化后的主要产物为 NH4+,若通电时电路中转移了 0.3mol e-,则此通电过程中理论上吸收的 NO 在标准状况下的体积为____ mL。
(5)欲用 5L Na2CO3溶液将 23.3g BaSO4固体全都转化为 BaCO3,则所用的 Na2CO3溶液的物质的量浓度至少为____ 。[已知:常温下K(BaSO4)=1×10−7、K(BaCO3)=2.5×10−6]。(忽略溶液体积的变化)
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应 2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 ΔH=
(2)SO2是形成酸雨的主要污染物,燃煤脱硫原理为 2CaO(s)+2SO2(g)+O2(g)⇌2CaSO4(s)。向 10L 恒温恒容密闭容器中加入 3mol CaO,并通入 2mol SO2和 lmol O2发生上述反应,2min时达平衡,此时 CaSO4为1.8mol。0〜2min 内,用 SO2表示的该反应的速率v(SO2)=
(3)NO 的排放主要来自于汽车尾气,净化原理为:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH=−746.8kJ/mol。实验测得,v正=k正·c2(NO)·c2(CO),v 逆=k逆·c(N2)·c2(CO2)(k 正、k 逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数
②若在 1L 的密闭容器中充入 1molCO 和 1mol NO,在一定温度下达到平衡时,CO 的转化率为 40%,则k正︰k逆=
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为
②NO 吸收转化后的主要产物为 NH4+,若通电时电路中转移了 0.3mol e-,则此通电过程中理论上吸收的 NO 在标准状况下的体积为
(5)欲用 5L Na2CO3溶液将 23.3g BaSO4固体全都转化为 BaCO3,则所用的 Na2CO3溶液的物质的量浓度至少为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】氨及铵盐在生活、生产中有广泛应用。
(1)固氮直接影响作物生长。自然固氮发生的反应有:
①N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-114.1 kJ·mol1
③N2(g)+2O2(g)=2NO2(g) ΔH3=__________________ kJ·mol1。
在雷电作用下,N2和O2直接发生反应①,而不是反应③,其主要原因是___________________ 。
(2)常温下,在x mL c mol·L1氨水中加入y mL c mol·L1盐酸得到混合溶液M恰好显中性。
①M溶液中所有离子浓度大小关系式为____________________________ 。
②常温下,NH3·H2O的电离常数K=______________________ (用含x和y的代数式表示,忽略溶液混合后的体积变化)。
(3)在催化剂作用下,NH3脱硫反应为8NH3(g)+6SO2(g) 3S2(g)+4N2(g)+12H2O(g)。
3S2(g)+4N2(g)+12H2O(g)。
在2 L恒容密闭容器中充入一定量NH3和 SO2,SO2的平衡转化率与温度的关系如图所示。
图中a、b、c代表不同n(NH3)/n(SO2)。
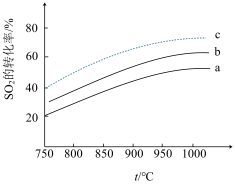
①升高温度,该反应平衡常数K______________ (填“增大”“减小”或“不变”)。
②在a、b、c曲线中,n(NH3)/n(SO2)最小的是__________________ (填字母)。
③若起始投入一定量的NH3和3 mol SO2,某温度下发生上述反应,某时刻测得SO2的转化率为60%,此时c(N2)=___________ mol·L1。
(4)氨气碱性燃料电池中氧化产物为单质,负极的电极反应式为___________________ 。
(1)固氮直接影响作物生长。自然固氮发生的反应有:
①N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-114.1 kJ·mol1
③N2(g)+2O2(g)=2NO2(g) ΔH3=
在雷电作用下,N2和O2直接发生反应①,而不是反应③,其主要原因是
(2)常温下,在x mL c mol·L1氨水中加入y mL c mol·L1盐酸得到混合溶液M恰好显中性。
①M溶液中所有离子浓度大小关系式为
②常温下,NH3·H2O的电离常数K=
(3)在催化剂作用下,NH3脱硫反应为8NH3(g)+6SO2(g)
 3S2(g)+4N2(g)+12H2O(g)。
3S2(g)+4N2(g)+12H2O(g)。在2 L恒容密闭容器中充入一定量NH3和 SO2,SO2的平衡转化率与温度的关系如图所示。
图中a、b、c代表不同n(NH3)/n(SO2)。

①升高温度,该反应平衡常数K
②在a、b、c曲线中,n(NH3)/n(SO2)最小的是
③若起始投入一定量的NH3和3 mol SO2,某温度下发生上述反应,某时刻测得SO2的转化率为60%,此时c(N2)=
(4)氨气碱性燃料电池中氧化产物为单质,负极的电极反应式为
您最近一年使用:0次
【推荐1】 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:
反应1:
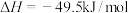
反应2:
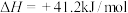 (副反应)
(副反应)
(1) ,该反应的
,该反应的
___________  。
。
(2)将 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数
___________ (保留两位有效数字)。
④分子筛膜反应器可提高反应1的平衡转化率、且实现 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是___________ 。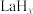 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
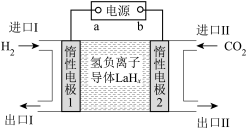
①电极a为电源的___________ (填“正极”或“负极”)。
②生成 的电极反应式为
的电极反应式为___________ 。
③若反应2也同时发生,出口Ⅱ为CO、 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为___________ (
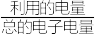 ×100%)。
×100%)。
 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:反应1:

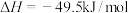
反应2:

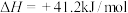 (副反应)
(副反应)(1)
 ,该反应的
,该反应的
 。
。(2)将
 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数

④分子筛膜反应器可提高反应1的平衡转化率、且实现
 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是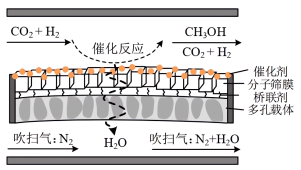
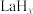 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
①电极a为电源的
②生成
 的电极反应式为
的电极反应式为③若反应2也同时发生,出口Ⅱ为CO、
 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为
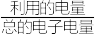 ×100%)。
×100%)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】研究氮氧化物的反应机理,对于消除环境污染有重要意义。
(1)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g) 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
i:2NO(g) N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
ii:N2O2(g)+O2(g) 2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
请回答下列问题:
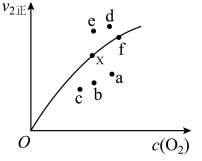
①一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________ (填字母)。 2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:______ mol·L-1·s-1
②下列能说明该反应达到平衡状态的是________ (填选项字母)。
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是_________ (填选项字母)。
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
④100℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,发生反应N2O4(g) 2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)
2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______ v逆(N2O4)(填“>”“=”或“<”)。
⑤上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=________ kPa·s-1。
(1)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)
 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:i:2NO(g)
 N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0ii:N2O2(g)+O2(g)
 2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为
 2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题: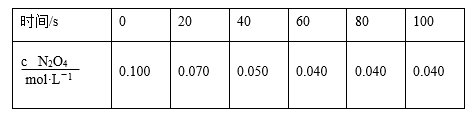
②下列能说明该反应达到平衡状态的是
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
④100℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,发生反应N2O4(g)
 2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)
2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)⑤上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:
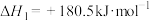

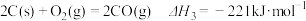
若某反应的平衡常数表达式为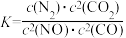 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2) 在一定条件下可发生分解:
在一定条件下可发生分解: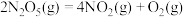 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是_______ (填字母)。
a. 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.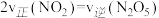 d.气体的密度保持不变
d.气体的密度保持不变
Ⅱ.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
(3)已知 CO2(g) + 3H2(g)⇌ CH3OH(g) + H2O(g),将 和
和 按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成
按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
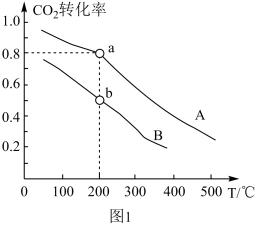
①a、b两点化学反应速率分别用Va、Vb,表示,则Va_______ Vb (填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K=_______ 。
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_______ 。
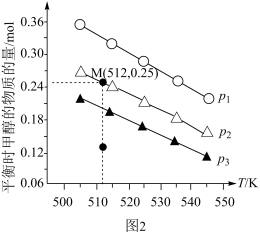
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在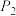 及512 K时,图中N点
及512 K时,图中N点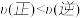
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即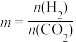 。
。
①图3中投料比相同,温度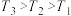 ,则该反应的焓变
,则该反应的焓变
_______ 0(填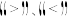 )。
)。

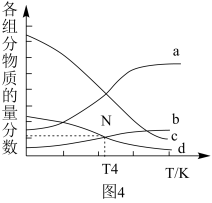
②m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_______ (填化学式)。
Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:

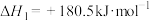

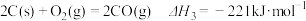
若某反应的平衡常数表达式为
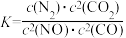 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)
 在一定条件下可发生分解:
在一定条件下可发生分解: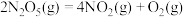 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是a.
 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化c.
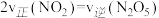 d.气体的密度保持不变
d.气体的密度保持不变Ⅱ.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
(3)已知 CO2(g) + 3H2(g)⇌ CH3OH(g) + H2O(g),将
 和
和 按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成
按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用Va、Vb,表示,则Va
②列出a点对应的平衡常数表达式K=
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是

A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为

D.在
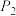 及512 K时,图中N点
及512 K时,图中N点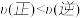
(5)
 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即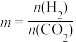 。
。①图3中投料比相同,温度
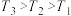 ,则该反应的焓变
,则该反应的焓变
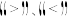 )。
)。
②m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol−1、283.0 kJ·mol−1,请写出CO还原SO2的生成CO2和S(s)热化学方程式_______ 。
(2)某科研小组研究臭氧氧化−−碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g) NO2(g)+O2(g) △H1=-200.9 kJ•mol−1 Ea1=3.2 kJ•mol−1
NO2(g)+O2(g) △H1=-200.9 kJ•mol−1 Ea1=3.2 kJ•mol−1
反应Ⅱ:SO2(g)+O3(g) SO3(g)+O2(g) △H2=-241.6 kJ•mol−1 Ea2=58 kJ•mol−1
SO3(g)+O2(g) △H2=-241.6 kJ•mol−1 Ea2=58 kJ•mol−1
已知该体系中臭氧发生分解反应:2O3(g) 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
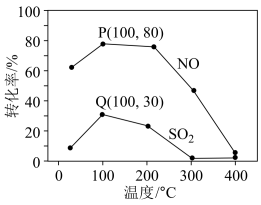
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______ 。
②下列说法正确的是_______ 。
A.Q点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是_______ mol;SO2的平均反应速率为_______ ;反应Ⅰ在此时的平衡常数为_______ 。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①ab是_______ 离子交换膜(填“阳”或“阴”)。阴极区的电极反应式为_______ 。
②若NO吸收转化后的产物为NH4+,通电过程中吸收4.48LNO(标况下),则阳极可以产生_______ mol气体。
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol−1、283.0 kJ·mol−1,请写出CO还原SO2的生成CO2和S(s)热化学方程式
(2)某科研小组研究臭氧氧化−−碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)
 NO2(g)+O2(g) △H1=-200.9 kJ•mol−1 Ea1=3.2 kJ•mol−1
NO2(g)+O2(g) △H1=-200.9 kJ•mol−1 Ea1=3.2 kJ•mol−1反应Ⅱ:SO2(g)+O3(g)
 SO3(g)+O2(g) △H2=-241.6 kJ•mol−1 Ea2=58 kJ•mol−1
SO3(g)+O2(g) △H2=-241.6 kJ•mol−1 Ea2=58 kJ•mol−1已知该体系中臭氧发生分解反应:2O3(g)
 3O2(g)。请回答:
3O2(g)。请回答:其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因
②下列说法正确的是
A.Q点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①ab是
②若NO吸收转化后的产物为NH4+,通电过程中吸收4.48LNO(标况下),则阳极可以产生
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】雾霾天气严重影响人们的生活健康,治理污染是化学工作者义不容辞的职责,因而对SO2、NOx等进行研究其有重要意义。
请根据以下信息回答有关问题:
I.NOx是汽车尾气的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

该反应的△H=__________ 。
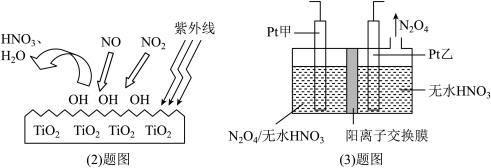
(2)科学家通过实验发现,在紫外线照射下TiO2会使空气中的某些分子产生活性基团OH,并且活性基团OH可与NO2、NO发生反应生成硝酸和水。根据左下图示,请写出OH与NO反应的化学方程式__________ 。
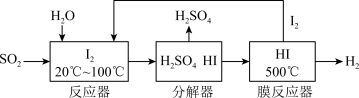
(3)电解法可将工业废气中含有的NO2消除。原理是先将NO2转化为N2O4,然后电解得到N2O5 (常温下为无色固体,常做绿色硝化剂)。电解原理如右上图所示,该电解池中生成N2O5的电极反应式是___________ 。
Ⅱ.工业上采取多种措施减少SO2的排放。
(4)碘循环工艺具体流程如下:
① 用化学方程式表示反应器中发生的反应___________ 。
② 在HI分解反应中使用膜反应器分离出H2的目的是__________ 。
③ 该工艺流程的优点有________ 。
(5)喷雾干燥法脱硫是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,吸收液中c(Ca2+)一直保持为0.70mol/L,则吸收液中的c(SO42-)为_____ 。[已知该温度下,Ksp (CaSO3)=1.4×10-7]
请根据以下信息回答有关问题:
I.NOx是汽车尾气的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

该反应的△H=
(2)科学家通过实验发现,在紫外线照射下TiO2会使空气中的某些分子产生活性基团OH,并且活性基团OH可与NO2、NO发生反应生成硝酸和水。根据左下图示,请写出OH与NO反应的化学方程式

(3)电解法可将工业废气中含有的NO2消除。原理是先将NO2转化为N2O4,然后电解得到N2O5 (常温下为无色固体,常做绿色硝化剂)。电解原理如右上图所示,该电解池中生成N2O5的电极反应式是
Ⅱ.工业上采取多种措施减少SO2的排放。
(4)碘循环工艺具体流程如下:

① 用化学方程式表示反应器中发生的反应
② 在HI分解反应中使用膜反应器分离出H2的目的是
③ 该工艺流程的优点有
(5)喷雾干燥法脱硫是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,吸收液中c(Ca2+)一直保持为0.70mol/L,则吸收液中的c(SO42-)为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
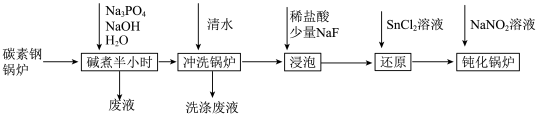
【推荐3】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:
已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________ 。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________ ;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________ 。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________ ;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________ (填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________ 。

(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________ 。

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
| 难溶物 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 | Ca3(PO4)2 |
| Ksp | 2.8×10-9 | 7.1×10-5 | 5.6×10-12 | 6.8×10-6 | 2.1×10-33 |
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为

(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为

您最近一年使用:0次



