①CO2甲烷化反应:CO2(g) +4H2(g)
 CH4(g) +2H2O(g)
CH4(g) +2H2O(g)  H=-165 kJ·mol-1
H=-165 kJ·mol-1②逆水煤气变换反应:CO2(g) + H2(g)
 CO(g) + H2O(g)
CO(g) + H2O(g)  H=+41.1 kJ·mol-1
H=+41.1 kJ·mol-1(1)写出CO甲烷化反应的热化学方程式:
(2)图甲是温度和压强对CO2平衡转化率影响的关系图。该实验条件下的压强有0.1MPa、3.0MPa、10.0MPa,图中a点压强为
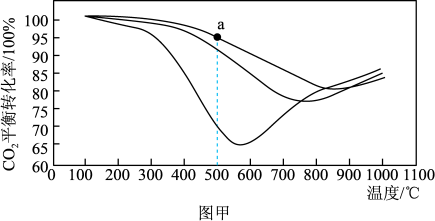
(3)图乙是反应条件对CO2甲烷化反应中CH4选择性影响的关系图。工业上一般选用的温度为400℃,则压强应选用

(4)450°C时,若在体积为1 L的恒容密闭容器中加入1 mol CO2和4 mol H2混合原料气只发生反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1。平衡时CO2的转化率为75%,则该温度下此反应的平衡常数K=
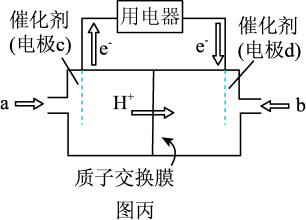
CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1。平衡时CO2的转化率为75%,则该温度下此反应的平衡常数K=(5)废气中的CO2可转化为甲醚(CH3OCH3),甲醚可用于制作甲醚燃料电池(如图丙),质子交换膜左右两侧溶液均为6 mol·L-1的H2SO4溶液。则电极d为
相似题推荐
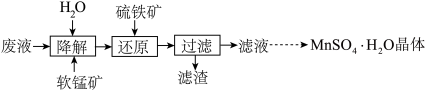
(1)研究温度对“降解”过程中有机物去除率的影响,实验在如图1所示的装置中进行。

①在不同温度下反应相同时间,发现温度从60℃升高到95℃时,有机物去除率从29%增大到58%,其可能的原因是:MnO2的氧化能力随温度升高而增强;
②废液因含有机物而呈现黑红色。有机物降解速率慢,难以观察气泡产生速率。降解一段时间,判断有机物浓度基本不变的依据是:三颈烧瓶内
(2)降解一段时间后,加入硫铁矿(主要成分FeS2)将剩余MnO2还原,所得溶液中的主要离子有Fe3+、Mn2+、SO42-等,其离子方程式为
(3)滤液若用足量高纯度MnO2再次氧化降解,改变条件,有机物去除率可达66%。反应后过滤,所得滤渣经洗涤后,在本实验流程中可用于
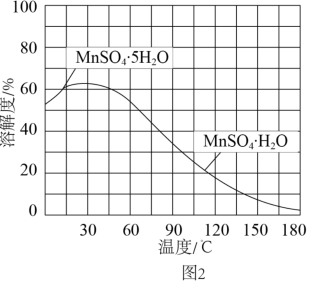
(4)MnSO4·H2O的溶解度曲线如图2所示。设计以过滤所得滤液为原料,进一步除去有机物等杂质并制取MnSO4·H2O晶体的实验方案:
 转化为乙醇可实现碳循环。近年来,随着全球变暖及能源枯竭的加剧,由
转化为乙醇可实现碳循环。近年来,随着全球变暖及能源枯竭的加剧,由 制乙醇又再次成为各国的研究热点。
制乙醇又再次成为各国的研究热点。Ⅰ.
 转化为乙醇的一种途径如下:
转化为乙醇的一种途径如下: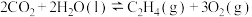
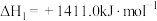
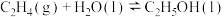
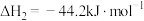
(1)则
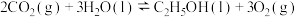

 。
。Ⅱ.已知
 催化加氢制乙醇原理为
催化加氢制乙醇原理为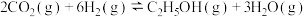 ,回答下列问题:
,回答下列问题:(2)在恒温恒容的密闭容器中,对
 催化加氢制乙醇反应体系说法错误的是
催化加氢制乙醇反应体系说法错误的是A.增大原料气中
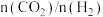 的比例,有利于提高
的比例,有利于提高 的转化率
的转化率B.若混合气体的密度保持不变,说明反应体系已达平衡
C.体系达平衡后,若压缩容器容积,则反应平衡正向移动
(3)在均为2 L的恒容密闭容器a和b中分别投入2 mol
 和6 mol
和6 mol  ,在不同温度下进行
,在不同温度下进行 加氢制乙醇的反应,各容器中乙醇的物质的量与时间的关系如图所示:
加氢制乙醇的反应,各容器中乙醇的物质的量与时间的关系如图所示:
①容器a中0~10 min氢气的平均反应速率
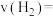
②若容器a、b中的反应温度分别为
 、
、 ,则判断
,则判断
③若容器a中改变条件时,反应情况会由曲线a变为曲线c,则改变的单一条件可是
A.加入更高效的催化剂 B.升温 C.增大压强 D.分离出乙醇
④
 温度下反应达平衡时,容器a中气体总压强为4 MPa,则
温度下反应达平衡时,容器a中气体总压强为4 MPa,则 时该反应的平衡常数
时该反应的平衡常数
(4)虽然由
 催化加氢制乙醇目前还无法实现产业化,但该方法具有很多优点、具有广阔的综合利用前景,试说明原因(任写一个原因):
催化加氢制乙醇目前还无法实现产业化,但该方法具有很多优点、具有广阔的综合利用前景,试说明原因(任写一个原因):(1)BD2的电子式为
(2)EAB2D4水溶液显酸性的原因是
(3)将等浓度等体积的EBC溶液和ABC溶液混合,所得混合溶液(呈碱性)中各微粒(水分子除外)浓度由大到小的顺序为
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式
(5)常温下,测得X和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2(g)
 2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将
2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是_______(填字母)。
| A.蒸馏水 | B.KCl溶液 | C.KNO3溶液 | D.CuSO4溶液 |
 。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
①比较P1、P2的大小关系:P1
②该反应的平衡常数K的表达式为
(4)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
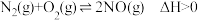 。请回答:
。请回答:①若该反应是在恒容条件下进行,判断该反应达到平衡的标志为
A.消耗1molN2同时生成1molO2 B.
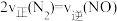
C.混合气体平均相对分子质量不变 D.混合气体密度不变
②将N2、O2的混合气体充入某密闭容器中,下图变化趋势正确的是

反应①CO2(g) + 3H2(g)
 CH3OH(g) + H2O(l) △H1=-49.01kJ/moL
CH3OH(g) + H2O(l) △H1=-49.01kJ/moL反应②2CH3OH(g)
 CH3OCH3(g) + H2O(l) △H2=-24.52kJ/moL
CH3OCH3(g) + H2O(l) △H2=-24.52kJ/moL反应③CO2(g) + H2(g)
 CO(g)+H2O(l) △H3
CO(g)+H2O(l) △H3请回答:
(1)CO2转化为二甲醚的反应原理为:反应④:2CO2(g) + 6H2(g)
 CH3OCH3(g)+3H2O(l) △H4=
CH3OCH3(g)+3H2O(l) △H4=(2)下列不能说明反应③在298K、恒容条件下达化学平衡状态的是
| A.v正(H2)=v逆(H2O) |
| B.n(CO2):n(H2):n(CO):n(H2O)=1:1:1:1 |
| C.混合气体的密度不变 |
| D.混合气体的平均相对分子质量不变 |
(3)写出反应②在500K时的平衡常数表达式:
(4)下图表示起始投料量H2/CO2=4时,反应③、④中CO2的平衡转化率随反应温度的变化关系图,根据图示回答下列问题:

① △H3
②
③若起始投料量H2/CO2=4,起始温度为298K,反应④在503K时达到平衡,请在上图画出CO2转化率随温度升高的变化曲线。
 (红棕色)和
(红棕色)和 (无色)之间发生反应:
(无色)之间发生反应: 。将一定量
。将一定量 气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
气体充入体积为2L的恒容密闭容器中,控制反应温度为T。(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量
(2)下列可以说明该反应达到平衡的是___________。
A.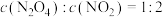 | B. |
| C.容器内气体的平均摩尔质量不再变化 | D.混合气体的密度不再变化 |

 ,
,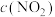 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。
①在图中画出0~16min时间段内,
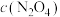 随时间的变化曲线
随时间的变化曲线②1~4四个点中,
 的点有
的点有③反应进行到4min时,
 的转化率是
的转化率是④下列措施能使该反应速率加快的是
A.增大容器体积 B.增大
 的浓度 C.恒容条件下充入He D.加入合适的催化剂
的浓度 C.恒容条件下充入He D.加入合适的催化剂(4)如图是氢氧燃料电池构造示意图:

该电池工作时,电流的流向为
 转化为乙酸,同时可处理温室气体
转化为乙酸,同时可处理温室气体 ,反应方程式如下:
,反应方程式如下: 。
。(1)我国科研人员提出了反应的催化反应历程,该历程示意图如下所示。

下列说法不正确的是
a.反应发生时,反应物化学键并没有全部断裂
b.使用催化效率更高的催化剂可以降低E值
c.①→②放出能量并形成了
 键
键d.“夺氢”过程中形成了
 键
键(2)
 时向
时向 密闭容器中充入
密闭容器中充入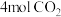 和
和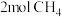 ,
, 后测得
后测得 浓度降为
浓度降为 ,
,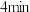 后达到平衡,测得乙酸的浓度为
后达到平衡,测得乙酸的浓度为 。
。①前两分钟乙酸的平均反应速率=
②若温度为
 时,向上述容器中充入
时,向上述容器中充入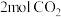 、
、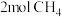 和
和 ,反应恰好处于平衡状态,则
,反应恰好处于平衡状态,则
 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)(3)以二氧化钛表面覆盖
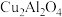 为催化剂催化该反应时,在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
为催化剂催化该反应时,在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。 时,温度升高而乙酸的生成速率降低的原因是
时,温度升高而乙酸的生成速率降低的原因是
(4)某高校科研团队在实验时,发现在
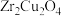 作催化剂时,还检测出了乙醇。推测发生了副反应:
作催化剂时,还检测出了乙醇。推测发生了副反应: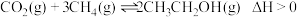
①下列有关制备乙酸的说法错误的是
a.选择合适催化剂可提高乙酸的产率
b.选择合适温度可提高催化剂的效率
c.增大投料时
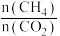 的比值可提高甲烷的转化率
的比值可提高甲烷的转化率d.及时分离出乙酸可提高乙酸的产率
②在温度为
 、压强为
、压强为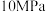 的恒温恒压容器中,充入
的恒温恒压容器中,充入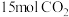 和
和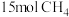 ,平衡时测得乙酸的百分含量是乙醇5倍,
,平衡时测得乙酸的百分含量是乙醇5倍, 的百分含量是
的百分含量是 的2倍。则平衡时乙醇的分压为
的2倍。则平衡时乙醇的分压为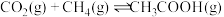 的
的
(1)如图表示金刚石、石墨在相关反应过程中的能量变化关系。写出石墨转化为金刚石的热化学方程式:
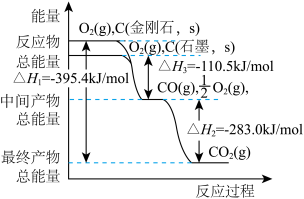
(2)CO与H2可在一定条件下反应生成燃料甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH<0。将2 mol CO和4 mol H2置于一体积不变的1 L密闭容器中,测定不同条件、不同时间段内CO的转化率,得到下表数据。
CH3OH(g) ΔH<0。将2 mol CO和4 mol H2置于一体积不变的1 L密闭容器中,测定不同条件、不同时间段内CO的转化率,得到下表数据。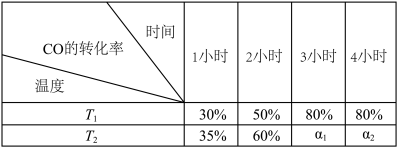
则温度为T1时该反应的平衡常数为
A.反应在2小时的时候混合气体的密度和相对分子质量均比1小时的大
B.反应在3小时的时候,v正(H2)=2v逆(CH3OH)
C.若其他条件不变,再充入6 mol H2,则最多可得到64 g CH3OH
D.其他条件不变,若最初加入的H2为2.4 mol,则达平衡时CO的转化率为50%
(3)工业中常用以下反应合成氨:N2(g)+3H2(g)
 2NH3(g) ΔH<0。在三个不同条件的密闭容器中加入N2和H2进行反应,起始时c(N2)均为0.10 mol/L,c(H2)均为0.30 mol/L,N2的浓度随时间的变化如图①、②、③曲线所示。计算③中产物NH3在0~10 min的平均反应速率:
2NH3(g) ΔH<0。在三个不同条件的密闭容器中加入N2和H2进行反应,起始时c(N2)均为0.10 mol/L,c(H2)均为0.30 mol/L,N2的浓度随时间的变化如图①、②、③曲线所示。计算③中产物NH3在0~10 min的平均反应速率: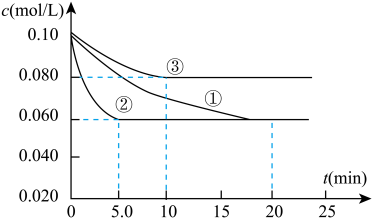
【推荐3】近年来,磁性材料的研究备受国际磁学界的关注。Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。回答下列问题:
(1)以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如图所示。
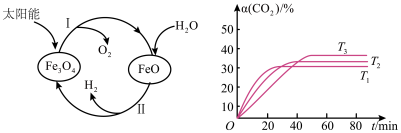
已知:H2O(l)= H2(g)+ O2(g)△H1+285.5kJ·mol-1
O2(g)△H1+285.5kJ·mol-1
过程I:2 Fe3O4(s)⇌6 FeO (s)+O2(g)△H2=+313.2kJ•mol-1
则过程II的热化学方程式为
(2)磁铁矿(Fe3O4)是工业上冶炼铁的原料之一,发生的主要反应为Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)△H <0,T℃ 时,在 1L 恒容密闭容器中加入Fe3O4、CO各0.5mol,5min反应达到平衡时,固体质量减小了6.4g。
①从起始到反应达到平衡时v(CO2)=
②欲提高该反应中 CO的平衡转化率,可采取的措施是
③其他条件不变时,该反应在不同温度下,CO2的产率随时间的变化α(CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是
Ⅰ.在一定条件下A与B反应可生成C和D,其能量变化如图:
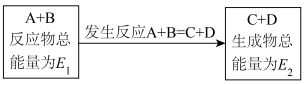
(2)能量高的物质相比于能量低的物质更
Ⅱ.原电池反应能够提供电能,如图是某原电池装置图。
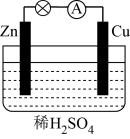
(4)Cu棒上发生的电极反应式为
(5)溶液中H+向
(2)纯碱热溶液可代替洗涤剂洗涤油污,原因是(用离子方程式表示):
(3)FeCl3水溶液呈酸性,原因是(用离子方程式表示):
(4)在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
①若加入AgNO3固体,c(I-)
②若加入更多的AgI固体,则c(Ag+)
③若加入固体AgBr,c(I-)
(5)若以铁棒、碳棒、导线和氯化铁溶液为用品设计原电池。负极材料为
(1)写出B的单核阴离子结构示意图
(2)A、B单质在高温下反应生成的液体M的结构式
(3)以C的一种单质为电极材料,写出用A、B的单质和KOH溶液构成的原电池的正、负极电极反应式,负极
(4)写出B、D的单质在加热条件下形成化合物的电子式



