回答下列问题:
(1)按系统命名法,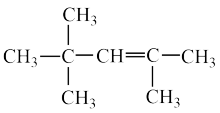 的名称是:
的名称是:___________ 。
(2)某化合物A 3.1g在氧气中完全燃烧,只生成4.4gCO2和2.7gH2O。则该有机物A的最简式为___________ ,A的红外光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,而A在核磁共振氢谱中出现两组峰,且其面积之比为2:1,则该有机物的简式为___________ 。
(3)常温下在某NaHSO3、Na2SO3混合溶液中HSO 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO 的水解平衡常数=
的水解平衡常数=___________ 。

(1)按系统命名法,
 的名称是:
的名称是:(2)某化合物A 3.1g在氧气中完全燃烧,只生成4.4gCO2和2.7gH2O。则该有机物A的最简式为
(3)常温下在某NaHSO3、Na2SO3混合溶液中HSO
 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO 的水解平衡常数=
的水解平衡常数=
更新时间:2022-09-26 21:30:34
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】已知常温下部分弱电解质的电离常数如下表:
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是____________ (填字母)。
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为________ 。
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-)______ c( )(填>、<或=);可使上述两种溶液pH相等的方法是
)(填>、<或=);可使上述两种溶液pH相等的方法是________ (填字母)。
A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为:__________________________ 。
(5)常温下,计算NH4Cl溶液中, 的水解常数Kh=
的水解常数Kh=_________________ 。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | Ka=6.8×10-4 | Ka=4.7×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Kb=1.7×10-5 |
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-)
 )(填>、<或=);可使上述两种溶液pH相等的方法是
)(填>、<或=);可使上述两种溶液pH相等的方法是A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为:
(5)常温下,计算NH4Cl溶液中,
 的水解常数Kh=
的水解常数Kh=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】研究电解质在水溶液中的行为有重要的意义(以下均为25℃)。
I.有0.1 mol·L 的两种溶液:a.NaOH b.
的两种溶液:a.NaOH b.
(1)向20 mL 溶液b中滴加溶液a的过程中,pH变化如图所示。

①在上图A、B、C和D四个点中,水电离程度最大的点是___________ 。
②D点溶液中,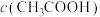
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅱ. 、
、 、HClO和
、HClO和
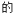 电离平衡常数如下:
电离平衡常数如下:
(2)0.1 mol·L 的下列四种溶液,pH由小到大的顺序是___________(填字母)。
的下列四种溶液,pH由小到大的顺序是___________(填字母)。
(3)0.1 mol·L
 的溶液中
的溶液中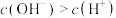 ,结合计算解释其原因:
,结合计算解释其原因:___________ 。
(4)向Na2CO3溶液中通入少量SO2,反应的离子方程式为___________ 。
I.有0.1 mol·L
 的两种溶液:a.NaOH b.
的两种溶液:a.NaOH b.
(1)向20 mL 溶液b中滴加溶液a的过程中,pH变化如图所示。

①在上图A、B、C和D四个点中,水电离程度最大的点是
②D点溶液中,
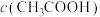
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。Ⅱ.
 、
、 、HClO和
、HClO和
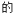 电离平衡常数如下:
电离平衡常数如下:| 化学式 |  |  | HClO |  |
电离平衡常数( ) ) |   | 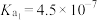  |  |  |
(2)0.1 mol·L
 的下列四种溶液,pH由小到大的顺序是___________(填字母)。
的下列四种溶液,pH由小到大的顺序是___________(填字母)。A. | B. | C.NaClO | D. |
(3)0.1 mol·L

 的溶液中
的溶液中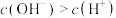 ,结合计算解释其原因:
,结合计算解释其原因:(4)向Na2CO3溶液中通入少量SO2,反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
(1)相同物质的量浓度的NaClO、 、
、 碱性最强的是
碱性最强的是___________ (填化学式)
(2)由上可知 的酸性强于HClO,能否
的酸性强于HClO,能否___________ (填“能”或“否”)用 制取HClO。
制取HClO。
Ⅱ.已知 和
和 的水溶液中存在如下平衡:
的水溶液中存在如下平衡:
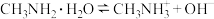 ,
,
 ,
,
常温下,10mL浓度均为 的两种溶液,分别加水进行稀释,所得曲线如图所示[V表示溶液的体积,
的两种溶液,分别加水进行稀释,所得曲线如图所示[V表示溶液的体积,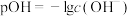 ],回答下列问题:
],回答下列问题:
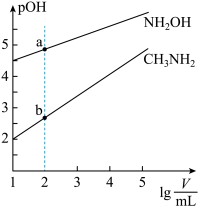
(3)写出 水解的离子方程式
水解的离子方程式___________
(4)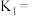
___________ ,等物质的量浓度的 溶液与
溶液与 溶液比较,酸性较弱的是
溶液比较,酸性较弱的是___________ (填化学式)。
(5)a、b两点比较,溶液中水的电离程度较大的是___________ (填“a”或“b”)。
(6)常温下,浓度均为 的
的 与
与 的混合液显
的混合液显___________ (填“酸”、“碱”或“中”)性,写出溶液中除水之外的微粒浓度由大到小的顺序___________ 。
(7)常温下,若 溶液与bmol/LNaOH溶液等体积混合后溶液为中性,则c=
溶液与bmol/LNaOH溶液等体积混合后溶液为中性,则c=___________ (用含b的式子表示)。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | HClO |  |  |
| 电离平衡常数(25℃) | 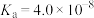 | 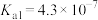  | 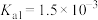 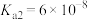 |
 、
、 碱性最强的是
碱性最强的是(2)由上可知
 的酸性强于HClO,能否
的酸性强于HClO,能否 制取HClO。
制取HClO。Ⅱ.已知
 和
和 的水溶液中存在如下平衡:
的水溶液中存在如下平衡: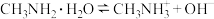 ,
,
 ,
,
常温下,10mL浓度均为
 的两种溶液,分别加水进行稀释,所得曲线如图所示[V表示溶液的体积,
的两种溶液,分别加水进行稀释,所得曲线如图所示[V表示溶液的体积,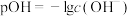 ],回答下列问题:
],回答下列问题:
(3)写出
 水解的离子方程式
水解的离子方程式(4)
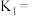
 溶液与
溶液与 溶液比较,酸性较弱的是
溶液比较,酸性较弱的是(5)a、b两点比较,溶液中水的电离程度较大的是
(6)常温下,浓度均为
 的
的 与
与 的混合液显
的混合液显(7)常温下,若
 溶液与bmol/LNaOH溶液等体积混合后溶液为中性,则c=
溶液与bmol/LNaOH溶液等体积混合后溶液为中性,则c=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】烯烃与酸性 溶液反应被氧化的部分与氧化产物的对应关系如下表:
溶液反应被氧化的部分与氧化产物的对应关系如下表:
(1)苯乙烯与酸性 溶液反应后所得氧化产物为
溶液反应后所得氧化产物为___________ 。
(2)现有某烃A的分子式为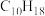 ,经催化加氢后得到化合物B,其分子式为
,经催化加氢后得到化合物B,其分子式为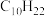 ,A与酸性
,A与酸性 溶液作用可得如下三种化合物:
溶液作用可得如下三种化合物: 、
、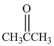 、
、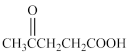 ,则A的结构简式为___________。
,则A的结构简式为___________。
(3)现有某烃C的分子式为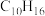 ,经催化加氢得到产物D,其分子式为
,经催化加氢得到产物D,其分子式为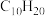 ,C与酸性
,C与酸性 溶液作用可得到等物质的量的两种含碳化合物:
溶液作用可得到等物质的量的两种含碳化合物: 与
与 ,经分析有关数据知D内含六元碳环。试写出C的结构简式:
,经分析有关数据知D内含六元碳环。试写出C的结构简式:___________ 。
 溶液反应被氧化的部分与氧化产物的对应关系如下表:
溶液反应被氧化的部分与氧化产物的对应关系如下表:| 烯烃被氧化的部分 | 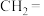 | 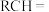 |  |
| 氧化产物 |  |  | 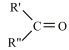 |
 溶液反应后所得氧化产物为
溶液反应后所得氧化产物为(2)现有某烃A的分子式为
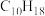 ,经催化加氢后得到化合物B,其分子式为
,经催化加氢后得到化合物B,其分子式为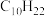 ,A与酸性
,A与酸性 溶液作用可得如下三种化合物:
溶液作用可得如下三种化合物: 、
、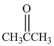 、
、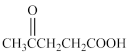 ,则A的结构简式为___________。
,则A的结构简式为___________。A. 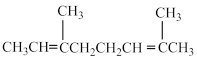 | B. 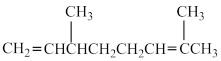 |
C.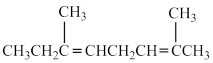 | D.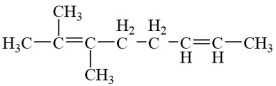 |
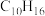 ,经催化加氢得到产物D,其分子式为
,经催化加氢得到产物D,其分子式为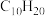 ,C与酸性
,C与酸性 溶液作用可得到等物质的量的两种含碳化合物:
溶液作用可得到等物质的量的两种含碳化合物: 与
与 ,经分析有关数据知D内含六元碳环。试写出C的结构简式:
,经分析有关数据知D内含六元碳环。试写出C的结构简式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某有机物 A 的相对分子质量为 62。为进一步测定 A 的化学式,现取 6.2 g A 完全燃烧,得到二氧化碳和水蒸气。将产物先后通过足量的浓硫酸和碱石灰,两者分别增重5.4 g 和 8.8 g(假设每步反应完全)。
(1)该有机物的实验式是_____ ;分子式是_____ 。
(2)红外光谱显示有“C—C”键和“O—H”键的振动吸收,若核磁共振氢谱只有 2 个吸收峰且峰面积之比为 1∶2,推断该有机物的结构简式是_____ 。
(1)该有机物的实验式是
(2)红外光谱显示有“C—C”键和“O—H”键的振动吸收,若核磁共振氢谱只有 2 个吸收峰且峰面积之比为 1∶2,推断该有机物的结构简式是
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
名校
【推荐3】通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________ ;
(2)X与金属钠反应放出氢气,反应的化学方程式是____________ (有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是________________ ;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率为_____ 。
(1)X的分子式是
(2)X与金属钠反应放出氢气,反应的化学方程式是
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测得其相对分子质量为46;
③用核磁共振仪处理该化合物,得到如下图所示谱图,图中三个峰的面积之比是1:2:3。
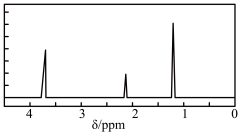
试回答下列问题:
(1)有机物A的实验式是___________ 。
(2)能否根据A的实验式确定A的分子式?____________ (填“能”或“不能”);若能,则A的分子式是___________ ;若不能,则此空不填。
(3)写出有机物A可能的结构简式:__________ 。
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测得其相对分子质量为46;
③用核磁共振仪处理该化合物,得到如下图所示谱图,图中三个峰的面积之比是1:2:3。

试回答下列问题:
(1)有机物A的实验式是
(2)能否根据A的实验式确定A的分子式?
(3)写出有机物A可能的结构简式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某实验兴趣小组用李比希法、现代仪器等测定有机物X的组成和结构。实验测得0.300 g样品X完全燃烧,产物气体先通过干燥剂高氯酸镁,高氯酸镁质量增加0.180 g,再通过碱石灰,碱石灰质量增加0.440 g。
(1)由实验数据分析计算可得X的实验式(最简式)为___ 。
(2)若红外光谱测得X中含有“C=O”和“C—O—C”的结构,质谱法测得X的相对分子质量是60,则X的名称为___ 。
(3)若质谱法测得X的相对分子质量是90,两分子X能通过酯化反应形成六元环状结构的有机物Y,Y的结构简式为___ 。
(1)由实验数据分析计算可得X的实验式(最简式)为
(2)若红外光谱测得X中含有“C=O”和“C—O—C”的结构,质谱法测得X的相对分子质量是60,则X的名称为
(3)若质谱法测得X的相对分子质量是90,两分子X能通过酯化反应形成六元环状结构的有机物Y,Y的结构简式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某有机物A含C、H、O三种元素,为了确定A的结构,进行如下实验:
(1)取3.4gA在O2中充分燃烧,将燃烧的产物依次通入浓硫酸和碱石灰,分别增重1.8g和8.8g,则A的实验式是___________ 。
(2)用质谱法对A进行分析,其质谱图如图,则有机物A的分子式是___________ 。
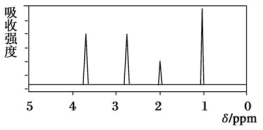
(3)用红外光谱法分析,有机物A中含有苯环、羧基、甲基;用核磁共振氢谱法分析该物质,其核磁共振氢谱图如下,由此推断有机物A的结构简式为___________ 。
(4)B与A互为同系物,且相对分子量比A大14,请写出满足下列要求的B的同分异构体的所有结构简式:___________ 。
①属于芳香族化合物;②与A具有相同的官能团;③分子中有4种氢原子,个数比为1∶1∶2∶6
(1)取3.4gA在O2中充分燃烧,将燃烧的产物依次通入浓硫酸和碱石灰,分别增重1.8g和8.8g,则A的实验式是
(2)用质谱法对A进行分析,其质谱图如图,则有机物A的分子式是
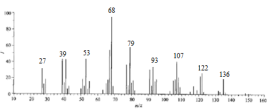
(3)用红外光谱法分析,有机物A中含有苯环、羧基、甲基;用核磁共振氢谱法分析该物质,其核磁共振氢谱图如下,由此推断有机物A的结构简式为
(4)B与A互为同系物,且相对分子量比A大14,请写出满足下列要求的B的同分异构体的所有结构简式:
①属于芳香族化合物;②与A具有相同的官能团;③分子中有4种氢原子,个数比为1∶1∶2∶6
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】写出下列有机物的系统命名或结构简式:
(1)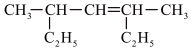
___________ ;
(2)
___________ ;
(3)2,5-二甲基-4-乙基庚烷___________ ;
(4)3-甲基-2-戊烯___________ 。
(1)
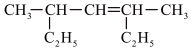
(2)

(3)2,5-二甲基-4-乙基庚烷
(4)3-甲基-2-戊烯
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】按要求回答下列问题:
(1)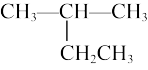 的系统命名为
的系统命名为_______ 。
(2)3-甲基-2-戊烯的结构简式为_______ 。
(3) 中的官能团名称为
中的官能团名称为_______ 。
(4)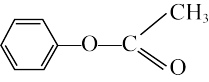 的1H-核磁共振谱图中有
的1H-核磁共振谱图中有______ 组特征峰。
(5)分子式为C5H10且属于烯烃的同分异构体有_______ 种。
(6)某有机物由C、H、O三种元素组成,相对分子质量为62,它的红外吸收光谱表明有羟基O-H键和烃基C-H键的吸收峰,且核磁共振氢谱中两组吸收峰面积比为1:2,则该有机物的结构简式为_______ 。
(1)
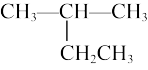 的系统命名为
的系统命名为(2)3-甲基-2-戊烯的结构简式为
(3)
 中的官能团名称为
中的官能团名称为(4)
 的1H-核磁共振谱图中有
的1H-核磁共振谱图中有(5)分子式为C5H10且属于烯烃的同分异构体有
(6)某有机物由C、H、O三种元素组成,相对分子质量为62,它的红外吸收光谱表明有羟基O-H键和烃基C-H键的吸收峰,且核磁共振氢谱中两组吸收峰面积比为1:2,则该有机物的结构简式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】写出下列有机物的系统命名或结构简式
(1)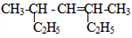
________________
(2)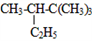
________________
(3)CH3CH(CH3)C(CH3)2(CH2)2CH3________________
(4)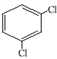
________________
(5)2,5-二甲基-4-乙基庚烷________________
(6)2-甲基-2-戊烯________________
(7)间三甲苯________________
(8)相对分子质量为72且沸点最低的烷烃的结构简式________________ 。
(1)
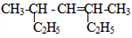
(2)
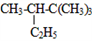
(3)CH3CH(CH3)C(CH3)2(CH2)2CH3
(4)

(5)2,5-二甲基-4-乙基庚烷
(6)2-甲基-2-戊烯
(7)间三甲苯
(8)相对分子质量为72且沸点最低的烷烃的结构简式
您最近一年使用:0次



