实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示,回答下列问题:

(1)A装置盛放浓盐酸的仪器的名称为_______ ,D管中发生的反应的化学方程式为_______ 。
(2)进行实验时应先点燃_______ (填“A”或“D”)处酒精灯,目的是_______ 。
(3)F装置所起的作用是①_______ ②防止空气中水蒸气进入D。
(4)将氯气通入氢氧化钙悬浊液中,制得漂粉精发生的化学反应方程式:_______ 。
(5)用下列两种方法制取氯气:①用含氯化氢4mol的浓盐酸与足量的二氧化锰反应②用1mol二氧化锰与足量的浓盐酸反应,则所得氯气_______。

(1)A装置盛放浓盐酸的仪器的名称为
(2)进行实验时应先点燃
(3)F装置所起的作用是①
(4)将氯气通入氢氧化钙悬浊液中,制得漂粉精发生的化学反应方程式:
(5)用下列两种方法制取氯气:①用含氯化氢4mol的浓盐酸与足量的二氧化锰反应②用1mol二氧化锰与足量的浓盐酸反应,则所得氯气_______。
| A.①比②多 | B.②比①多 | C.一样多 | D.无法比较 |
更新时间:2022-11-15 11:35:00
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:

(1)溶解:溶解后过滤,将滤渣洗涤2~3次,滤渣的主要成分是________ 。(填化学式)
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是________________ 。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++ 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++ 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________________ 。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:______________________________________ 。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是_______________________ 。
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是___________________________ 。

(6)三氧化铁是一种重要的化合物,可以用来腐蚀电路板。常温下,某腐蚀废液中含有0.5 mol•L-1 Fe3+和0.26 mol•L-1 Cu2+,欲使Fe3+完全沉淀c(Fe3+)<4×10-5 mol•L-1时完全沉淀]而Cu2+不沉淀,则需控制溶液 pH的范围为_________________ 。 [KspCu(OH)2]=2.6×10-19;Ksp[Fe(OH)3]=4×10-38

(1)溶解:溶解后过滤,将滤渣洗涤2~3次,滤渣的主要成分是
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++ 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++ 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是

(6)三氧化铁是一种重要的化合物,可以用来腐蚀电路板。常温下,某腐蚀废液中含有0.5 mol•L-1 Fe3+和0.26 mol•L-1 Cu2+,欲使Fe3+完全沉淀c(Fe3+)<4×10-5 mol•L-1时完全沉淀]而Cu2+不沉淀,则需控制溶液 pH的范围为
您最近一年使用:0次
【推荐2】回答下列问题:
(1)按如图所示操作,充分反应后:

①I中发生反应的离子方程式为_______ ;
②II中铜丝上观察到的现象是_______ ;
③结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_______ 。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、 HNO3、NO、H2O。该反应体系中的还原产物是_______ 。
(3)将Cl2通入HBr溶液中,发生反应Cl2+2Br-=2Cl-+Br2,而将少量 Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,这个事实说明具有还原性的粒子的还原性强弱顺序为_______ 。
(1)按如图所示操作,充分反应后:

①I中发生反应的离子方程式为
②II中铜丝上观察到的现象是
③结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、 HNO3、NO、H2O。该反应体系中的还原产物是
(3)将Cl2通入HBr溶液中,发生反应Cl2+2Br-=2Cl-+Br2,而将少量 Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,这个事实说明具有还原性的粒子的还原性强弱顺序为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】(NH4)2[Ce(NO3)6](硝酸铈铵)是橙红色单斜细粒结晶,易溶于水,几乎不溶于浓硝酸。实验室由稀土氟化物(含28%二氧化铈、37.7%其他稀土金属氧化物、4.5%的氧化钙及金属氟化物)制备硝酸铈铵时的主要实验步骤如下:
I.取适量稀土氟化物于铂皿或铅皿中,加适量水在沙浴上加热,搅拌下缓缓加入适量浓硫酸,充分加热,直至产生SO3白烟为止,冷却得混合物。
II.将上述混合物用适量水浸取,得浸取液,向其中加入NaOH溶液至溶液呈强碱性,过滤、洗涤至不含SO ,得到灰白色Ce(OH)3。
,得到灰白色Ce(OH)3。
III.由步骤II制得的Ce(OH)3制取Ce(OH)4(黄色难溶物)。
IV.向Ce(OH)4沉淀物中加入浓硝酸加热至浆状{生成H2[Ce(NO3)6]},再加入稍过量的NH4NO3晶体,充分搅拌后重新加热至糊状结晶体,冷却、过滤得硝酸铈铵粗品。
回答下列问题:
(1)步骤I中用铂皿或铅皿中而不用玻璃仪器的主要原因是____ 。
(2)步骤III中由Ce(OH)3制取Ce(OH)4的装置如图所示:
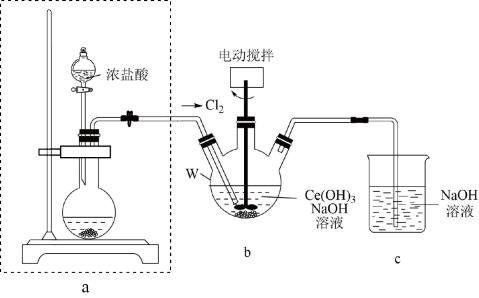
①装置a的烧瓶中盛放的固体为____ (填化学式);装置b中仪器W的名称是____ 。
②当b中沉淀完全变为黄色后,停止通Cl2后改通空气(图中框内改通空气装置)的目的是_____ 。
③将装置b中的反应混合物过滤、洗涤,能说明沉淀已洗涤干净的实验方法是____ 。
(3)步骤IV中H2[Ce(NO3)6]与NH4NO3发生反应的化学方程式为____ ;将得到的粗品进一步提纯可采用的方法是____ (填操作名称)。
I.取适量稀土氟化物于铂皿或铅皿中,加适量水在沙浴上加热,搅拌下缓缓加入适量浓硫酸,充分加热,直至产生SO3白烟为止,冷却得混合物。
II.将上述混合物用适量水浸取,得浸取液,向其中加入NaOH溶液至溶液呈强碱性,过滤、洗涤至不含SO
 ,得到灰白色Ce(OH)3。
,得到灰白色Ce(OH)3。III.由步骤II制得的Ce(OH)3制取Ce(OH)4(黄色难溶物)。
IV.向Ce(OH)4沉淀物中加入浓硝酸加热至浆状{生成H2[Ce(NO3)6]},再加入稍过量的NH4NO3晶体,充分搅拌后重新加热至糊状结晶体,冷却、过滤得硝酸铈铵粗品。
回答下列问题:
(1)步骤I中用铂皿或铅皿中而不用玻璃仪器的主要原因是
(2)步骤III中由Ce(OH)3制取Ce(OH)4的装置如图所示:

①装置a的烧瓶中盛放的固体为
②当b中沉淀完全变为黄色后,停止通Cl2后改通空气(图中框内改通空气装置)的目的是
③将装置b中的反应混合物过滤、洗涤,能说明沉淀已洗涤干净的实验方法是
(3)步骤IV中H2[Ce(NO3)6]与NH4NO3发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所用仪器如图所示:

(1)盛放浓盐酸的仪器名称是_______ 。
(2)装置II中,盛放的试剂是_______ ;装置III中浓硫酸的作用是_______ 。
(3)装置V中反应的离子方程式为_______ 。
(4)装置I中反应的化学方程式为_______ ;该反应体现浓盐酸的_______ 性。
(5)实验室用下列方法制取氯气:
①用含 146g 氯化氢的浓盐酸与足量的二氧化锰反应;
②用 87g 二氧化锰与足量浓盐酸反应。
若不考虑氯化氢的挥发,则反应后所得氯气的质量_______ 。
A.①比②多 B. ②比①多 C. 两种方法一样多 D. 无法比较

(1)盛放浓盐酸的仪器名称是
(2)装置II中,盛放的试剂是
(3)装置V中反应的离子方程式为
(4)装置I中反应的化学方程式为
(5)实验室用下列方法制取氯气:
①用含 146g 氯化氢的浓盐酸与足量的二氧化锰反应;
②用 87g 二氧化锰与足量浓盐酸反应。
若不考虑氯化氢的挥发,则反应后所得氯气的质量
A.①比②多 B. ②比①多 C. 两种方法一样多 D. 无法比较
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某化学兴趣小组同学为验证氯气的性质并制备少量干燥的氯化铁,设计并进行如下实验:
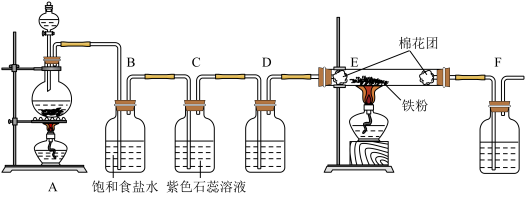
回答下列问题:
(1)写出A中制取氯气的化学方程式__________________________________ 。
(2)B装置的作用是_____________ 。
(3)实验时C中可观察到的现象是_________________________ 。
(4)E中发生反应的化学方程式是_________ 。
(5)F瓶溶液发生反应的离子方程式或化学方程式___________ 。

回答下列问题:
(1)写出A中制取氯气的化学方程式
(2)B装置的作用是
(3)实验时C中可观察到的现象是
(4)E中发生反应的化学方程式是
(5)F瓶溶液发生反应的离子方程式或化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
(1)将钠、镁、铝、钾各1mol分别投入到足量的相同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈的单质是_________ ,与盐酸反应产生的气体最多的是_________ 。
(2)向Na2S 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应离子方程式为_________ 。
(3)利用如图装置可验证同主族元素非金属性的变化规律:仪器A的名称为_________ ,装置D的作用为______________________ ;

①若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________ 的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用______ 溶液吸收尾气.
②若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液______________________ 的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_________ 溶液的洗气瓶.
(1)将钠、镁、铝、钾各1mol分别投入到足量的相同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈的单质是
(2)向Na2S 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应离子方程式为
(3)利用如图装置可验证同主族元素非金属性的变化规律:仪器A的名称为

①若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4
 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液②若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列问题
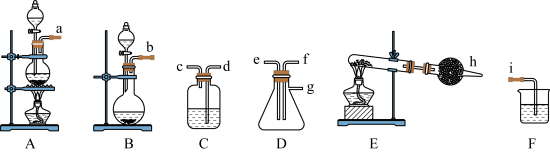
用A、D、E、F装置探究Cl2和NH3反应生成一种盐和一种常见单质气体。
(1)用装置E制备NH3的化学方程式为___________ 。干燥氨气可选用的干燥剂是___________ 。
(2)Cl2和NH3在装置D中反应的化学方程式为___________ 。该反应中被氧化的元素为___________ 。
(3)用装置A制备Cl2的离子方程式为___________ 。有同学认为,装置D中出现的白烟不一定是Cl2和NH3反应产生的。为了排除干扰,他在装置A后面连接了装置C,装置C中的试剂为___________ 。
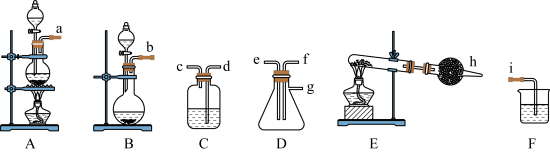
用A、D、E、F装置探究Cl2和NH3反应生成一种盐和一种常见单质气体。
(1)用装置E制备NH3的化学方程式为
(2)Cl2和NH3在装置D中反应的化学方程式为
(3)用装置A制备Cl2的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】下图是一套实验室制取并验证氯气部分化学性质的实验装置。
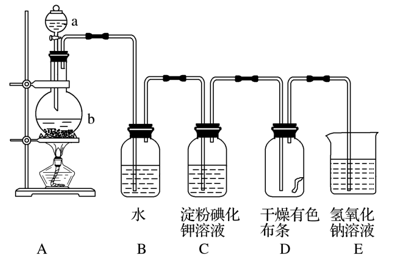
回答下列问题:
(1)当有少量Cl2气流通过后,装置C中观察到的现象为____________ 。
(2)当Cl2气流持续通过 时,装置D中干燥的有色布条
时,装置D中干燥的有色布条__________ (填“能”或“不能”,下同)褪色,若在装置C和D之间加一个盛有浓硫酸的洗气瓶,则装置D中干燥的有色布条______________ 褪色。
(3)装置E中发生反应的化学方程式为______________________________________ 。

回答下列问题:
(1)当有少量Cl2气流通过后,装置C中观察到的现象为
(2)当Cl2气流持续通过
 时,装置D中干燥的有色布条
时,装置D中干燥的有色布条(3)装置E中发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和燃料的制取中也有重要作用。某化学学习小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯。SO2(g)+Cl2(g)═SO2Cl2(l) △H=-97.3 kJ•mol-1。实验装置如图所示(部分夹持装置未画出):

已知:硫酰氯通常条件下为无色液体,熔点-54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。回答下列问题:
(1)盛放亚硫酸钠的仪器名称是___________ ,装置丙的冷凝管中进水口是___________ (填a或b)
(2)戊装置上方分液漏斗中最好选用下列___________ 试剂。(填字母)
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.6.0 mol/L盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应化学方程式是___________ 。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H=SO2Cl2+H2SO4,分离两种产物的方法是___________ (填入正确选项前的字母)。
a.重结晶 b.过滤 c.蒸馏 d.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是___________ (使用必要文字和相关方程式加以解释)。

已知:硫酰氯通常条件下为无色液体,熔点-54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。回答下列问题:
(1)盛放亚硫酸钠的仪器名称是
(2)戊装置上方分液漏斗中最好选用下列
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.6.0 mol/L盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应化学方程式是
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H=SO2Cl2+H2SO4,分离两种产物的方法是
a.重结晶 b.过滤 c.蒸馏 d.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】氯化镁(MgCl2)可用作部分食品的添加剂、小麦粉处理剂、融雪剂等。某MgCO3样品中含有Fe2O3、FeO杂质,以该样品制取MgCl2溶液的流程如图:

已知: Fe3+在pH=6时可完全生成Fe (OH)3沉淀,Fe2+在pH=7.6时可完全生成Fe (OH) 2沉淀。
请回答下列问题:
(1)Fe2O3属于_____ (填“酸”或“碱”)性氧化物,写出一条基于其物理性质的用途________________ 。
(2)“酸溶”所得气体的电子式为__________________ 。
(3)加入氯水的作用是__________________ ,该反应的离子方程式为_____________________ 。
(4)滤渣的化学式为______________ 。
(5)请设计实验方案,检验过滤后所得氯化镁溶液中铁元素是否已被除尽:_________________ 。

已知: Fe3+在pH=6时可完全生成Fe (OH)3沉淀,Fe2+在pH=7.6时可完全生成Fe (OH) 2沉淀。
请回答下列问题:
(1)Fe2O3属于
(2)“酸溶”所得气体的电子式为
(3)加入氯水的作用是
(4)滤渣的化学式为
(5)请设计实验方案,检验过滤后所得氯化镁溶液中铁元素是否已被除尽:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】用工业废渣(主要含有Fe2O3、FeO及少量Al、Fe)制备FeSO4·7H2O的流程如下:

(1)“浸泡”过程中反应的离子方程式为____________ 。
(2) “还原”时,FeS2(难溶于水,铁为+2价)与溶液中的Fe2(SO4)3反应,产物为FeSO4和H2SO4,该反应的离子方程式为____________ 。
(3)检验“还原”反应已经完全的方法是____________ 。
(4)由“还原”所得溶液制取FeSO4·7H2O晶体的操作过程为____________ 。
(5)将FeSO4·7H2O在空气中加热分解所得气体冷却后可得绿矾油,绿矾油就是硫酸。验证绿矾油是硫酸的实验方法是____________ 。

(1)“浸泡”过程中反应的离子方程式为
(2) “还原”时,FeS2(难溶于水,铁为+2价)与溶液中的Fe2(SO4)3反应,产物为FeSO4和H2SO4,该反应的离子方程式为
(3)检验“还原”反应已经完全的方法是
(4)由“还原”所得溶液制取FeSO4·7H2O晶体的操作过程为
(5)将FeSO4·7H2O在空气中加热分解所得气体冷却后可得绿矾油,绿矾油就是硫酸。验证绿矾油是硫酸的实验方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】苯乙酸铜是合成优良催化剂、传感材料—纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线。

制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。

制备苯乙酸的反应原理为:
 +2H2O+H2SO4
+2H2O+H2SO4
 +NH4HSO4
+NH4HSO4
(1)配置100mL70%的硫酸(密度1.61g·cm-3)需取_____ mL98%的浓硫酸(密度1.84g·cm-3)。
(2)仪器b的名称_____ ,仪器c的作用是_____ 。
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_____ 。分离苯乙酸粗品不需要的仪器是_____ (填标号)。
A.分液漏 B.漏斗 C.直形冷凝管 D.烧杯 E.玻璃棒
(4)在实验中用5.0mL苯乙腈,最终获得3.2g苯乙酸,计算产率为_____ (结果保留三位有效数字)。

制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。

制备苯乙酸的反应原理为:
 +2H2O+H2SO4
+2H2O+H2SO4
 +NH4HSO4
+NH4HSO4| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(g·cm-3) |
| 苯乙腈 | 117 | -48 | 197 | 微溶于冷水,易溶于乙醇 | 1.08 |
| 苯乙酸 | 136 | 76.5 | 161 | 微溶于冷水,易溶于乙醇 | 1.17 |
(1)配置100mL70%的硫酸(密度1.61g·cm-3)需取
(2)仪器b的名称
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
A.分液漏 B.漏斗 C.直形冷凝管 D.烧杯 E.玻璃棒
(4)在实验中用5.0mL苯乙腈,最终获得3.2g苯乙酸,计算产率为
您最近一年使用:0次



