(1)CO用于处理大气污染物
 所发生的反应为
所发生的反应为
 。几种物质的相对能量如下:
。几种物质的相对能量如下:物质 |
|
|
|
|
相对能量/ | 475.5 | 283 | 0 | 393.5 |
①

 。改变下列“量”,不会引起
。改变下列“量”,不会引起 发生变化的是
发生变化的是A.温度 B.催化剂 C.化学计量数
②有人提出上述反应可以用“
 ”作催化剂,其总反应分两步进行。
”作催化剂,其总反应分两步进行。第一步:
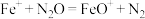 ,
,第二步:
第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率
(2)在实验室,采用
 测定空气中CO的含量。在密闭容器中加入足量的
测定空气中CO的含量。在密闭容器中加入足量的 粉末和一定的CO,发生反应
粉末和一定的CO,发生反应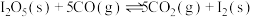 ,测得CO的转化率如图所示。
,测得CO的转化率如图所示。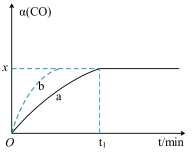
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是
②在此温度下,该可逆反应的平衡常数K=
(3)工业上用CO和
 合成
合成 。在1L恒容密闭容器中充入1molCO(g)和
。在1L恒容密闭容器中充入1molCO(g)和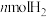 ,在250℃时发生反应
,在250℃时发生反应 ,测得混合气体中
,测得混合气体中 的体积分数与
的体积分数与 的物质的量的关系如图所示。在a、b、c、d点中,CO的平衡转化率最大的点是
的物质的量的关系如图所示。在a、b、c、d点中,CO的平衡转化率最大的点是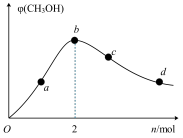
(4)有人提出利用
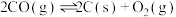 消除CO对环境的污染,你的评价是
消除CO对环境的污染,你的评价是相似题推荐
(1)用Cu2Al2O4作催化剂制备乙酸
已知:CO2(g)+CH4(g)
 CH3COOH(g) ∆H=akJ∙mol-1,各物质相对能量大小如图。
CH3COOH(g) ∆H=akJ∙mol-1,各物质相对能量大小如图。
①a=
②反应物的活化分子浓度大小:过程I
(2)甲烷超干催化重整(DRM)制备CO,在Ni、CaO及Fe3O4的共同催化作用下,可以获得极高浓度的CO,其机理如下:
第①步:Ni基催化CH4(g)+CO2(g)
 2CO(g)+2H2(g);
2CO(g)+2H2(g);第②步:Fe的还原Fe3O4(s)+4H2(g)
 3Fe(s)+4H2O(g)、Fe3O4(s)+4CO(g)
3Fe(s)+4H2O(g)、Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g);
3Fe(s)+4CO2(g);第③步:CO2的捕获CaO(s)+CO2(g)=CaCO3(s);
第④步:CO2的释放与还原CaCO3(s)=CaO(s)+CO2(g)、4CO2(g)+3Fe(s)=Fe3O4(s)+4CO(g)。
设计第②步与第③步反应有利于实现氢物种与
 =
= (3)甲烷催化重整与压强的关系
已知:CH4(g)+CO2(g)
 2CO(g)+2H2(g),现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2 (g),三个容器的反应压强分别为P1 atm、P2 atm、P3 atm,在其他条件相同的情况下,反应均进行到t min时,CO2的平衡体积分数φ(CO2)如下左图,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是
2CO(g)+2H2(g),现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2 (g),三个容器的反应压强分别为P1 atm、P2 atm、P3 atm,在其他条件相同的情况下,反应均进行到t min时,CO2的平衡体积分数φ(CO2)如下左图,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是 
(4)甲烷用于燃料电池
已知:甲烷电池的工作原理如上图,则负极反应方程式为
反应I(热裂解):CH3COOH(g)⇌2CO(g)+2H2(g) △H1
反应II(脱羧基):CH3COOH(g)⇌CH4(g)+CO2(g) △H2
已知:反应I的活化能为(E5-E2)kJ,反应I逆反应的活化能为(E5-E3)kJ,反应II的活化能为(E4-E2)kJ,反应II逆反应的活化能为(E4-E1)kJ,E1到E5能量依次增大
(1)△H1+△H2=
(2)在不同温度下,向密闭容器中充入等量醋酸蒸汽,反应相同时间后,测得各气体的产率与温度的关系如图所示:
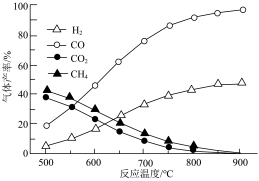
①约650℃之前,氢气产率低于甲烷的原因是;
②约650℃之后,随着温度升高后,氢气产率高于甲烷的原因是:
a. 反应II速率减慢
b. 反应I速率加快的程度比反应II大
c. 反应I正向移动,而反应II逆向移动
d. 反应I正向移动的程度大于反应II正向移动的程度
③根据图像分析,该容器中一定发生了另外的副反应,理由是:
(3)投入一定量的乙酸,在相同压强下,经过相同反应时间测得如下实验数据:
| 温度(℃) | 催化剂 | CH3COOH转化率 | H2的选择性 |
| 550 | 甲 | 14.5 | 40.2 |
| 550 | 乙 | 11.1 | 62.1 |
| 600 | 甲 | 11.2 | 41.2 |
| 600 | 乙 | 10.3 | 63.3 |
(H2的选择性:转化的CH3COOH中生成H2的百分比 )
①表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成H2的选择性有显著的影响,其原因是
②有利于提高CH3COOH转化为H2平衡转化率的措施有
A.使用催化剂甲 B.使用催化剂乙
C.升高反应温度 D.增加反应物的浓度
(4)利用合适的催化剂使另外的副反应不发生。温度为TK,达到平衡时,总压强为PkPa,反应I消耗乙酸40%,反应II消耗乙酸20%,乙酸体积分数为
(1)为了高效利用能源并且减少
 的排放,可以将
的排放,可以将 和乙烷反应制备乙烯。
和乙烷反应制备乙烯。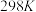 时,相关物质的相对能量如图,已知
时,相关物质的相对能量如图,已知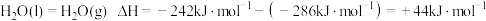 。请写出
。请写出 与乙烷反应生成乙烯、
与乙烷反应生成乙烯、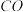 和气态水的热化学方程式为
和气态水的热化学方程式为
(2)已知
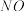 的氧化反应
的氧化反应 ;一定温度下,在刚性密闭容器中,起始充入一定量的
;一定温度下,在刚性密闭容器中,起始充入一定量的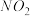 气体(
气体(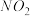 转化为
转化为 忽略不计),此时压强为
忽略不计),此时压强为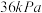 ,在
,在 达到平衡,此时容器的压强为
达到平衡,此时容器的压强为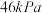 ,则
,则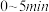 用
用 的分压表示反应速率为
的分压表示反应速率为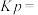
 (
( 是平衡分压代替平衡浓度计算的平衡常数)。
是平衡分压代替平衡浓度计算的平衡常数)。恒温恒容条件下,能说明该反应达到平衡状态的是
A.压强不再变化 B.混合气体的密度不再变化的
C.生成
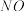 的速率与消耗
的速率与消耗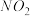 的速率相等 D.混合气体的平均相对分子质量不再变化
的速率相等 D.混合气体的平均相对分子质量不再变化(3)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①
 ;②
;② 。反应体系中组分M、Z的浓度(单位:
。反应体系中组分M、Z的浓度(单位: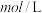 )随时间(单位:
)随时间(单位: )变化情况如图。
)变化情况如图。
计算
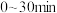 时间段内,Y的平均反应速率为
时间段内,Y的平均反应速率为(4)利用
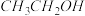 燃料电池电解。可将雾霾中的
燃料电池电解。可将雾霾中的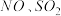 分别转化为
分别转化为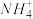 和
和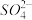 如下图装置所示。则物质甲为
如下图装置所示。则物质甲为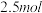 电子时,A的浓度为
电子时,A的浓度为 (电解过程中忽略溶液体积变化)。
(电解过程中忽略溶液体积变化)。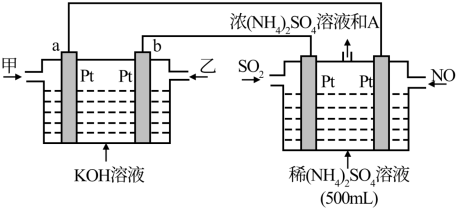
(1)已知:
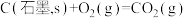
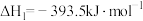
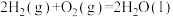
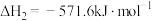
 ΔH=-2599.2kJ
ΔH=-2599.2kJ mol-1
mol-1则由
 和
和 反应生成
反应生成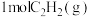 的焓变为
的焓变为甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(2)在一容积为2L的密闭容器内,充入0.2 mol CO与0.4 mol
 发生反应,
发生反应, ,CO的平衡转化率与温度,压强的关系如图所示。
,CO的平衡转化率与温度,压强的关系如图所示。
①该反应的ΔH
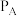
 (填“>、<、=”)。
(填“>、<、=”)。②A、B、C三点的平衡常数
 ,
, ,
,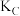 的大小关系是
的大小关系是③下列叙述能说明上述反应能达到化学平衡状态的是
a.
 的消耗速率是
的消耗速率是 生成速率的2倍 b.
生成速率的2倍 b. 的体积分数不再改变
的体积分数不再改变c.混合气体的密度不再改变 d.CO和
 的物质的量之和保持不变
的物质的量之和保持不变(3)在
 压强、
压强、 ℃时,该反应的平衡常数K=
℃时,该反应的平衡常数K= (4)
 ℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、
℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、 :0.2mol、
:0.2mol、 :0.2mol,此时
:0.2mol,此时
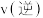 (填“>、<或=”)。
(填“>、<或=”)。
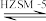 ETBE(g) ΔH。回答下列问题:
ETBE(g) ΔH。回答下列问题:(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的ΔH=a kJ/mol,下列选项正确的是
A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
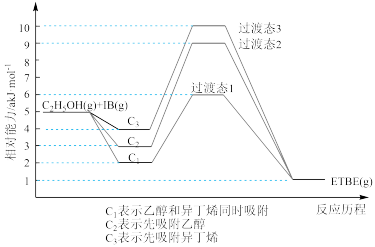
(2)向刚性容器中按物质的量之比1∶1充入乙醇和异丁烯,在温度为378K与388K时异丁烯的转化率随时间变化如图所示。
①图中A、M两点,正反应速率由大到小的顺序为
②388K时,容器内起始总压为P0Pa,用分压表示的该反应的平衡常数Kp=
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:
 (其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
(其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
已知反应速率v=v正-v逆=K正P(C2H5OH)·P(IB)-K逆P(ETBE),计算上图中M点
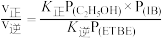 =
=(1)已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol−1②2H2(g)+CO(g)
 CH3OH(g) ΔH2=-128.3kJ·mol−1
CH3OH(g) ΔH2=-128.3kJ·mol−1③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6kJ·mol−1
若某反应的平衡常数表达式为:K=
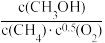 ,则此反应ΔH=
,则此反应ΔH=(2)CH4-CO2催化重整对温室气体的减排具有重要意义。催化重整反应为:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。
2CO(g)+2H2(g)ΔH=+247kJ·mol−1,平衡时CH4的转化率与温度和压强的关系如图所示。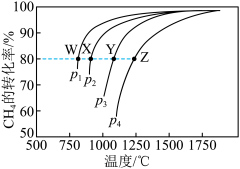
②压强为P4时,在Y点:v正
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为
(3)CO2加氢制备甲酸(HCOOH)可回收利用CO2,温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。
HCOOH(g) ΔH>0,化学平衡常数K=1,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。①当HCOOH的体积分数为25%时,CO2的转化率为
②温度为T1,反应达到平衡时,k逆=
(4)采用电还原法也可将CO2转化为甲酸,在碳酸氢盐的水溶液中,CO2被还原成甲酸的原理如图所示。阴极的电极反应式是
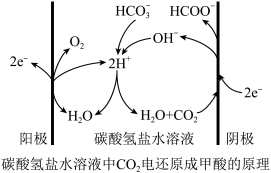
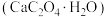 可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:(1)在隔绝空气条件下,
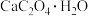 分解反应如下:
分解反应如下:①
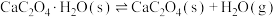
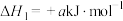 ;
;②
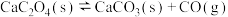
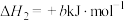 ;
;③
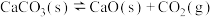
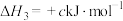 ;
;④
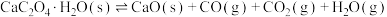

 (上述反应式中,a,b,c都大于0)。
(上述反应式中,a,b,c都大于0)。(2)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生中反应:CaC2O4(s)
 CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=(3)已知反应②CaC2O4(s)
 CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g)
CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g) N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=
N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=(4)在密闭容器中充入足量
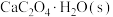 粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:
粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示: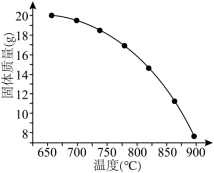
②温度高于800℃时,曲线斜率减小,可能是产物之间发生了可逆的无机氧化还原反应,写出该反应的化学方程式:
(5)在400℃时,向体积可变的密闭容器中充入足量CaC2O4•H2O粉末,只发生(1)中反应①。达到平衡时体积为1L,压强为p0kPa.温度保持不变,将体积变为2L并保持体积不变,直至反应达到平衡,平衡时压强为
(6)氧化钙晶胞如图所示,已知:
 代表阿伏加德罗常数的值,阳离子半径为100pm。
代表阿伏加德罗常数的值,阳离子半径为100pm。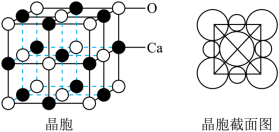
A.
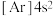 B.
B.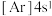 C.
C.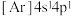 D.
D.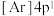
②氧化钙的摩尔体积为
 。
。
 用途广泛,是常见的漂白剂、疏松剂、食品抗氧化剂,某研究性学习小组探究焦亚硫酸钠的制取以及其性质。请回答下列问题:
用途广泛,是常见的漂白剂、疏松剂、食品抗氧化剂,某研究性学习小组探究焦亚硫酸钠的制取以及其性质。请回答下列问题:Ⅰ.制备、收集干燥的

(1)实验室制取
 的试剂是
的试剂是 填字母
填字母 。
。①

 溶液 ②
溶液 ②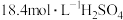 溶液 ③
溶液 ③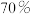 的
的 溶液 ④
溶液 ④ 固体 ⑤
固体 ⑤ 固体
固体A.①④ B.②④ C.②③ D.③⑤
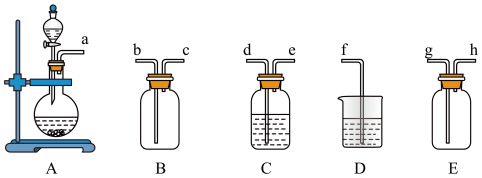
(2)实验室制取
 的化学方程式为
的化学方程式为按气流方向连接各仪器






Ⅱ.焦亚硫酸钠的制取
①在搅拌的条件下,向饱和碳酸钠溶液中通入SO2至反应液的
 ;
;②将溶液蒸发浓缩、结晶、离心分离,
 干燥得到成品。
干燥得到成品。(3)SO2与
 溶液反应生成
溶液反应生成 和
和 的化学方程式为
的化学方程式为 溶液的pH小于7,说明
溶液的pH小于7,说明 的电离程度大于其水解程度,溶液中
的电离程度大于其水解程度,溶液中
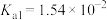 ,
,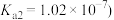
Ⅲ
 焦亚硫酸钠的性质
焦亚硫酸钠的性质(4)N2S2O5作脱氧剂时的反应原理为:
 ,该反应中,氧化产物是
,该反应中,氧化产物是 晶体作脱氧剂时已被氧化的实验方案是
晶体作脱氧剂时已被氧化的实验方案是(5)适当加入
 使面团变得柔软,面团延伸性增加,拉断面团所需的拉力也逐渐减少,过度加入
使面团变得柔软,面团延伸性增加,拉断面团所需的拉力也逐渐减少,过度加入 会严重破坏蛋白质网络结构,面团变得稀软、发黏、延伸性下降,如图所示。综合来说,当添加量为
会严重破坏蛋白质网络结构,面团变得稀软、发黏、延伸性下降,如图所示。综合来说,当添加量为 填字母序号
填字母序号 时,面团延伸性较好。
时,面团延伸性较好。A.0~0.05‰ B.0.05‰~0.1‰ C.0.10‰~0.15‰ D.0.20‰~0.25‰
【推荐3】CO、CO2、CH4等含碳化合物的综合利用是当今科技的重点研究对象之一。
(1)双功能催化剂的催化作用,突破了低温下水煤气转换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]时高转化率与高反应速率不能兼得的难题。反应过程示意图如下:

下列说法正确的是
A.过程I、过程II、过程皿均为吸热反应
B.图示的三个过程都与H2O有关
C.图示的三个过程中均有极性共价键的断裂和生成
D.使用催化剂降低了整个水煤气变换反应过程的ΔH
(2)已知:
①2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH=+180kJ·mol-1
表示CO燃烧热的热化学方程式为
(3)某催化剂的M型、N型均可催化反应2CO(g)+O2(g)=2CO2(g),向容积相同的恒容密闭容器中分别充入等物质的量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(α)如图所示。

①图中a、b、c、d、e五个点对应状态下,反应速率最慢的是
②N型催化剂条件下,从a点到e点,CO的转化率先增大,后减小,e点时突然减小的原因为
③若b点容器中c(O2)=0.4mol·L-1,则T℃时该反应的平衡常数K=
(4)在一定条件下,CH4(g)+CO2(g)=2H2(g)+2CO(g),可制得合成气H2和CO。在2L密闭容器中充入CO2和CH4,使其物质的量浓度均为0.5mol·L-1,达到平衡时CO的体积分数为X,若恒温恒容下,向平衡体系中再充入1mol CO2和1mol CH4。回答下列问题:
①化学平衡
②再次平衡时,CO的体积分数
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
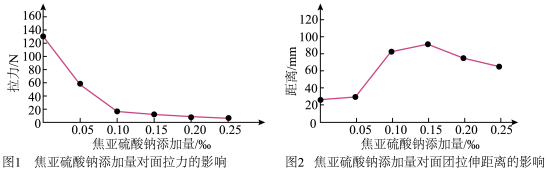
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
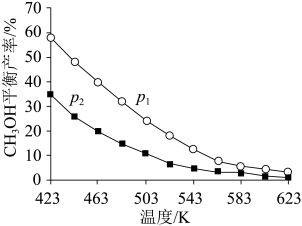
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:
 )在有机合成、化学电源制造等方面有广泛的应用。工业上用硫酸厂尾气中的
)在有机合成、化学电源制造等方面有广泛的应用。工业上用硫酸厂尾气中的 与
与 、
、 为原料合成
为原料合成 ,反应如下:
,反应如下:Ⅰ.
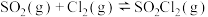
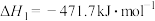
Ⅱ.
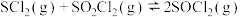
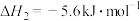
总反应:
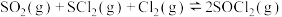

(1)总反应
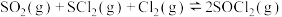 在
在(2)为提高
 的反应速率和平衡转化率,下列措施合理的是
的反应速率和平衡转化率,下列措施合理的是A.及时液化并移走
 B.使用选择性更好的催化剂
B.使用选择性更好的催化剂C.升高温度 D.增加
 的浓度
的浓度(3)该合成反应过程中要注意保持无水环境,否则会造成氯化亚砜发生剧烈反应,生成两种酸性气体,该反应的方程式为
(4)一定条件下,在密闭容器中通入物质的量均为
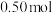 的
的 、
、 和
和 ,发生反应,测得初始压强为
,发生反应,测得初始压强为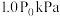 反应过程中容器内总压强(P)随时间(t)变化如曲线1所示(平衡时温度与初始温度相同)。
反应过程中容器内总压强(P)随时间(t)变化如曲线1所示(平衡时温度与初始温度相同)。
①反应开始,容器内压强增大的原因是
②若只是改变某一条件,测得压强随时间的变化如曲线2所示,则改变的条件是
③在图中画出反应物
 平衡时的体积分数随温度的变化曲线图
平衡时的体积分数随温度的变化曲线图
④该条件下达到平衡时,测得容器内
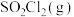 的物质的量为
的物质的量为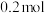 ,平衡时的总压强为
,平衡时的总压强为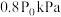 ,则总反应的平衡常数为
,则总反应的平衡常数为
 (对气相反应,用某组分(
(对气相反应,用某组分( )的平衡压强(PB)代替物质的量浓度(cB)表示的平衡常数(记作
)的平衡压强(PB)代替物质的量浓度(cB)表示的平衡常数(记作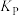 ),
),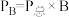 的物质的量分数)
的物质的量分数)
 2CO(g) ∆H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
2CO(g) ∆H,测得压强、温度对CO、CO2的平衡组成的影响如图所示: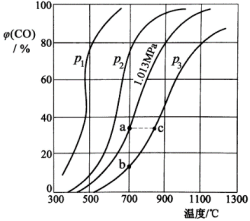
回答下列问题:
(1)p1、p2、p3的大小关系是
(2)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
反应1:CO(g)+3H2(g)
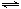 CH4(g)+H2O(g) ∆H1= a kJ/mol
CH4(g)+H2O(g) ∆H1= a kJ/mol反应2:CO(g)+H2O(g)
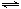 CO2(g)+H2(g) ∆H2= b kJ/mol
CO2(g)+H2(g) ∆H2= b kJ/mol① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是
② 已知298 K时相关化学键键能数据为:
| 化学键 | H—H | O—H | C—H |  |
| E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
则根据键能计算,∆H1=
(3)一定条件下,CO2(g)+3H2(g)
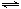 CH3OH(g)+H2O(g) ΔH3,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K值=
CH3OH(g)+H2O(g) ΔH3,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K值=






