碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,还含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO的质量分数≤0.43%)的实验流程如下:
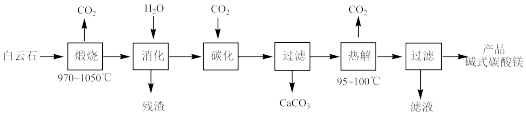
(1)“煅烧”时发生主要反应的化学方程式为_______ 。
(2)常温常压下“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
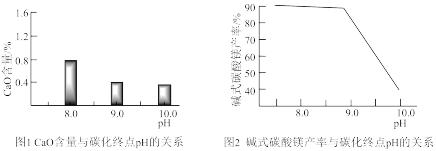
①应控制“碳化”终点pH约为_______ 。
②图2中,当pH=10.0时,镁元素的主要存在形式是_______ (写化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为_______ 。
(4)该工艺为达到清洁生产,可以循环利用的物质是_______ (写化学式)。

(1)“煅烧”时发生主要反应的化学方程式为
(2)常温常压下“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。

①应控制“碳化”终点pH约为
②图2中,当pH=10.0时,镁元素的主要存在形式是
(3)“热解”生成碱式碳酸镁的化学方程式为
(4)该工艺为达到清洁生产,可以循环利用的物质是
更新时间:2022-12-10 15:58:47
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】Ⅰ.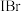 、
、 、
、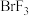 等称之为卤素互化物,
等称之为卤素互化物, 、
、 、
、 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(1)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈 、
、 两种价态,则这种化合物的化学式是
两种价态,则这种化合物的化学式是__________ 。
(2)溴化碘(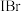 )具有强氧化性,能与
)具有强氧化性,能与 溶液发生反应,发生反应的离子方程式为
溶液发生反应,发生反应的离子方程式为________ ;
(3)①已知某些离子的还原性强弱顺序为 。现将几滴
。现将几滴 溶液滴入到含少量
溶液滴入到含少量 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______ ;
②下列物质中,也可以使该溶液红色褪去的是_______ ;
A 新制氯水 B 碘水 C D 盐酸
D 盐酸
(4) 为剧毒物质,处理含有
为剧毒物质,处理含有 的废水常用的方法是:在碱性条件下用
的废水常用的方法是:在碱性条件下用 溶液将
溶液将 氧化为
氧化为 和一种单质气体,该反应的离子方程式为
和一种单质气体,该反应的离子方程式为_________ ;
(5)已知 的电离平衡常数
的电离平衡常数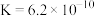 ,
, 的电离平衡常数
的电离平衡常数 ,
, ,则下列离子方程式能发生的是
,则下列离子方程式能发生的是____________ 。
A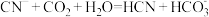 B
B 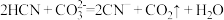
C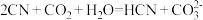 D
D 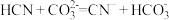
Ⅱ.如下图转化关系: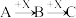
(6)若B为白色胶状不溶物,则A与C反应的离子方程式为_______ 。
(7)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为______ 。
 、
、 、
、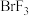 等称之为卤素互化物,
等称之为卤素互化物, 、
、 、
、 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。(1)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈
 、
、 两种价态,则这种化合物的化学式是
两种价态,则这种化合物的化学式是(2)溴化碘(
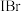 )具有强氧化性,能与
)具有强氧化性,能与 溶液发生反应,发生反应的离子方程式为
溶液发生反应,发生反应的离子方程式为(3)①已知某些离子的还原性强弱顺序为
 。现将几滴
。现将几滴 溶液滴入到含少量
溶液滴入到含少量 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象②下列物质中,也可以使该溶液红色褪去的是
A 新制氯水 B 碘水 C
 D 盐酸
D 盐酸(4)
 为剧毒物质,处理含有
为剧毒物质,处理含有 的废水常用的方法是:在碱性条件下用
的废水常用的方法是:在碱性条件下用 溶液将
溶液将 氧化为
氧化为 和一种单质气体,该反应的离子方程式为
和一种单质气体,该反应的离子方程式为(5)已知
 的电离平衡常数
的电离平衡常数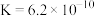 ,
, 的电离平衡常数
的电离平衡常数 ,
, ,则下列离子方程式能发生的是
,则下列离子方程式能发生的是A
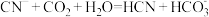 B
B 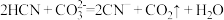
C
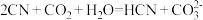 D
D 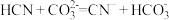
Ⅱ.如下图转化关系:
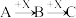
(6)若B为白色胶状不溶物,则A与C反应的离子方程式为
(7)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】离子化合物A由三种常见的短周期元素组成,其中两种是金属元素,一种是非金属元素。按以下流程进行实验:

请回答:
(1)组成A的元素为___________ ,B的电子式为___________ 。
(2)写出固体C部分溶于NaOH溶液的离子反应方程式___________ 。
(3) A与O2反应,氧化剂与还原剂的物质的量之比为___________ 。
(4) A与盐酸发生氧化还原反应,且有无色无味的气体生成,写出该化学反应方程式___________ 。

请回答:
(1)组成A的元素为
(2)写出固体C部分溶于NaOH溶液的离子反应方程式
(3) A与O2反应,氧化剂与还原剂的物质的量之比为
(4) A与盐酸发生氧化还原反应,且有无色无味的气体生成,写出该化学反应方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】按要求回答问题
(1)Ca(OH)2溶液与少量NaHCO3溶液反应的离子方程式:___________ 。
(2)某无色透明溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、NH 、Cl-、SO
、Cl-、SO 、 NO
、 NO 、CO
、CO 中的若干种离子。某同学取50 mL的溶液进行如下实验:
中的若干种离子。某同学取50 mL的溶液进行如下实验:

根据实验判断下列说法中正确的是___________
A.原溶液中一定只含有NH 、Mg2+、SO
、Mg2+、SO 、Cl-
、Cl-
B.原溶液中一定不存在 Fe2+、Fe3+、Ba2+、CO 、NO
、NO
C.原溶液中可能含有NO
D.原溶液中c(K+)=2mol/L
(3)已知:①H2(g)=H2(l) ΔH=-0.92 kJ·mol-1
②O2(g)=O2(l) ΔH=-6.84 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
④H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:___________
(4)已知 4NO2+2CO(NH2)2=2CO2+4N2+4H2O+O2(已知尿素中N为-3 价),该反应的氧化产物为___________ ;若吸收0.15 mol NO2,则转移电子___________ mol。
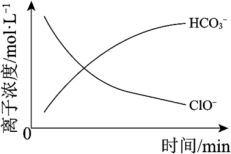
(5)处理某废水时,反应过程中部分离子浓度与反应进程关系如图,反应过程中主要存在N2、HCO 、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式___________ 。
(1)Ca(OH)2溶液与少量NaHCO3溶液反应的离子方程式:
(2)某无色透明溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、NH
 、Cl-、SO
、Cl-、SO 、 NO
、 NO 、CO
、CO 中的若干种离子。某同学取50 mL的溶液进行如下实验:
中的若干种离子。某同学取50 mL的溶液进行如下实验:
根据实验判断下列说法中正确的是
A.原溶液中一定只含有NH
 、Mg2+、SO
、Mg2+、SO 、Cl-
、Cl-B.原溶液中一定不存在 Fe2+、Fe3+、Ba2+、CO
 、NO
、NO
C.原溶液中可能含有NO

D.原溶液中c(K+)=2mol/L
(3)已知:①H2(g)=H2(l) ΔH=-0.92 kJ·mol-1
②O2(g)=O2(l) ΔH=-6.84 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
④H2(g)+
 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1请写出液氢和液氧生成气态水的热化学方程式:
(4)已知 4NO2+2CO(NH2)2=2CO2+4N2+4H2O+O2(已知尿素中N为-3 价),该反应的氧化产物为
(5)处理某废水时,反应过程中部分离子浓度与反应进程关系如图,反应过程中主要存在N2、HCO
 、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
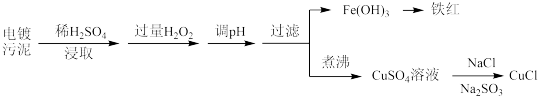
(1)酸浸后加入H2O2的目的是______ ,调pH的最适宜范围为______ 。
(2)调pH过程中加入的试剂合理的是 。
(3)煮沸CuSO4溶液的目的为__________________ 。
(4)25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数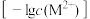 与溶液pH的变化关系如图所示。曲线
与溶液pH的变化关系如图所示。曲线____ (填“a”或“b”)表示Fe(OH)2饱和溶液中的变化关系。当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=______ 。

(5)25℃时,Fe3发生反应: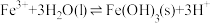 ,则该反应的平衡常数为
,则该反应的平衡常数为________ 。
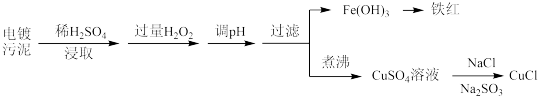
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
| Ksp | 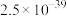 | 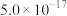 |  |
(1)酸浸后加入H2O2的目的是
(2)调pH过程中加入的试剂合理的是 。
| A.NaOH | B.CuO | C.NH3⋅H2O | D.Cu2(OH)2CO3 |
(4)25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数
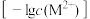 与溶液pH的变化关系如图所示。曲线
与溶液pH的变化关系如图所示。曲线
(5)25℃时,Fe3发生反应:
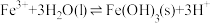 ,则该反应的平衡常数为
,则该反应的平衡常数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
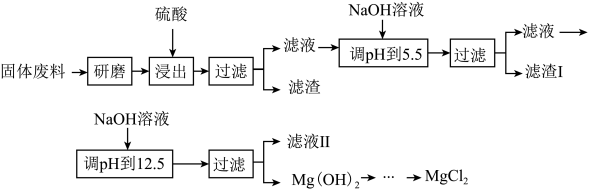
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有______________________________ (要求写出两条)。
(2)滤渣I的主要成分是__________________ 。
Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3→Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示:
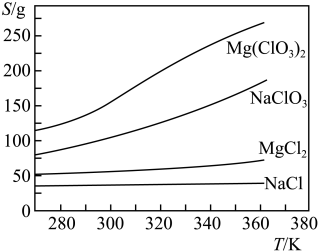
(3)将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:______________________________________________ 。
(4)按条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:________________________________ 。除去产品中该杂质的方法是:_____________ 。

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(2)滤渣I的主要成分是
Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3→Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示:

(3)将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
(4)按条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】金属镓被称为“电子工业脊梁”,与铝同族,性质与铝相似。氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为 、
、 、
、 ,还有少量
,还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下:
(1)“焙烧”过程中 变为
变为 ,则
,则 与纯碱反应的化学方程式为
与纯碱反应的化学方程式为___________ 。
(2)“碱浸”后滤渣的主要成分为___________ (写化学式)。用惰性电极电解含 的溶液可得到金属Ga,阴极的电极反应式为
的溶液可得到金属Ga,阴极的电极反应式为___________ 。
(3)常温下,反应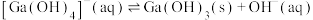 的平衡常数
的平衡常数
___________ 。
(4)“碱浸”后溶液的主要成分为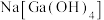 、
、 、
、 。请补充完整流程中“操作”过程的步骤(在方框内填入试剂的化学式或pH值):
。请补充完整流程中“操作”过程的步骤(在方框内填入试剂的化学式或pH值):___________ 。
 溶液、0.1
溶液、0.1  NaOH溶液)
NaOH溶液)
(5)用石墨为电极电解熔融 得到Ga单质,电极材料需要定期补充的是
得到Ga单质,电极材料需要定期补充的是___________ 极(填“阴”或“阳”)。
 、
、 、
、 ,还有少量
,还有少量 等杂质)制备镓和氮化镓的流程如下:
等杂质)制备镓和氮化镓的流程如下: 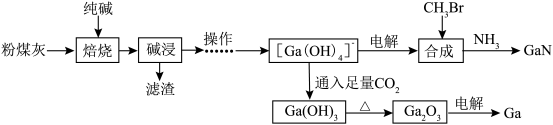
常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度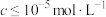 时,可认为已除尽。
时,可认为已除尽。
(1)“焙烧”过程中
 变为
变为 ,则
,则 与纯碱反应的化学方程式为
与纯碱反应的化学方程式为(2)“碱浸”后滤渣的主要成分为
 的溶液可得到金属Ga,阴极的电极反应式为
的溶液可得到金属Ga,阴极的电极反应式为(3)常温下,反应
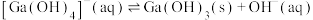 的平衡常数
的平衡常数
(4)“碱浸”后溶液的主要成分为
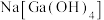 、
、 、
、 。请补充完整流程中“操作”过程的步骤(在方框内填入试剂的化学式或pH值):
。请补充完整流程中“操作”过程的步骤(在方框内填入试剂的化学式或pH值):

 溶液、0.1
溶液、0.1  NaOH溶液)
NaOH溶液)(5)用石墨为电极电解熔融
 得到Ga单质,电极材料需要定期补充的是
得到Ga单质,电极材料需要定期补充的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
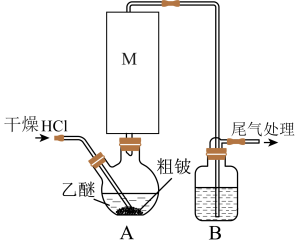
【推荐1】某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④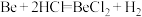 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: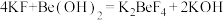 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含 、
、 和
和 的字母表示)。
的字母表示)。
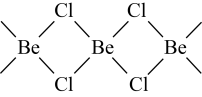
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
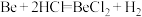 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: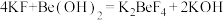 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为 、
、 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质.本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。
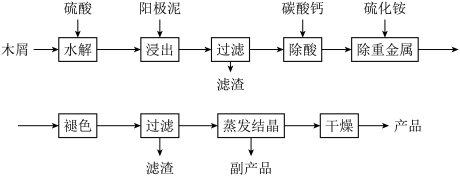
(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为_____________ 。
(2)写出木屑水解反应的化学方程式:___________
配平浸出步骤反应方程式C6H12O6+MnO2+H2SO4→MnSO4+CO2+H2O_________________
(3)若取消除酸操作步骤,将会产生气体_____________ (填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式____ ;
(5)取一定量的阳极泥进行实验分析,得到如图像。硫酸的最合适用量为________ mL,若再增加硫酸的用量,将会导致____________ (填化学式)的消耗量增大。

(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于_________ L。(假设阳极泥中的其它成分不参与反应)

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为
(2)写出木屑水解反应的化学方程式:
配平浸出步骤反应方程式C6H12O6+MnO2+H2SO4→MnSO4+CO2+H2O
(3)若取消除酸操作步骤,将会产生气体
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式
(5)取一定量的阳极泥进行实验分析,得到如图像。硫酸的最合适用量为

(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】氯磺酸(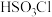 )沸点约152℃,易溶于硫酸,可迅速吸水产生浓烈的白雾。常温下制取氯磺酸的基本原理为
)沸点约152℃,易溶于硫酸,可迅速吸水产生浓烈的白雾。常温下制取氯磺酸的基本原理为 其中
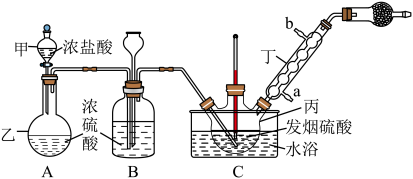
其中 由发烟硫酸提供。可用下列仪器装置进行制备(图中夹持、固定仪器等已略去)。
由发烟硫酸提供。可用下列仪器装置进行制备(图中夹持、固定仪器等已略去)。
回答下列问题:
(1)仪器丙的名称是_______ ,实验过程中仪器丁的进水口为__________ (填“a”或“b”)口。
(2)球形干燥器中装有___________ (填写试剂名称);若无此装置,氯磺酸发生水解的化学方程式为___________ 。
(3)装置B具有干燥气体、___________ 等作用。
(4)当B和C中气泡逸出速率相当时应进行的操作___________ ;随即将装置C改为油浴蒸馏装置,分离氯磺酸时依然要通入HCl气体的目的是___________ 。
(5)氯磺酸产品中可能含有少量 和
和 ,现测定其中总铁量。已知在PH为3-9时,邻菲啰啉能与
,现测定其中总铁量。已知在PH为3-9时,邻菲啰啉能与 形成橙色配合物Fe-phen。Fe-phen在510nm处的吸光度A与溶液中
形成橙色配合物Fe-phen。Fe-phen在510nm处的吸光度A与溶液中 浓度呈线性关系,如下所示:
浓度呈线性关系,如下所示:
①测定实验步骤:取一定质量氯磺酸产品,加水水解为一定体积的强酸性溶液,加入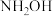 将
将 还原
还原 ;然后依次
;然后依次___________ (填写选项)。
A.加入0.5%邻菲啰啉溶液
B.加入缓冲溶液调节pH=5.0
C.摇匀、静置
②在一定条件下测定溶液的平均吸光度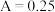 ,该产品中总铁量为
,该产品中总铁量为________ mol(保留两位有效数字)。
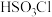 )沸点约152℃,易溶于硫酸,可迅速吸水产生浓烈的白雾。常温下制取氯磺酸的基本原理为
)沸点约152℃,易溶于硫酸,可迅速吸水产生浓烈的白雾。常温下制取氯磺酸的基本原理为 其中
其中 由发烟硫酸提供。可用下列仪器装置进行制备(图中夹持、固定仪器等已略去)。
由发烟硫酸提供。可用下列仪器装置进行制备(图中夹持、固定仪器等已略去)。
回答下列问题:
(1)仪器丙的名称是
(2)球形干燥器中装有
(3)装置B具有干燥气体、
(4)当B和C中气泡逸出速率相当时应进行的操作
(5)氯磺酸产品中可能含有少量
 和
和 ,现测定其中总铁量。已知在PH为3-9时,邻菲啰啉能与
,现测定其中总铁量。已知在PH为3-9时,邻菲啰啉能与 形成橙色配合物Fe-phen。Fe-phen在510nm处的吸光度A与溶液中
形成橙色配合物Fe-phen。Fe-phen在510nm处的吸光度A与溶液中 浓度呈线性关系,如下所示:
浓度呈线性关系,如下所示: 浓度/ 浓度/ | 0 | 0.00080 | 0.0016 | 0.0024 | 0.0032 |
| 吸光度A | 0 | 0.20 | 0.40 | 0.60 | 0.80 |
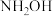 将
将 还原
还原 ;然后依次
;然后依次A.加入0.5%邻菲啰啉溶液
B.加入缓冲溶液调节pH=5.0
C.摇匀、静置
②在一定条件下测定溶液的平均吸光度
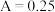 ,该产品中总铁量为
,该产品中总铁量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】某化学小组用钠制备 (不考虑空气中的
(不考虑空气中的 )并测量
)并测量 的纯度。
的纯度。
(1)少量的钠应保存在______ 中。
(2)制备 可利用的装置如下:
可利用的装置如下:

①装置Ⅰ中发生的化学反应是______ 。
②若规定气流的方向为从左到右,各仪器连接的顺序是:空气进入______ ,______ 接______ ,______ 接a,b接c(填字母)。
③装置Ⅳ中盛放的药品是______ 溶液(填化学式),若没有该装置可能导致生成的 中含有杂质,产生该杂质的化学方程式为
中含有杂质,产生该杂质的化学方程式为______ 。
(3)可通过测量产物样品与水反应产生氧气的体积确定 的变质程度,但有资料显示过氧化钠与水反应收集到
的变质程度,但有资料显示过氧化钠与水反应收集到 的体积小于理论值。该小组查阅资料发现:
的体积小于理论值。该小组查阅资料发现:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
i.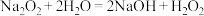
ii.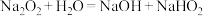
b.与 类似,
类似,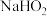 也能在
也能在 催化的条件下分解生成
催化的条件下分解生成
设计如下实验:取0.02mol纯净 与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量
与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量 ,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化如图所示。
,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化如图所示。

①小组同学根据pH的变化判断反应过程中一定发生反应ii,判断的理由是______ 。(已知 越大,溶液pH越大。)
越大,溶液pH越大。)
②根据140s~180s的pH计算出溶液中 ,则此时段内溶液中
,则此时段内溶液中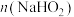 为
为______ 。
③由上述实验得出的结论是______ 。
④取4.0g产物样品,______ (补全实验方案),再加入足量的水,收集产生的氧气并测量体积为0.56L(折合到标准状况),计算过氧化钠的纯度为______ 。
 (不考虑空气中的
(不考虑空气中的 )并测量
)并测量 的纯度。
的纯度。(1)少量的钠应保存在
(2)制备
 可利用的装置如下:
可利用的装置如下:
①装置Ⅰ中发生的化学反应是
②若规定气流的方向为从左到右,各仪器连接的顺序是:空气进入
③装置Ⅳ中盛放的药品是
 中含有杂质,产生该杂质的化学方程式为
中含有杂质,产生该杂质的化学方程式为(3)可通过测量产物样品与水反应产生氧气的体积确定
 的变质程度,但有资料显示过氧化钠与水反应收集到
的变质程度,但有资料显示过氧化钠与水反应收集到 的体积小于理论值。该小组查阅资料发现:
的体积小于理论值。该小组查阅资料发现:a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
i.
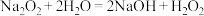
ii.
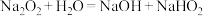
b.与
 类似,
类似,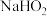 也能在
也能在 催化的条件下分解生成
催化的条件下分解生成
设计如下实验:取0.02mol纯净
 与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量
与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量 ,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化如图所示。
,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化如图所示。
①小组同学根据pH的变化判断反应过程中一定发生反应ii,判断的理由是
 越大,溶液pH越大。)
越大,溶液pH越大。)②根据140s~180s的pH计算出溶液中
 ,则此时段内溶液中
,则此时段内溶液中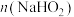 为
为③由上述实验得出的结论是
④取4.0g产物样品,
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】钼酸铵晶体[(NH4)2MoO4]是生产高纯度二硫化钼、三氧化钼等钼制品的基本原料。从废钼催化剂(主要含有MoS2、SiO2和CuFeS2)中回收钼酸铵的工艺流程如图1所示。

回答下列问题:
(1)高温焙烧时生成的金属氧化物是_______ (写化学式)。
(2)若选择两种不同萃取剂按一定比例(协萃比)协同萃取溶液中含金属元素的离子,萃取情况如图2所示,当协萃比为_______ 时更有利于MoO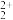 的萃取。
的萃取。

(3)调pH后所得的滤渣的主要成分是_______ (写化学式)。
(4)向有机相中滴加氨水,发生反应的离子方程式主要为_______ 。
(5)向钼酸铵溶液中加入Na2S可生成(NH4)2MoS4,再向混合液中加入盐酸即可得到沉淀MoS3。写出生成MoS3的离子方程式:_______ 。该反应适宜温度是40℃,其原因是_______ 。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8。不纯的Na2MoO4溶液中含有少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去 ,为完全除去
,为完全除去 且尽量减小钼元素损耗,应控制溶液中c(MoO
且尽量减小钼元素损耗,应控制溶液中c(MoO )<
)<_______ mol·L-1(保留2位有效数字)。

回答下列问题:
(1)高温焙烧时生成的金属氧化物是
(2)若选择两种不同萃取剂按一定比例(协萃比)协同萃取溶液中含金属元素的离子,萃取情况如图2所示,当协萃比为
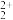 的萃取。
的萃取。
(3)调pH后所得的滤渣的主要成分是
(4)向有机相中滴加氨水,发生反应的离子方程式主要为
(5)向钼酸铵溶液中加入Na2S可生成(NH4)2MoS4,再向混合液中加入盐酸即可得到沉淀MoS3。写出生成MoS3的离子方程式:
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8。不纯的Na2MoO4溶液中含有少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去
 ,为完全除去
,为完全除去 且尽量减小钼元素损耗,应控制溶液中c(MoO
且尽量减小钼元素损耗,应控制溶液中c(MoO )<
)<
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】苯酚是重要的化工原料,有关苯酚的实验如下:
(Ⅰ)苯酚的制备
工业上用异丙苯氧化法合成苯酚,其生产流程如图:
(1)异丙苯氧化过程①温度不能过高的原因是___________ 。
(2)检验有机相中是否含有水的试剂是___________ 。
(3)“操作1”的名称是___________ 。
(Ⅱ)苯酚的实验探究
探究铁盐种类和 对苯酚与
对苯酚与 显色反应的影响。
显色反应的影响。
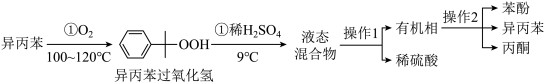
查阅资料:ⅰ.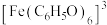 为紫色;
为紫色;
ⅱ. 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;
ⅲ. 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与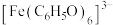 的浓度在一定范围内成正比
的浓度在一定范围内成正比
ⅳ.苯酚与 的显色原理:
的显色原理:
提出猜想:猜想1: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想2: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
猜想3: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
进行实验:常温下,用盐酸调节配制得到 分别为a和b的
分别为a和b的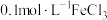 溶液(a>b),用硫酸调节配制得到
溶液(a>b),用硫酸调节配制得到 分别为a和b的
分别为a和b的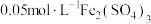 溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含
溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验
的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验 改变对
改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
结果讨论:实验结果为 。
。
(4)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是___________ 。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂: 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体)
③小组同学得出实验结果为: ,
,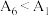 ,由此得出此结论是
,由此得出此结论是___________ 。
④根据实验1~6的结果,小组同学得出猜想3成立,且 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是___________ 。
(Ⅰ)苯酚的制备
工业上用异丙苯氧化法合成苯酚,其生产流程如图:

(1)异丙苯氧化过程①温度不能过高的原因是
(2)检验有机相中是否含有水的试剂是
(3)“操作1”的名称是
(Ⅱ)苯酚的实验探究
探究铁盐种类和
 对苯酚与
对苯酚与 显色反应的影响。
显色反应的影响。查阅资料:ⅰ.
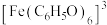 为紫色;
为紫色;ⅱ.
 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;ⅲ.
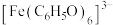 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与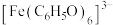 的浓度在一定范围内成正比
的浓度在一定范围内成正比ⅳ.苯酚与
 的显色原理:
的显色原理:
提出猜想:猜想1:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想2:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。猜想3:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。进行实验:常温下,用盐酸调节配制得到
 分别为a和b的
分别为a和b的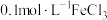 溶液(a>b),用硫酸调节配制得到
溶液(a>b),用硫酸调节配制得到 分别为a和b的
分别为a和b的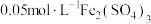 溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含
溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验
的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验 改变对
改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。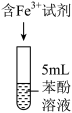 | 序号 | 含 的试剂 的试剂 | 吸光度 | |
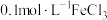 溶液 溶液 | 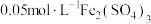 溶液 溶液 | |||
| 1 |  | / |  | |
| 2 |  | / |  | |
| 3 | / |  |  | |
| 4 | / |  |  | |
 。
。(4)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂:
 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体) | 序号 | 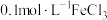 溶液 溶液 | 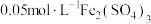 溶液 溶液 | 再加试剂 | 吸光度 |
| 5 | / |  |  固体 固体 | 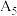 | |
| 6 |  | / | 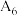 |
 ,
,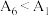 ,由此得出此结论是
,由此得出此结论是④根据实验1~6的结果,小组同学得出猜想3成立,且
 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
您最近一年使用:0次



