 是汽车尾气中的主要污染物,在汽车尾气系统中装配催化转化器,可有效降低
是汽车尾气中的主要污染物,在汽车尾气系统中装配催化转化器,可有效降低 的排放。
的排放。(1)当尾气中空气不足时,
 (以
(以 为主)在催化转化器中被
为主)在催化转化器中被 还原成
还原成 排出。
排出。①基态碳原子中,电子占据最高能级的电子云轮廓图的形状是
②氧的基态原子的轨道表示式为
③C、N、O电负性由大到小顺序为
(2)当尾气中空气过量时,催化转化器中的金属氧化物吸收
 生成盐。其吸收能力顺序如下:
生成盐。其吸收能力顺序如下: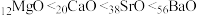 。已知:镁、钙、锶、钡的部分电离能数据如下表所示。
。已知:镁、钙、锶、钡的部分电离能数据如下表所示。| 元素 |  |  |  |  | |
 |  | 738 | 589.7 | 549 | 502.9 |
 | 1451 | 1145 | 1064 | 965.2 | |
 | 7733 | 4910 | a | 3600 | |
 的第三电离能a的范围:
的第三电离能a的范围:②
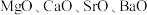 对
对 的吸收能力增强,从原子结构角度解释原因:
的吸收能力增强,从原子结构角度解释原因: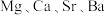 为同主族元素,
为同主族元素, 的吸收能力逐渐增强。
的吸收能力逐渐增强。(3)研究
 作为
作为 脱硝催化剂的性能时发现:在
脱硝催化剂的性能时发现:在 上适当掺杂不同的金属氧化物如
上适当掺杂不同的金属氧化物如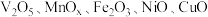 等有利于提高催化脱硝性能。
等有利于提高催化脱硝性能。①基态V原子的核外电子排布式为
②若继续寻找使
 催化性能更好的掺杂金属氧化物,可以在元素周期表
催化性能更好的掺杂金属氧化物,可以在元素周期表A.s B.p C.d D.ds
更新时间:2023-01-06 09:13:01
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】最近一期《物理评论快报》报道了科学家成功制备了包含钙(Ca)、钾(K)、铁(Fe)和砷(As)以及少量镍(Ni)的新型化合物材料[CaK(Fe1-x一Nix)4As4).回答下列问题:
(1)基态镍原子的价层电子排布式为________ ,基态砷原子最高能级的电子云有________ 个伸展方向.
(2)亚铁氰化钾{K4[Fe(CN)6]}是食盐中广泛使用的抗结剂,化学式中涉及的所有元素的第一电离能由小到大的顺序为________ ,[Fe(CN)6]4-中,铁提供的空轨道数目为________ ,气态化合物X与CN一互为等电子体,则X的化学式为________ .
(3)AsCl3分子中砷的杂化类型为________ ;其空间构型为________ 。
(4)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是________ 。
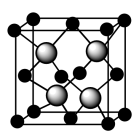
(5)镍和硫形成的某晶体.其晶胞如图所示.已知该晶体密度为dg•cm-3,NA为阿伏加 德罗常数的值。则Ni、S原子最短核间距(D)为________________ cm。
(1)基态镍原子的价层电子排布式为
(2)亚铁氰化钾{K4[Fe(CN)6]}是食盐中广泛使用的抗结剂,化学式中涉及的所有元素的第一电离能由小到大的顺序为
(3)AsCl3分子中砷的杂化类型为
(4)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是
(5)镍和硫形成的某晶体.其晶胞如图所示.已知该晶体密度为dg•cm-3,NA为阿伏加 德罗常数的值。则Ni、S原子最短核间距(D)为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
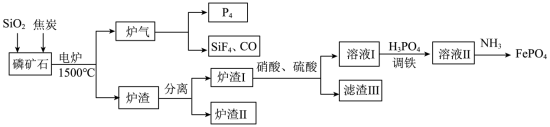
【推荐2】“刀片电池”通过结构创新,大大提升了磷酸铁锂电池的能量密度。以下是以磷矿石(主要成分Ca5(PO4)3F,还有Fe2O3、CaCO3等杂质)为原料生产白磷(P4)同时制得刀片电池正极材料FePO4的工艺流程:
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷(P4)不溶于水但易溶于二硫化碳,说明P4是___________ (填“极性分子”或“非极性分子”)。
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:___________ 。
(3)炉渣Ⅱ的主要成分是___________ 。
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是___________ 。若此条件下Fe3+恰好完全转化为FePO4沉淀(当溶液中某离子浓度≤1×10−5mol/L时,可视为该离子沉淀完全),过滤,现往滤液中加入2mol/L的MgCl2溶液(设溶液体积增加1倍),此时溶液中___________ Mg3(PO4)2沉淀生成(填“有”或“无”或“无法确定”)【已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10−22、1.0×10−24】
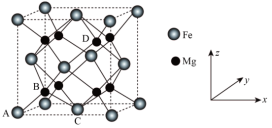
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示: ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为___________ 。此晶胞中Fe的配位数是___________ 。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷(P4)不溶于水但易溶于二硫化碳,说明P4是
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:
(3)炉渣Ⅱ的主要成分是
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示:
 ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁、钴、镍等金属及其化合物有广泛用途。
(1)基态Ni原子共有_______ 种不同能量的电子,其成对电子数与未成对电子数之比是_______ 。
(2)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故 在酸性溶液中常发生如下水解:
在酸性溶液中常发生如下水解: (配离子)
(配离子) 。则配离子中
。则配离子中 的配位数为
的配位数为_______ ,1 mol该配离子所含σ键的数目为_______ 。(设 为阿伏加德罗常数)
为阿伏加德罗常数)
(3) 、
、 常用于陶瓷工业。已知:
常用于陶瓷工业。已知: ,则真空条件下分解温度
,则真空条件下分解温度
_______  (填“高于”“等于”或“低于”);溶液中,
(填“高于”“等于”或“低于”);溶液中, 、
、 、
、 的氧化性依次增强,请从结构上分析,其原因是
的氧化性依次增强,请从结构上分析,其原因是_______ 。
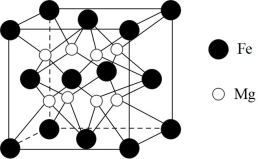
(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。晶体中Fe原子和Mg原子之间的最近距离为a nm。该晶体中一个Mg与之距离最近且等距的Mg原子有_______ 个。储氢时, 分子在晶胞的体心和棱的中点位置,则晶体吸附
分子在晶胞的体心和棱的中点位置,则晶体吸附 后的化学式为
后的化学式为_______ ,理论上1dm3 Fe-Mg最多能储存
_______ kg。
(1)基态Ni原子共有
(2)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故
 在酸性溶液中常发生如下水解:
在酸性溶液中常发生如下水解: (配离子)
(配离子)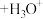 。则配离子中
。则配离子中 的配位数为
的配位数为 为阿伏加德罗常数)
为阿伏加德罗常数)(3)
 、
、 常用于陶瓷工业。已知:
常用于陶瓷工业。已知: ,则真空条件下分解温度
,则真空条件下分解温度
 (填“高于”“等于”或“低于”);溶液中,
(填“高于”“等于”或“低于”);溶液中, 、
、 、
、 的氧化性依次增强,请从结构上分析,其原因是
的氧化性依次增强,请从结构上分析,其原因是(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。晶体中Fe原子和Mg原子之间的最近距离为a nm。该晶体中一个Mg与之距离最近且等距的Mg原子有
 分子在晶胞的体心和棱的中点位置,则晶体吸附
分子在晶胞的体心和棱的中点位置,则晶体吸附 后的化学式为
后的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】硒(34Se)属于氧族元素,是人体必需微量元素之一,含硒化合物在材料和药物等领域具有重要应用。回答下列问题:
(1)基态Se原子价电子排布式是________ 。
(2)由二苯基二硒醚(I)合成含硒化合物IV的化学方程式如图:
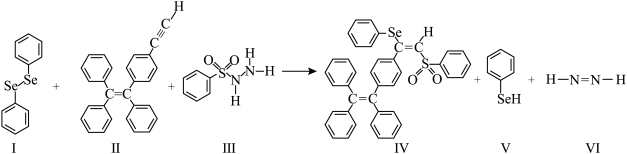
①下列说法不正确 的是________ 。
A.反应物中所有C原子的杂化方式均为sp2
B.能量最低的激发态N原子内层电子排布式为1s22s22p2
C.化合物III(苯磺酰肼)既能与盐酸反应,也能与氢氧化钠溶液反应
D.硒氧组合的微粒中,SeO3分子的键角小于SeO
E.化合物IV的熔点主要取决于所含化学键的键能大小
②化合物VI(N2H2)不稳定,易分解成N2和H2。其不稳定的原因是________ 。
③一定压强下,化合物V(苯硒酚)的沸点低于苯酚的原因是________ 。
(3)通过数学建模利用材料的晶体结构数据可预测其热电性能。下列化合物是潜在热电建模材料,晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
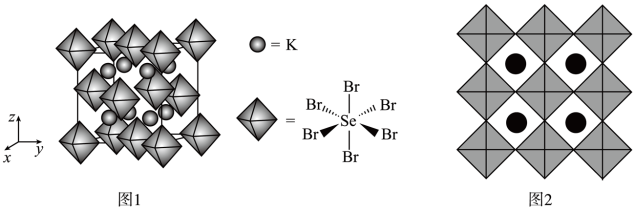
①其化学式为_______ 。
②设该化合物的最简式式量为M1,晶体密度为ρg•cm-3,则该化合物中相邻K之间的最短距离为______ nm(列出计算式,NA为阿伏加德罗常数的值)。
(1)基态Se原子价电子排布式是
(2)由二苯基二硒醚(I)合成含硒化合物IV的化学方程式如图:

①下列说法
A.反应物中所有C原子的杂化方式均为sp2
B.能量最低的激发态N原子内层电子排布式为1s22s22p2
C.化合物III(苯磺酰肼)既能与盐酸反应,也能与氢氧化钠溶液反应
D.硒氧组合的微粒中,SeO3分子的键角小于SeO

E.化合物IV的熔点主要取决于所含化学键的键能大小
②化合物VI(N2H2)不稳定,易分解成N2和H2。其不稳定的原因是
③一定压强下,化合物V(苯硒酚)的沸点低于苯酚的原因是
(3)通过数学建模利用材料的晶体结构数据可预测其热电性能。下列化合物是潜在热电建模材料,晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①其化学式为
②设该化合物的最简式式量为M1,晶体密度为ρg•cm-3,则该化合物中相邻K之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】碳是形成许多有机材料和无机非金属材料的重要组成元素。回答下列问题:
(1)基态碳原子的价电子排布式为_______ 。
(2) 的沸点比
的沸点比 高的主要原因为
高的主要原因为_______ 。
(3)一种半导体材料,由C、N形成类石墨烯平面结构,通过层层堆叠而成,其晶胞结构如图1,晶胞左侧四边形结构如图2。
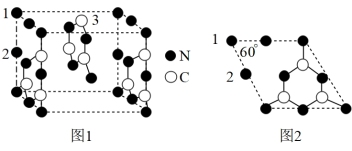
①图1中“3”碳原子不处于晶胞面心的理由为_______ 。
②同一层中“1”氮原子和“2”氮原子配位数之比为_______ 。
③每个“2”氮原子提供_______ 个电子参与形成π键。
④已知该晶胞的体积为Vcm3,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为_______  。
。
(1)基态碳原子的价电子排布式为
(2)
 的沸点比
的沸点比 高的主要原因为
高的主要原因为(3)一种半导体材料,由C、N形成类石墨烯平面结构,通过层层堆叠而成,其晶胞结构如图1,晶胞左侧四边形结构如图2。

①图1中“3”碳原子不处于晶胞面心的理由为
②同一层中“1”氮原子和“2”氮原子配位数之比为
③每个“2”氮原子提供
④已知该晶胞的体积为Vcm3,阿伏加德罗常数的值为
 ,则该晶胞的密度为
,则该晶胞的密度为 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】铜和三氧化二铁在工农业生产中用途广泛。用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
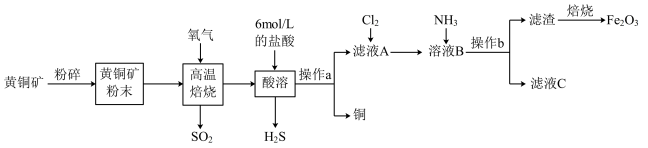
回答下列问题:
(1)铜的价电子排布式____________ 。
(2)高温焙烧时发生的反应是 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子____________ mol。
(3)向滤液A中通入 的目的是
的目的是________________________________________________ 。
(4)向溶液B中通入 后发生反应的离子方程式为
后发生反应的离子方程式为_____________________________________________ 。
(5)工业上用生物法处理 的原理为:(硫杆菌作催化剂)
的原理为:(硫杆菌作催化剂)
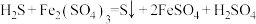
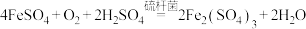
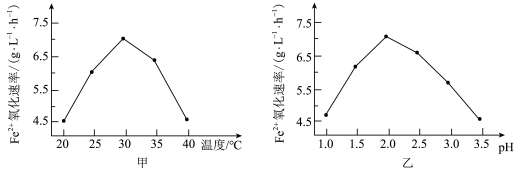
由图甲和图乙判断使用硫杆菌的最佳条件为___________________ 。若反应温度过高,反应速率下降,其原因是_______________________________________________ 。
 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
回答下列问题:
(1)铜的价电子排布式
(2)高温焙烧时发生的反应是
 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子(3)向滤液A中通入
 的目的是
的目的是(4)向溶液B中通入
 后发生反应的离子方程式为
后发生反应的离子方程式为(5)工业上用生物法处理
 的原理为:(硫杆菌作催化剂)
的原理为:(硫杆菌作催化剂)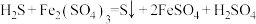
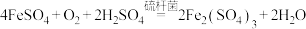
由图甲和图乙判断使用硫杆菌的最佳条件为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铁元素在工业生产中有重要的作用。回答下列问题:
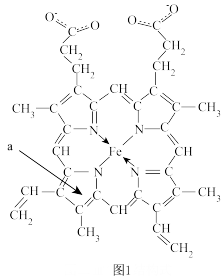
I.血红素(结构如图1)是血红蛋白的活性部位,其中心元素是Fe(II)。
(1)基态 的价电子轨道表示式为:
的价电子轨道表示式为:_______ 。
(2)血红素分子中Fe、N、O三种元素第一电离能由大到小的顺序是_______ (用元素符号表示)。
(3)图1中a环为平面结构,该环大 键可表示为
键可表示为_______ 。(大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数)
键的电子数)
II.铁离子可与EDTA(结构如图2)络合。
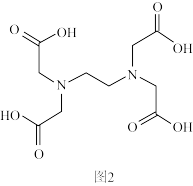
(4)EDTA中C原子杂化类型为_______ 。
(5)已知:一个配位体含有几个能提供孤电子对的原子就叫几齿配位体,则EDTA是_______ 齿配位体(羰炭基中的氧原子不能提供孤对电子)。
III.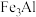 晶体的晶胞结构如图3所示,该晶胞为立方晶胞,其中黑球均在晶胞体内,晶胞参数为apm。
晶体的晶胞结构如图3所示,该晶胞为立方晶胞,其中黑球均在晶胞体内,晶胞参数为apm。
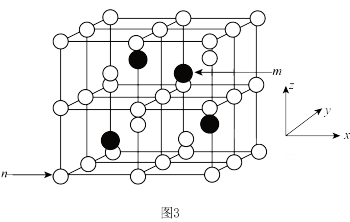
(6)以晶胞参数为单位长度建立坐标系可表示各原子的位置。若n原子分数坐标为 ,则m原子分数坐标为
,则m原子分数坐标为_______ ;若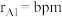 ,
,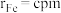 ,则该晶胞的空间利用率为
,则该晶胞的空间利用率为_______ (以含 的代数式表示)。
的代数式表示)。
I.血红素(结构如图1)是血红蛋白的活性部位,其中心元素是Fe(II)。

(1)基态
 的价电子轨道表示式为:
的价电子轨道表示式为:(2)血红素分子中Fe、N、O三种元素第一电离能由大到小的顺序是
(3)图1中a环为平面结构,该环大
 键可表示为
键可表示为 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数)
键的电子数) II.铁离子可与EDTA(结构如图2)络合。

(4)EDTA中C原子杂化类型为
(5)已知:一个配位体含有几个能提供孤电子对的原子就叫几齿配位体,则EDTA是
III.
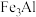 晶体的晶胞结构如图3所示,该晶胞为立方晶胞,其中黑球均在晶胞体内,晶胞参数为apm。
晶体的晶胞结构如图3所示,该晶胞为立方晶胞,其中黑球均在晶胞体内,晶胞参数为apm。
(6)以晶胞参数为单位长度建立坐标系可表示各原子的位置。若n原子分数坐标为
 ,则m原子分数坐标为
,则m原子分数坐标为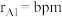 ,
,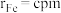 ,则该晶胞的空间利用率为
,则该晶胞的空间利用率为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
【推荐2】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表IB族。Cu2+的价电子排布图为___________ 。
(2)黄铜是人类最早使用的合金之一,主要由Zn 和 Cu组成,元素铜与锌的第二电离能分别为: Icu=1958 k·mol-1、Izn=1733 k·mol-1,二者的第二电离能Icu> Izn的原因是___________ 。
(3)胆矾 CuSO4·5H2O 可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
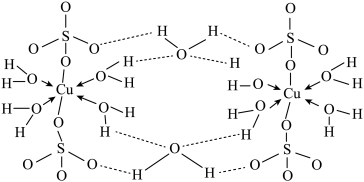
下列说法正确的是___________(填字母)。
(4)已知铜离子可形成配位数为 4 的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到蓝色溶液,写出该反应的离子方程式___________ 。
(5)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl—取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ 。
(1)Cu位于元素周期表IB族。Cu2+的价电子排布图为
(2)黄铜是人类最早使用的合金之一,主要由Zn 和 Cu组成,元素铜与锌的第二电离能分别为: Icu=1958 k·mol-1、Izn=1733 k·mol-1,二者的第二电离能Icu> Izn的原因是
(3)胆矾 CuSO4·5H2O 可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列说法正确的是___________(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(5)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl—取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】N、P、S、 、
、 元素形成的化合物质性质丰富,研究较多。
元素形成的化合物质性质丰富,研究较多。
(1)基态 原子核外电子排布式为
原子核外电子排布式为___________ 。
(2)硫脲(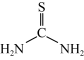 )分子中氮、碳的杂化类型分别为
)分子中氮、碳的杂化类型分别为___________ 、___________ 。
(3)P、S的第二电离能 的大小关系为
的大小关系为
___________ 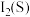 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
(4) 不稳定遇到氧气被氧化成深蓝色的
不稳定遇到氧气被氧化成深蓝色的 ,试回答下列问题:
,试回答下列问题:
① 配位数为
配位数为___________ ,含有 键的数目为
键的数目为___________ 个。
② 的空间结构为
的空间结构为___________ 。
③上述反应可用于检验氨气中的痕量 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(5)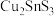 属于立方晶体,如下图所示,
属于立方晶体,如下图所示,
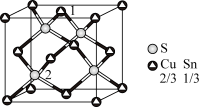
其晶胞参数为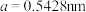 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,S原子填充在
,S原子填充在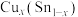 构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为
构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为___________ ,则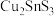 密度为
密度为___________  (列出计算式)。
(列出计算式)。
 、
、 元素形成的化合物质性质丰富,研究较多。
元素形成的化合物质性质丰富,研究较多。(1)基态
 原子核外电子排布式为
原子核外电子排布式为(2)硫脲(
 )分子中氮、碳的杂化类型分别为
)分子中氮、碳的杂化类型分别为(3)P、S的第二电离能
 的大小关系为
的大小关系为
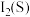 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是(4)
 不稳定遇到氧气被氧化成深蓝色的
不稳定遇到氧气被氧化成深蓝色的 ,试回答下列问题:
,试回答下列问题:①
 配位数为
配位数为 键的数目为
键的数目为②
 的空间结构为
的空间结构为③上述反应可用于检验氨气中的痕量
 ,写出该反应的离子方程式
,写出该反应的离子方程式(5)
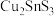 属于立方晶体,如下图所示,
属于立方晶体,如下图所示,
其晶胞参数为
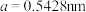 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,S原子填充在
,S原子填充在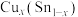 构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为
构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为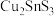 密度为
密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
【推荐1】废旧太阳能电池具有较高的回收利用价值,其主要组成CIGS的化学式可写为CuIn0.5Ga0.5Se2;回答下列问题:
(1)Cu在元素周期表中属于_______ 区,同周期元素基态原子中与其未成对电子数相同的原子还有_______ (写元素名称)。
(2)Ga、In与Al同主族,写出Ga基态原子外围电子排布式_______ 。
(3)Ga、Se与As同周期,推测这三种元素第一电离能由大到小的顺序_______ (用元素符号表示),推测的理由是_______ 。
(4)CIGS中Cu的化合价为_______ ,含有的四种元素中电负性最强的是_______ (写元素名称)。
(1)Cu在元素周期表中属于
(2)Ga、In与Al同主族,写出Ga基态原子外围电子排布式
(3)Ga、Se与As同周期,推测这三种元素第一电离能由大到小的顺序
(4)CIGS中Cu的化合价为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】 是制造芯片的新型半导体材料。回答下列问题:
是制造芯片的新型半导体材料。回答下列问题:
(1)镓为第四周期元素,基态 原子的价层电子轨道表示式为:
原子的价层电子轨道表示式为:_________________________ 。
(2) 的电负性由强到弱的顺序为
的电负性由强到弱的顺序为_________________________ (元素符号表示,下同);
 的第一电离能由大到小的顺序
的第一电离能由大到小的顺序_____________________________ 。
(3)芯片制造中用到光刻胶,可由甲基丙烯酸甲酯(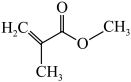 )、马来酸酐(
)、马来酸酐(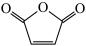 )等通过加聚反应制得。甲基丙烯酸甲酯中碳原子的轨道杂化类型为
)等通过加聚反应制得。甲基丙烯酸甲酯中碳原子的轨道杂化类型为_________________ ,马来酸酐分子中, 键和
键和 键个数比为
键个数比为_________________ 。
(4)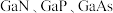 的结构类似于金刚石,熔点如表所示:
的结构类似于金刚石,熔点如表所示:
试分析三者熔点变化的原因:_________________________ 。
(5) 的晶胞结构如图所示(白球是
的晶胞结构如图所示(白球是 ,黑球是
,黑球是 )。
)。
图甲中,与 原子紧邻的
原子紧邻的 原子有
原子有_________ 个,若 晶体密度为
晶体密度为 ,相对分子质量为
,相对分子质量为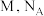 表示阿伏加德罗常数,则晶胞中距离最近的两个
表示阿伏加德罗常数,则晶胞中距离最近的两个 原子间距离为
原子间距离为_____________  。(用含
。(用含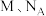 和
和 的代数式表示)
的代数式表示)
 是制造芯片的新型半导体材料。回答下列问题:
是制造芯片的新型半导体材料。回答下列问题:(1)镓为第四周期元素,基态
 原子的价层电子轨道表示式为:
原子的价层电子轨道表示式为:(2)
 的电负性由强到弱的顺序为
的电负性由强到弱的顺序为 的第一电离能由大到小的顺序
的第一电离能由大到小的顺序(3)芯片制造中用到光刻胶,可由甲基丙烯酸甲酯(
 )、马来酸酐(
)、马来酸酐( )等通过加聚反应制得。甲基丙烯酸甲酯中碳原子的轨道杂化类型为
)等通过加聚反应制得。甲基丙烯酸甲酯中碳原子的轨道杂化类型为 键和
键和 键个数比为
键个数比为(4)
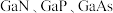 的结构类似于金刚石,熔点如表所示:
的结构类似于金刚石,熔点如表所示:| 物质 |  | 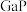 |  |
熔点/ | 1700 | 1480 | 1238 |
(5)
 的晶胞结构如图所示(白球是
的晶胞结构如图所示(白球是 ,黑球是
,黑球是 )。
)。图甲中,与
 原子紧邻的
原子紧邻的 原子有
原子有 晶体密度为
晶体密度为 ,相对分子质量为
,相对分子质量为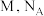 表示阿伏加德罗常数,则晶胞中距离最近的两个
表示阿伏加德罗常数,则晶胞中距离最近的两个 原子间距离为
原子间距离为 。(用含
。(用含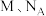 和
和 的代数式表示)
的代数式表示)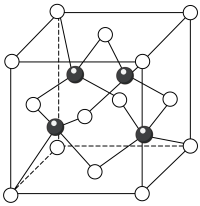
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】1932年美国化学家鲍林首先提出了电负性(用x表示)的概念。表中是某些短周期元素的x值:
(1)表格元素中,第一电离能最小的元素的基态原子电子排布式为____ 。
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。____
(3)第一电离能大小:Mg____ Al(填“大于”“小于”)。
(4)S元素和Cl元素基态原子核外未成对电子数之比为____ 。
(5)某有机化合物结构中含S-N键,其共用电子对偏向____ (写原子名称)。
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是____ 。
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)通过分析x值变化规律,确定N元素x值范围:____<x(N)<____。
(3)第一电离能大小:Mg
(4)S元素和Cl元素基态原子核外未成对电子数之比为
(5)某有机化合物结构中含S-N键,其共用电子对偏向
(6)经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键。试推断AlBr3中化学键类型是
您最近一年使用:0次



