七水合硫酸亚铁 一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为
一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为 、
、 、
、 等)制取
等)制取 ,并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
,并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
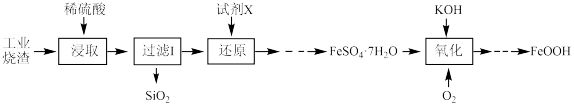
回答下列问题:
(1)为了提高“浸取”速率,可采取的措施有___________ (填写一种)。
(2)试剂X最好选用___________ (填化学式),“还原”时发生反应的离子方程式为___________ 。
(3)“还原”结束至得到产品 ,应进行的操作依次是
,应进行的操作依次是___________ 、___________ 、过滤、洗涤、干燥。
(4)“氧化”过程发生反应的化学方程式___________ 。
(5)色光度是产品质量的指标之一,合格氧化铁黄的色光度值范围为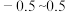 。氧化过程中溶液
。氧化过程中溶液 对产率、色光度的影响如图所示。
对产率、色光度的影响如图所示。

“氧化”时应控制 的范围是
的范围是___________ ;若 过大会导致产品颜色变黑,可能含有的杂质为
过大会导致产品颜色变黑,可能含有的杂质为___________ (填化学式)。
 一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为
一种用途广泛的无机盐,可用于制备氧化铁颜料、媒染剂、净水剂等。一种采用工业烧渣(主要成分为 、
、 、
、 等)制取
等)制取 ,并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
,并利用其制备纳米氧化铁黄颜料的部分流程如图所示:
回答下列问题:
(1)为了提高“浸取”速率,可采取的措施有
(2)试剂X最好选用
(3)“还原”结束至得到产品
 ,应进行的操作依次是
,应进行的操作依次是(4)“氧化”过程发生反应的化学方程式
(5)色光度是产品质量的指标之一,合格氧化铁黄的色光度值范围为
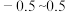 。氧化过程中溶液
。氧化过程中溶液 对产率、色光度的影响如图所示。
对产率、色光度的影响如图所示。
“氧化”时应控制
 的范围是
的范围是 过大会导致产品颜色变黑,可能含有的杂质为
过大会导致产品颜色变黑,可能含有的杂质为
更新时间:2023-01-14 22:52:44
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为___ 。
(2)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因____ 而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是___ 。
(3)KMnO4标准液滴定H2O2的离子方程式为___MnO +___H2O2+___H+=___Mn2++___O2↑+___H2O;
+___H2O2+___H+=___Mn2++___O2↑+___H2O;___ ;当滴定到___ 可以认为已达到滴定终点。
(4)该医生消毒剂中H2O2的物质的量浓度为___ mol·L-1。
(5)②中若用盐酸代替H2SO4测定结果将___ (填“偏高”“偏低”或“无影响”)。
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO
 +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为
(2)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因
(3)KMnO4标准液滴定H2O2的离子方程式为___MnO
 +___H2O2+___H+=___Mn2++___O2↑+___H2O;
+___H2O2+___H+=___Mn2++___O2↑+___H2O;(4)该医生消毒剂中H2O2的物质的量浓度为
(5)②中若用盐酸代替H2SO4测定结果将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】浓硫酸有多种化学性质,如吸水性、脱水性、强氧化性、酸性等。
Ⅰ.甲同学用浓硫酸与木炭的反应探究浓硫酸的强氧化性。已知在加热条件下浓硫酸与木炭可发生化学反应,为了检验反应的产物,某同学用以下装置进行试验。请据此回答下列问题:
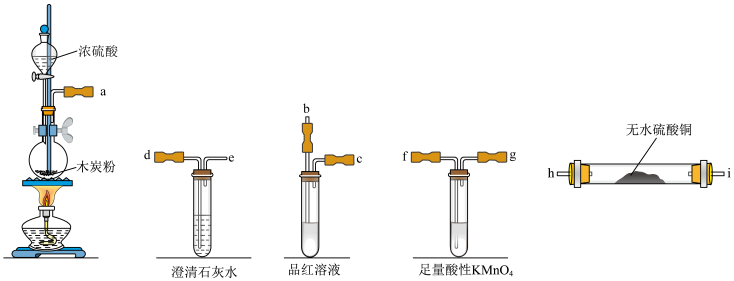
(1)为了完成实验,请将装置的接口按顺序连接(气流方向从左到右):______ 。
(2)实验过程中发现无水硫酸铜固体变为蓝色,品红溶液褪色,由此可知有水和SO2生成,利用氧化还原反应的规律推测还应该有CO2生成,证明有CO2气体生成的实验现象是______ 。
(3)依据上面的结论,写出木炭与浓硫酸反应的化学方程式______ 。
Ⅱ.乙同学用A制备SO2,并进一步制备抗氧化剂Na2S2O5,实验前已除尽装置内的空气。
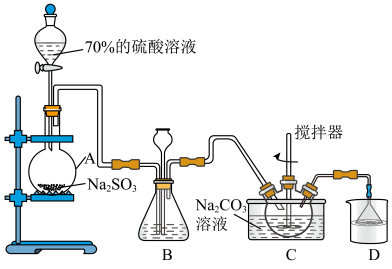
(4)制取二氧化硫选用70%浓硫酸,体现了硫酸的______ 性。
(5)装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用______ 。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
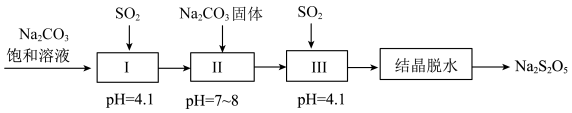
(6)如图流程为焦亚硫酸钠(Na2S2O5)的制备。若步骤Ⅰ中通入足量的SO2,则该步骤反应的离子方程式为_____ 。
Ⅰ.甲同学用浓硫酸与木炭的反应探究浓硫酸的强氧化性。已知在加热条件下浓硫酸与木炭可发生化学反应,为了检验反应的产物,某同学用以下装置进行试验。请据此回答下列问题:

(1)为了完成实验,请将装置的接口按顺序连接(气流方向从左到右):
(2)实验过程中发现无水硫酸铜固体变为蓝色,品红溶液褪色,由此可知有水和SO2生成,利用氧化还原反应的规律推测还应该有CO2生成,证明有CO2气体生成的实验现象是
(3)依据上面的结论,写出木炭与浓硫酸反应的化学方程式
Ⅱ.乙同学用A制备SO2,并进一步制备抗氧化剂Na2S2O5,实验前已除尽装置内的空气。

(4)制取二氧化硫选用70%浓硫酸,体现了硫酸的
(5)装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(6)如图流程为焦亚硫酸钠(Na2S2O5)的制备。若步骤Ⅰ中通入足量的SO2,则该步骤反应的离子方程式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】工业上利用软锰矿浆(主要成分是 ,还含有
,还含有 、FeO、
、FeO、 和NiO等杂质)制备
和NiO等杂质)制备 和单质Mn的工艺流程如下:
和单质Mn的工艺流程如下:

回答下列问题:
(1)滤渣1的主要成分为_______ (填化学式);在一定温度下,提高“还原浸取”速率的方法是_______ 。
(2)“还原浸取”时发生反应的离子方程式为_______ 。
(3)“除铁、镍”时,溶液pH对除 效果的影响如图所示。当
效果的影响如图所示。当 ,pH越小除镍效果越差的原因是
,pH越小除镍效果越差的原因是_______ 。

(4)用惰性电极电解 溶液可以制取金属Mn。
溶液可以制取金属Mn。
①生成金属锰的电极是_______ 极。
②电解时,产生气体的电极反应式为_______ 。
(5)“氧化”时,发生反应的离子方程式为_______ 。
 ,还含有
,还含有 、FeO、
、FeO、 和NiO等杂质)制备
和NiO等杂质)制备 和单质Mn的工艺流程如下:
和单质Mn的工艺流程如下:
回答下列问题:
(1)滤渣1的主要成分为
(2)“还原浸取”时发生反应的离子方程式为
(3)“除铁、镍”时,溶液pH对除
 效果的影响如图所示。当
效果的影响如图所示。当 ,pH越小除镍效果越差的原因是
,pH越小除镍效果越差的原因是
(4)用惰性电极电解
 溶液可以制取金属Mn。
溶液可以制取金属Mn。①生成金属锰的电极是
②电解时,产生气体的电极反应式为
(5)“氧化”时,发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
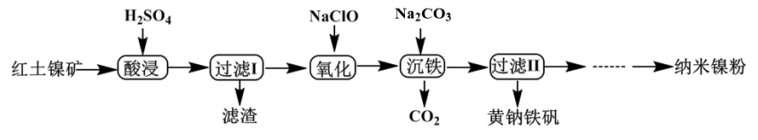
【推荐1】黄钠铁矾[NaFex(SO4)y(OH)6]是一种高效净水剂。一种以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取黄钠铁矾和纳米镍粉的部分工艺流程如图:
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
(1)若NaFex(SO4)y(OH)6中y=2,则黄钠铁矾的化学式为_______ 。
(2)“酸浸”过程,欲提高铁和镍元素的浸出率,可采取的措施为_______ (写出一条即可)。
(3)滤渣的主要成分为_______ 。CO2的电子式为_______ 。
(4)“氧化”过程中ClO-被Fe2+还原,反应中n(ClO-):n(Fe2+)=_______ 。
(5)“沉铁”过程中加入碳酸钠的目的是调节溶液的酸碱度,生成黄钠铁矾。根据上表分析:
①pH不可大于3.7的原因是_______ 。
②常温下,Ksp[Fe(OH)3]=_______ 。
(6)写出“沉铁"过程的化学方程式_______ 。

已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全(离子浓度为1.0×10-5)的pH | 3.7 | 9.7 | 9.2 |
(1)若NaFex(SO4)y(OH)6中y=2,则黄钠铁矾的化学式为
(2)“酸浸”过程,欲提高铁和镍元素的浸出率,可采取的措施为
(3)滤渣的主要成分为
(4)“氧化”过程中ClO-被Fe2+还原,反应中n(ClO-):n(Fe2+)=
(5)“沉铁”过程中加入碳酸钠的目的是调节溶液的酸碱度,生成黄钠铁矾。根据上表分析:
①pH不可大于3.7的原因是
②常温下,Ksp[Fe(OH)3]=
(6)写出“沉铁"过程的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
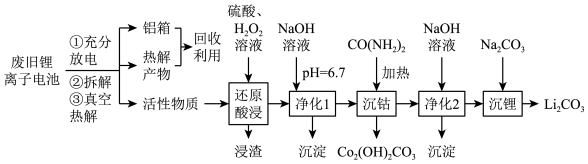
【推荐2】从废旧锂离子电池[含LiCoO2、C6Li(Li嵌入石墨层间)、铝箔、LiPF6电解质和有机溶剂及少量的Cu、Fe、Ni、Zn]中回收钻和锂并制备Co3O4和Li2CO3的一种工艺流程如图:
已知:该工艺条件下,浸取液中含有的五种金属离子开始沉淀和完全沉淀的pH如表:
回答下列问题:
(1)“真空热解”的温度一般选择600℃,没有选择更高温度的主要原因是___ 。
(2)“还原酸浸”中LiCoO2发生反应的化学方程式为____ ;该工艺中只用盐酸也可将LiCoO2还原,该反应的离子方程式为___ 。
(3)“净化1”时调整溶液的pH为6.7,此时得到的沉淀有Cu(OH)2和___ (填化学式)。
(4)“净化2”时,应将溶液的pH调整为___ 。
(5)溶液中c(Li+)=1mol·L-1,为使“沉锂”后溶液中c(Li+)≤0.02mol·L-1,则5L溶液中至少要加Na2CO3固体____ g。[假设溶液体积不变,Ksp(Li2CO3)=8×10-4]

已知:该工艺条件下,浸取液中含有的五种金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe3+ | Co2+ | Cu2+ | Ni2+ | Zn2+ |
| 开始沉淀的pH | 1.9 | 7.6 | 4.2 | 6.7 | 6.5 |
| 完全沉淀的pH | 3.2 | 9.2 | 6.7 | 8.4 | 8.5(pH=10.5时开始溶解) |
(1)“真空热解”的温度一般选择600℃,没有选择更高温度的主要原因是
(2)“还原酸浸”中LiCoO2发生反应的化学方程式为
(3)“净化1”时调整溶液的pH为6.7,此时得到的沉淀有Cu(OH)2和
(4)“净化2”时,应将溶液的pH调整为
(5)溶液中c(Li+)=1mol·L-1,为使“沉锂”后溶液中c(Li+)≤0.02mol·L-1,则5L溶液中至少要加Na2CO3固体
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
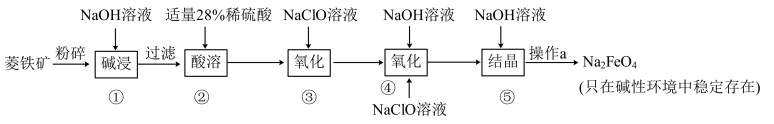
(1)Na2FeO4中铁元素的化合价为___________ ,高铁酸钠用于杀菌消毒时的化学反应类型为___________ (填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还___________ (填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:___________ 。
A.容量瓶B.烧杯C.烧瓶D.玻璃棒E.酸式滴定管
(3)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为___________ ;已知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为___________ 。
(4)理论上,每获得0.5mol的 消耗NaClO的总质量为
消耗NaClO的总质量为___________ 。

(1)Na2FeO4中铁元素的化合价为
(2)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还
A.容量瓶B.烧杯C.烧瓶D.玻璃棒E.酸式滴定管
(3)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为
(4)理论上,每获得0.5mol的
 消耗NaClO的总质量为
消耗NaClO的总质量为
您最近一年使用:0次
【推荐1】海水是巨大的资源宝库。如图是从海水中提取食盐和溴的主要流程。
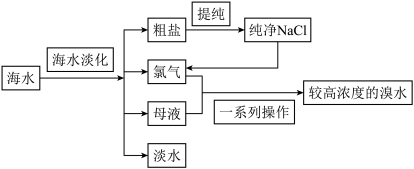
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。
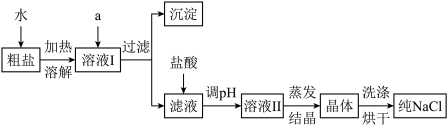
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、b饱和NaCl溶液
①除去溶液1中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、______ 、______ 。
②如何证明操作①中NaOH溶液已经过量?______ 。
③蒸发过程所用的主要仪器有:铁架台、酒精灯、______ 。
(2)工业上将较高浓度的溴水经进一步处理得到工业溴。某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。水的沸点为100℃。他们参观生产过程后,设计了如图装置简图:

①图中仪器B的名称:______ 。
②用热水浴加热的优点是______ 。
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为______ 。

(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、b饱和NaCl溶液
①除去溶液1中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、
②如何证明操作①中NaOH溶液已经过量?
③蒸发过程所用的主要仪器有:铁架台、酒精灯、
(2)工业上将较高浓度的溴水经进一步处理得到工业溴。某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。水的沸点为100℃。他们参观生产过程后,设计了如图装置简图:

①图中仪器B的名称:
②用热水浴加热的优点是
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】以炼锌厂的烟道灰(主要成分为ZnO,另含少量 、CuO、
、CuO、 、MnO等)为原料生产草酸锌晶体(
、MnO等)为原料生产草酸锌晶体( )的工艺流程如图所示:
)的工艺流程如图所示:
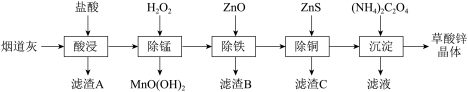
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
请回答下列问题:
(1)滤渣A的主要成分为___________ ,滤渣B的主要成分为___________ 。
(2)除锰过程中产生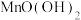 沉淀的离子方程式为
沉淀的离子方程式为___________ 。
(3)①除铁(部分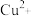 可能被除去)时加入ZnO控制反应液pH的范围为
可能被除去)时加入ZnO控制反应液pH的范围为___________ 。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是___________ 。
(4)沉淀后要获得干燥纯净的草酸锌晶体,需进行的操作是___________ 。
 、CuO、
、CuO、 、MnO等)为原料生产草酸锌晶体(
、MnO等)为原料生产草酸锌晶体( )的工艺流程如图所示:
)的工艺流程如图所示:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为
(2)除锰过程中产生
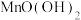 沉淀的离子方程式为
沉淀的离子方程式为(3)①除铁(部分
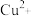 可能被除去)时加入ZnO控制反应液pH的范围为
可能被除去)时加入ZnO控制反应液pH的范围为②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是
(4)沉淀后要获得干燥纯净的草酸锌晶体,需进行的操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某研究性学习小组查阅资料:氯气与硫在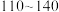 ℃直接化合生成二氯化二硫(
℃直接化合生成二氯化二硫( )。他们利用如下仪器和药品制取纯净的氯气与硫反应来制备
)。他们利用如下仪器和药品制取纯净的氯气与硫反应来制备 。
。
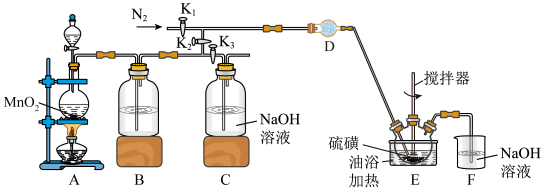
已知:有关物质的部分性质如下表:
回答下列问题:
(1)写出A中发生反应的化学方程式:___________ 。
(2)D中所装试剂为___________ (填化学式)。
(3)实验前向装置中通入 的目的是
的目的是___________ ,反应后向装置中通入 的目的是
的目的是___________ 。
(4)若要清洗附着在烧瓶内壁的硫单质,可以选用___________ 试剂(填字母)。
a. 溶液(浓、热) b.
溶液(浓、热) b. c.酒精 d.
c.酒精 d. (二硫化碳)
(二硫化碳)
(5)若加热温度过高, 粗品中可能混有的杂质是
粗品中可能混有的杂质是___________ (填化学式,填写两种)。
(6)已知 中各原子均满足8电子结构,则分子中含有的共价键类型为
中各原子均满足8电子结构,则分子中含有的共价键类型为___________ 。
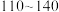 ℃直接化合生成二氯化二硫(
℃直接化合生成二氯化二硫( )。他们利用如下仪器和药品制取纯净的氯气与硫反应来制备
)。他们利用如下仪器和药品制取纯净的氯气与硫反应来制备 。
。
已知:有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
 | 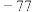 | 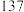 | ①遇水生成 、 、 、 、 ②温度超  以上完全分解生成硫和氯气 以上完全分解生成硫和氯气③ 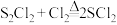 |
(1)写出A中发生反应的化学方程式:
(2)D中所装试剂为
(3)实验前向装置中通入
 的目的是
的目的是 的目的是
的目的是(4)若要清洗附着在烧瓶内壁的硫单质,可以选用
a.
 溶液(浓、热) b.
溶液(浓、热) b. c.酒精 d.
c.酒精 d. (二硫化碳)
(二硫化碳)(5)若加热温度过高,
 粗品中可能混有的杂质是
粗品中可能混有的杂质是(6)已知
 中各原子均满足8电子结构,则分子中含有的共价键类型为
中各原子均满足8电子结构,则分子中含有的共价键类型为
您最近一年使用:0次



