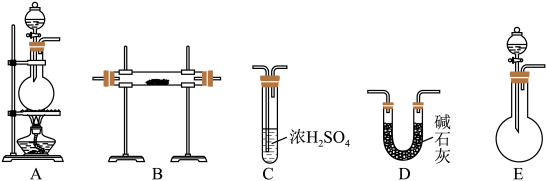
氮元素的化合物种类繁多,利用下图所示装置探究含氮物质间的转化。
实验一段时间后,④中气体颜色无明显变化;⑤中收集到红棕色气体,过一段时间后产生白烟。
回答下列相关问题:
(1)仪器③的名称为_______ 。
(2)④中发生反应的化学方程式为_______ 。
(3)⑤中产生的白烟是_______ (填化学式)。
(4)一段时间后,⑥中溶液变蓝,猜想可能的原因有:a.①中产生的O2在酸性条件下氧化Cu;b._______ (用离子方程式表示)。
(5)为防止含NO、NO2等氮氧化物的尾气污染环境,通常用以下两种方法处理:
方法一:纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:Na2CO3+2NO2=NaNO3+X+CO2↑,X的化学式为_______ 。
方法二:氨转化法。已知6mol氨气恰好能将含NO和NO2共5mol的混合气体完转化为N2,则混合气体中NO和NO2的物质的量之比为_______ 。

实验一段时间后,④中气体颜色无明显变化;⑤中收集到红棕色气体,过一段时间后产生白烟。
回答下列相关问题:
(1)仪器③的名称为
(2)④中发生反应的化学方程式为
(3)⑤中产生的白烟是
(4)一段时间后,⑥中溶液变蓝,猜想可能的原因有:a.①中产生的O2在酸性条件下氧化Cu;b.
(5)为防止含NO、NO2等氮氧化物的尾气污染环境,通常用以下两种方法处理:
方法一:纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:Na2CO3+2NO2=NaNO3+X+CO2↑,X的化学式为
方法二:氨转化法。已知6mol氨气恰好能将含NO和NO2共5mol的混合气体完转化为N2,则混合气体中NO和NO2的物质的量之比为
更新时间:2023-02-10 12:04:16
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:6ZnFe2O4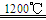 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O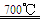 3ZnFe2O4+H2↑
3ZnFe2O4+H2↑
(1)ZnFe2O4中Fe的化合价为_______________ 。
(2)该循环制氢中不断消耗的物质是________ (填化学式),得到H2和O2的质量比为_______________ 。
(3)氢气作为新能源的优点有________ (任写一点)。该循环法制氢的不足之处是________________________________________________ 。
Ⅱ.贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+ 3H2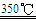 3MgH2+MgCu2
3MgH2+MgCu2
(4)熔炼制备Mg2Cu合金时,通入氩气的目的是_________________ 。
(5)氢化物MgH2与水反应生成一种碱,并释放出H2。其化学反应方程式为___________________________ 。
(6)11.2g Mg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为________ g。
I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:6ZnFe2O4
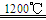 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O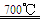 3ZnFe2O4+H2↑
3ZnFe2O4+H2↑(1)ZnFe2O4中Fe的化合价为
(2)该循环制氢中不断消耗的物质是
(3)氢气作为新能源的优点有
Ⅱ.贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+ 3H2
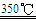 3MgH2+MgCu2
3MgH2+MgCu2(4)熔炼制备Mg2Cu合金时,通入氩气的目的是
(5)氢化物MgH2与水反应生成一种碱,并释放出H2。其化学反应方程式为
(6)11.2g Mg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】纯净干燥的 能与熔融金属锡反应制备
能与熔融金属锡反应制备 ,某化学小组设计了如下实验装置进行制备。
,某化学小组设计了如下实验装置进行制备。
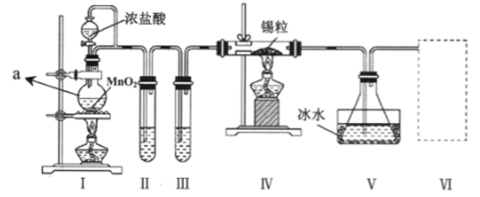
已知:①金属锡的熔点为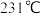 ,化学性质与铁相似;
,化学性质与铁相似;
② 的沸点为
的沸点为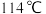 ;
;
③ 易与水反应。
易与水反应。
请回答下列问题。
(1)仪器 的名称为
的名称为___________ 。
(2)装置 中制备
中制备 的离子方程式为
的离子方程式为___________ ;分液漏斗上方的导管的作用是___________ 。
(3)装置 中的试剂为
中的试剂为___________ ,装置 的作用是
的作用是___________ 。
(4)装置 的作用是
的作用是___________ 。
(5)实验开始后要先点燃 处酒精灯,一段时间后再点燃
处酒精灯,一段时间后再点燃 处酒精灯,这样做是为了
处酒精灯,这样做是为了___________
(6)甲同学准备在装置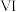 处用
处用 溶液吸收未反应完的
溶液吸收未反应完的 ,在某温度下将
,在某温度下将 通入
通入 溶液中,反位得到
溶液中,反位得到 、
、 、
、 的混合液,经测定
的混合液,经测定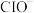 与
与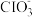 的离子数目之比为
的离子数目之比为 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(7)乙同学准备在装置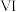 处将未反应完的
处将未反应完的 通入蒸馏水中制备氯水,并用制取的氯水进行一系列实验,下列实验方法、实验现象和实验结论正确的是
通入蒸馏水中制备氯水,并用制取的氯水进行一系列实验,下列实验方法、实验现象和实验结论正确的是___________ (填字母)。
(8)老师看了同学们的设计后,提出吸收多余氯气改用碱石灰更好,原因是___________ 。
 能与熔融金属锡反应制备
能与熔融金属锡反应制备 ,某化学小组设计了如下实验装置进行制备。
,某化学小组设计了如下实验装置进行制备。
已知:①金属锡的熔点为
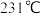 ,化学性质与铁相似;
,化学性质与铁相似;②
 的沸点为
的沸点为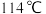 ;
;③
 易与水反应。
易与水反应。请回答下列问题。
(1)仪器
 的名称为
的名称为(2)装置
 中制备
中制备 的离子方程式为
的离子方程式为(3)装置
 中的试剂为
中的试剂为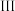 的作用是
的作用是(4)装置
 的作用是
的作用是(5)实验开始后要先点燃
 处酒精灯,一段时间后再点燃
处酒精灯,一段时间后再点燃 处酒精灯,这样做是为了
处酒精灯,这样做是为了(6)甲同学准备在装置
 处用
处用 溶液吸收未反应完的
溶液吸收未反应完的 ,在某温度下将
,在某温度下将 通入
通入 溶液中,反位得到
溶液中,反位得到 、
、 、
、 的混合液,经测定
的混合液,经测定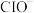 与
与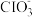 的离子数目之比为
的离子数目之比为 ,写出该反应的化学方程式
,写出该反应的化学方程式(7)乙同学准备在装置
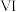 处将未反应完的
处将未反应完的 通入蒸馏水中制备氯水,并用制取的氯水进行一系列实验,下列实验方法、实验现象和实验结论正确的是
通入蒸馏水中制备氯水,并用制取的氯水进行一系列实验,下列实验方法、实验现象和实验结论正确的是| 选项 | 实验方法 | 实验现象 | 实验结论 |
| A | 向氯水中滴加碳酸氢钠溶液 | 有气泡产生 | 氯水中有 |
| B | 将氯水滴在有色布条上 | 有色布条褪色 | 氯水中有 |
| C | 向滴加了酚酞的 溶液 溶液中加入氯水 | 溶液红色褪去 | 一定是氯水中的 的漂白性所致 的漂白性所致 |
| D | 向氯水中滴加石蕊溶液 | 溶液先变红后褪色 |  与指示剂作用速度更快 与指示剂作用速度更快 |
| E | 氯水经过光照 | 颜色变浅,且有气泡产生,酸性增强 | 温度升高, 的溶解性变 的溶解性变小而逸出 |
您最近一年使用:0次
【推荐3】电子工业常用过量的 FeCl3 溶液腐蚀绝缘板上的铜箔来制造电路板。利用腐蚀废液 可制铁红,过程如图:
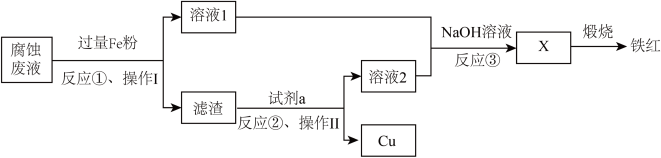
(1)反应①的离子方程式有___________ 。
(2)试剂 a 可以是___________。
(3)操作Ⅱ为___________ 。
(4)检验溶液 1 中是否含有 Fe3+ 的试剂是___________ 。
(5)经检验铁红中有 Fe3O4,取 100 g 产品,用足量稀硫酸溶解,逐滴加入 0.100 mol·L-1高锰酸钾溶液 40.0 mL 至恰好反应完全,反应的离子方程式为___________ , 则 Fe3O4 的物质的量为___________ mol。

(1)反应①的离子方程式有
(2)试剂 a 可以是___________。
| A.HCl | B.H2SO4 | C.KOH 溶液 | D.Na2CO3 溶液 |
(3)操作Ⅱ为
(4)检验溶液 1 中是否含有 Fe3+ 的试剂是
(5)经检验铁红中有 Fe3O4,取 100 g 产品,用足量稀硫酸溶解,逐滴加入 0.100 mol·L-1高锰酸钾溶液 40.0 mL 至恰好反应完全,反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某学生利用以下装置探究氯气与氨气之间的反应。其中C为纯净干燥的氯气与氨气反应的装置。
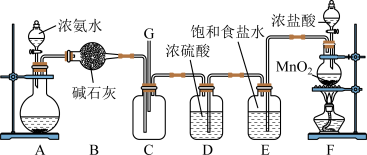
请回答下列问题:
(1)装置A中的烧瓶内固体不能选用___________
(2)装置A中发生反应的化学方程式为___________
(3)B装置的作用___________ ;E装置的作用___________
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一、写出反应的化学方程式:___________
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,需要处理,___________ ,写出离子方程式___________
(6)实验室制备氨气,下列方法中适宜选用的是___________ 。
①固态氯化铵加热分解 ②浓氨水中加入固体氢氧化钠
③加热浓氨水 ④固态氯化铵与氢氧化钙混合加热

请回答下列问题:
(1)装置A中的烧瓶内固体不能选用___________
| A.生石灰 | B.碱石灰 | C.五氧化二磷 | D.烧碱 |
(3)B装置的作用
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一、写出反应的化学方程式:
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,需要处理,
(6)实验室制备氨气,下列方法中适宜选用的是
①固态氯化铵加热分解 ②浓氨水中加入固体氢氧化钠
③加热浓氨水 ④固态氯化铵与氢氧化钙混合加热
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某课外小组在实验室制备氨气,并进行有关氮气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取并收集干燥的氨气。

①应该选用的仪器及装置有(填字母)___________ 。
②生石灰与氯化铵反应生成氨气的化学方程式为___________ 。
(2)该小组同学设计如图所示装置探究氨气的还原性。
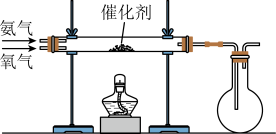
将催化剂加热至红热,撤去酒精灯,可观察到催化剂继续保持红热,有红棕色气体产生及少量白烟生成,在上述过程会同时发生多个反应,根据现象判断氨气的催化氧化为___________ (放热或吸热)反应,白烟的化学式为___________ 。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。合适的方案是___________ (填“甲”或“乙”);
②检验产物中有 的方法为
的方法为___________ 。
(1)该小组同学加热生石灰与氯化铵的混合物制取并收集干燥的氨气。

①应该选用的仪器及装置有(填字母)
②生石灰与氯化铵反应生成氨气的化学方程式为
(2)该小组同学设计如图所示装置探究氨气的还原性。

将催化剂加热至红热,撤去酒精灯,可观察到催化剂继续保持红热,有红棕色气体产生及少量白烟生成,在上述过程会同时发生多个反应,根据现象判断氨气的催化氧化为
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。合适的方案是
②检验产物中有
 的方法为
的方法为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X为短周期元素,A为该元素的简单氢化物,D为该元素的最高价含氧酸且为强酸。根据如图所示转化关系(反应条件及部分产物已略去),回答下列问题。

(1)若液态A可作制冷剂。C的化学式为_______ ,写出①的化学反应方程式:_______ ,反应③中还原剂与氧化剂的质量之比为_______ 。
(2)实验室制取A的化学方程式:_______ 。
(3)若A的摩尔质量为34g/mol。A的电子式为_______ ,D的浓溶液与蔗糖的实验现象说明其具有_______ 性质。

(1)若液态A可作制冷剂。C的化学式为
(2)实验室制取A的化学方程式:
(3)若A的摩尔质量为34g/mol。A的电子式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置A中的烧瓶内固体可选用__ (填字母)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从表格中的备选装置中选择,并将编号填入下列空格:B__ ,D__ ,E__ 。
(3)通入C装置的两根导管左边较长、右边较短,目的是__ 。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__ ;其中氧化剂与还原剂的物质的量之比为__ ;当amol氯气参加反应时,转移的电子总数为b个,则阿伏加 德罗常数为__ mol-1(用含a、b的代数式表示)。
(5)从装置C的出气管口G处逸出的尾气可能含有污染环境的气体,如何处理?_ 。

请回答下列问题:
(1)装置A中的烧瓶内固体可选用
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从表格中的备选装置中选择,并将编号填入下列空格:B
(3)通入C装置的两根导管左边较长、右边较短,目的是
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:
(5)从装置C的出气管口G处逸出的尾气可能含有污染环境的气体,如何处理?
您最近一年使用:0次
【推荐3】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
I.氨气的制备
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。___________ ;B中圆底烧瓶收集氨气时,请你选择氨气的进气口___________ (填“a”或“b”)。
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是___________ ;你认为引发喷泉的操作应是___________ 。
(3)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是___________ (填序号)。
(4)铜和浓硝酸产生NO2的化学方程式是___________ 。
(5)将I中收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(4)中产生的NO2(两端用夹子K1、K2夹好)。___________ ;反应的化学方程式___________ 。
(6)若有NO2和NH3的混合物1mol,充分反应。反应后所得到产物中,经氧化得到的N2比经还原得到的N2多1.4g,则反应混合物中NO2与NH3的体积比是___________
I.氨气的制备
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。
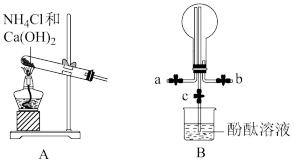
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是
(3)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是
① ②
② ③
③ ④
④
(4)铜和浓硝酸产生NO2的化学方程式是
(5)将I中收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(4)中产生的NO2(两端用夹子K1、K2夹好)。
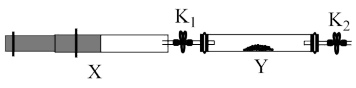
(6)若有NO2和NH3的混合物1mol,充分反应。反应后所得到产物中,经氧化得到的N2比经还原得到的N2多1.4g,则反应混合物中NO2与NH3的体积比是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO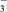 、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是____ 和______ 。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体(无气体生成),则C为___ 。(填名称)
(3)将38.4g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D为_________ (化学式),写出Cu溶解的离子方程式_______ ,若要将Cu完全溶解,至少加入H2SO4的物质的量是_________ 。
(4)足量E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的化学方程式为__________ 。
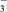 、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体(无气体生成),则C为
(3)将38.4g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D为
(4)足量E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________________ ;得到滤渣1的主要成分为______ (写化学式)。
(2)第②步加H2O2的作用是______________________ (用离子方程式表示);使用H2O2的优点是____________ ;调溶液pH的目的是使____________ 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________ 。

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为
(2)第②步加H2O2的作用是
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物( 反应时加入或生成的水,以及生成沉淀J时的其它产物均已略去)。

已知:2NaCl+2H2O 2NaOH+Cl2↑+H2↑ F是常见的金属单质
2NaOH+Cl2↑+H2↑ F是常见的金属单质
请填写下列空白:
(1)B中元素在周期表中的位置是_____ ;H的电子式是_____ ;J是_____ ;(用化学式作答)
(2)反应②的方程式是________________________ ;现象是:___________________________ 。
(3)E是一种二元化合物,请用电子式表示其形成过程______________________________ 。

已知:2NaCl+2H2O
 2NaOH+Cl2↑+H2↑ F是常见的金属单质
2NaOH+Cl2↑+H2↑ F是常见的金属单质请填写下列空白:
(1)B中元素在周期表中的位置是
(2)反应②的方程式是
(3)E是一种二元化合物,请用电子式表示其形成过程
您最近一年使用:0次