金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+172kJ•mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2=-51kJ•mol-1,Kp2=1.2×1012Pa
①对于直接氯化反应:增大压强,平衡______ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率______ (填“变大”“变小”或“不变”)。
②直接氯化的反应趋势远小于碳氯化,其原因是______ 。
(2)在1.0×105Pa,将TiO2、C、Cl2按物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
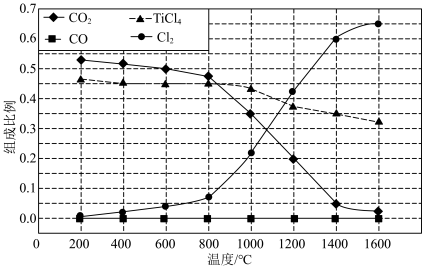
①反应 C(s)+
C(s)+ CO2(g)
CO2(g) CO(g)的平衡常数Kp(1400℃)=
CO(g)的平衡常数Kp(1400℃)=______ Pa(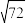 ≈8.5)。
≈8.5)。
②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是______ 。
(3)TiO2直接氯化和碳氯化都属于“气—固”反应,工业生产中有利于“气—固”充分接触的措施是______ 。
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+172kJ•mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2=-51kJ•mol-1,Kp2=1.2×1012Pa
①对于直接氯化反应:增大压强,平衡
②直接氯化的反应趋势远小于碳氯化,其原因是
(2)在1.0×105Pa,将TiO2、C、Cl2按物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①反应
 C(s)+
C(s)+ CO2(g)
CO2(g) CO(g)的平衡常数Kp(1400℃)=
CO(g)的平衡常数Kp(1400℃)=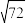 ≈8.5)。
≈8.5)。②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
(3)TiO2直接氯化和碳氯化都属于“气—固”反应,工业生产中有利于“气—固”充分接触的措施是
更新时间:2023/05/10 17:29:41
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】高温下N2和O2发生反应N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
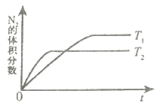
(1)下图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g) 2NO(g)为
2NO(g)为_______ (填“吸热”或“放热”)反应。
(2)2000℃时向容积为2L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则此反应的平衡常数K=____ 。该温度下,若开始时向上述容器中充入N2和O2均为1mol,则达到平衡后N2的转化率为______ 。
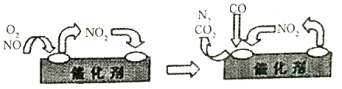
(3)汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出其变化的总化学反应方程式:__________ 。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氢氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若16gCH4还原NO2至N2共放出热量867kJ,则△H2=_______ 。
 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。(1)下图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g)
 2NO(g)为
2NO(g)为
(2)2000℃时向容积为2L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则此反应的平衡常数K=
(3)汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出其变化的总化学反应方程式:

(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氢氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若16gCH4还原NO2至N2共放出热量867kJ,则△H2=
您最近一年使用:0次
【推荐2】回答下列问题:
(1)在密闭容器中,加热一氧化碳和水蒸气的气体混合物,在催化剂存在下发生反应: ,500℃时,平衡常数
,500℃时,平衡常数 。若反应开始时,一氧化碳和水蒸气的浓度都是0.2mol/L,则平衡时CO的体积分数为
。若反应开始时,一氧化碳和水蒸气的浓度都是0.2mol/L,则平衡时CO的体积分数为_______ 。
(2)在恒温恒压的密闭容器中,按照n(A):n(B)=1:4投料,发生如下反应①和②
①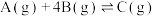 ;②
;②
总压为 ,A的转化率为a,C的分压为P,则反应①的
,A的转化率为a,C的分压为P,则反应①的
_______ (列出算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生反应 并达到平衡状态,若保持容器容积不变再通入一定量的Z,则平衡如何移动
并达到平衡状态,若保持容器容积不变再通入一定量的Z,则平衡如何移动_______ (填“正移”“逆移”或“不移”);达新平衡后,X的体积分数如何变化_______ (填“增大”“减小”或“不变”)。
(1)在密闭容器中,加热一氧化碳和水蒸气的气体混合物,在催化剂存在下发生反应:
 ,500℃时,平衡常数
,500℃时,平衡常数 。若反应开始时,一氧化碳和水蒸气的浓度都是0.2mol/L,则平衡时CO的体积分数为
。若反应开始时,一氧化碳和水蒸气的浓度都是0.2mol/L,则平衡时CO的体积分数为(2)在恒温恒压的密闭容器中,按照n(A):n(B)=1:4投料,发生如下反应①和②
①
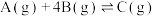 ;②
;②
总压为
 ,A的转化率为a,C的分压为P,则反应①的
,A的转化率为a,C的分压为P,则反应①的
(3)将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生反应
 并达到平衡状态,若保持容器容积不变再通入一定量的Z,则平衡如何移动
并达到平衡状态,若保持容器容积不变再通入一定量的Z,则平衡如何移动
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应: PCl5(g)  Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
(1)能表明该反应达到平衡状态的是________ (填序号);
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为____ ;该反应的平衡常数K= ___ 。
(3)反应在前50 s内的平均速率为v(PCl3)=_____ 。
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11mol·L-l,则正反应的ΔH__ 0(填“>”或“<”)。
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正)__ v(逆)(填“>”或“<”)
 Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:| 反应时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为
(3)反应在前50 s内的平均速率为v(PCl3)=
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11mol·L-l,则正反应的ΔH
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知可逆反应:M(g)+N(g) P(g)+Q(g) ΔH>0。请回答下列问题:
P(g)+Q(g) ΔH>0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为________ ;该温度时的平衡常数K=________ 。
(2)若反应温度升高,则M的转化率________ (填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1,达到平衡后,c(P)=2 mol·L-1,则a=________ 。
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为________ 。
 P(g)+Q(g) ΔH>0。请回答下列问题:
P(g)+Q(g) ΔH>0。请回答下列问题:(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为
(2)若反应温度升高,则M的转化率
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1,达到平衡后,c(P)=2 mol·L-1,则a=
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】合成氨是人类科学技术发展史上的一项重大突破,诺贝尔化学奖曾三次授予与合成氨有关的研究。以下是关于合成氨的有关问题,请回答:
 N2(g)+
N2(g)+  H2(g)
H2(g)  NH3(g) ΔH(298K)= -46.2kJ· mol-l
NH3(g) ΔH(298K)= -46.2kJ· mol-l
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附: N2(g) →2N*; H2(g)→2H*;
表面反应: N*+ H* NH*; NH*+ H*
NH*; NH*+ H* NH2*; NH2* + H*
NH2*; NH2* + H* NH3*
NH3*
脱附: NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率小,决定了合成氨的整体反应速率。
(1)平衡后,若想提高H2的转化率,可以采取的措施有 _______。
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应: N2(g) + 3H2(g)  2NH3(g) ΔH = - 92.4kJ·mol-1, 请完成下列问题:
2NH3(g) ΔH = - 92.4kJ·mol-1, 请完成下列问题:
①试比较K1、K2的大小,K1_______ K2 (填“>”、“<”或“=”)
②400℃时,反应2NH3(g) N2(g) + 3H2(g)的化学平衡常数为
N2(g) + 3H2(g)的化学平衡常数为_______ 。当NH3、N2和H2的物质的量分别为2mol、a mol和1mol时,v(N2)正=v(N2)逆。a=_______ 。
(3)关于合成氨工艺的理解,正确的是_______
(4)实际生产中,常用工艺条件: Fe 作催化剂,控制温度500℃,压强3.0×105Pa,原料中N2和H2物质的量之比为1:2.8。分析说明原料气中N2过量的理由有哪些? _______
 N2(g)+
N2(g)+  H2(g)
H2(g)  NH3(g) ΔH(298K)= -46.2kJ· mol-l
NH3(g) ΔH(298K)= -46.2kJ· mol-l在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附: N2(g) →2N*; H2(g)→2H*;
表面反应: N*+ H*
 NH*; NH*+ H*
NH*; NH*+ H* NH2*; NH2* + H*
NH2*; NH2* + H* NH3*
NH3*脱附: NH3*
 NH3(g)
NH3(g)其中,N2的吸附分解反应活化能高、速率小,决定了合成氨的整体反应速率。
(1)平衡后,若想提高H2的转化率,可以采取的措施有 _______。
| A.加入催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
 2NH3(g) ΔH = - 92.4kJ·mol-1, 请完成下列问题:
2NH3(g) ΔH = - 92.4kJ·mol-1, 请完成下列问题:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,反应2NH3(g)
 N2(g) + 3H2(g)的化学平衡常数为
N2(g) + 3H2(g)的化学平衡常数为(3)关于合成氨工艺的理解,正确的是_______
| A.控制温度(500℃) 远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率 |
| B.当温度压强一定时,在原料气(N2 和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率 |
| C.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,利于反应正向进行 |
| D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气需经过净化处理,以防止催化剂中毒和安全事故发生 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】一定温度下,在甲、乙、丙三个体积均为1L的恒容密闭容器中发生由甲醇合成二甲醚的反应2CH3OH(g) CH3OCH3(g)+H2O(g),起始投料只有甲醇。相关数据如表所示:
CH3OCH3(g)+H2O(g),起始投料只有甲醇。相关数据如表所示:
(1)反应开始时,____ (填“甲”、“乙”或“丙”)容器中反应速率最快。
(2)由甲醇合成二甲醚的反应为____ (填“吸热”或“放热”)反应,反应类型为____ 。(填“取代”、“加成”或“氧化”)
(3)387℃时,该反应的化学平衡常数K=____ 。
(4)平衡时,乙容器中的CH3OH(g)转化率为____ 。
 CH3OCH3(g)+H2O(g),起始投料只有甲醇。相关数据如表所示:
CH3OCH3(g)+H2O(g),起始投料只有甲醇。相关数据如表所示:| 容器编号 | 温度/℃ | 起始 | 平衡 | |
| n[CH3OH(g)]/mol | n[CH3OCH3(g)]/mol | n[H2O(g)]/mol | ||
| 甲 | 387 | 0.20 | 0.080 | 0.080 |
| 乙 | 387 | 0.40 | ||
| 丙 | 207 | 0.20 | 0.090 | 0.090 |
(1)反应开始时,
(2)由甲醇合成二甲醚的反应为
(3)387℃时,该反应的化学平衡常数K=
(4)平衡时,乙容器中的CH3OH(g)转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】已知该产业链中,有炭参与的某反应平衡常数表达式为:K=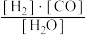 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:________ ,若该反应只有在持续高温下才能自发进行,则该反应为________ (“吸热”或“放热”)反应。
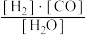 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应: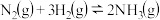 ∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=
∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=_______ 。平衡时H2的转化率为_______ %。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应: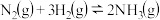 ∆H<0,其化学平衡常数K与温度T的关系如表所示:
∆H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①写出化学平衡常数K的表达式_______ 。
②试比较K1、K2的大小,K1_______ K2(填“>”、“<”或“=”);
③400℃时,反应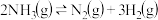 的化学平衡常数为
的化学平衡常数为_______ 。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正_______ v(N2)逆(填“>”、“<”或“=”)。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
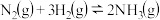 ∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=
∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
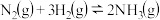 ∆H<0,其化学平衡常数K与温度T的关系如表所示:
∆H<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①写出化学平衡常数K的表达式
②试比较K1、K2的大小,K1
③400℃时,反应
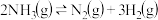 的化学平衡常数为
的化学平衡常数为
您最近一年使用:0次



