元素周期表中前20号元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,X的简单离子半径在同周期元素中最小,由这四种元素组成一种化合物Q,在Q的溶液中滴加Ba(OH)2溶液,产生沉淀的物质的量与Ba(OH)2的物质的量的关系如图所示,下列说法正确的是

| A.简单离子半径:Z>Y |
| B.简单气态氯化物的热稳定性:Y>R |
| C.Q的水溶液显酸性、可作为净水剂 |
| D.M点沉淀物有2种,且物质的量之比为4:1 |
2023·江西南昌·二模 查看更多[5]
(已下线)通关练06 元素位-构-性推断-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)考点巩固卷05 物质结构 元素周期律(2大考点50题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题07 元素周期表与元素周期律江西省南昌市2023届高三下学期二模考试理科综合化学试题
更新时间:2023-05-06 12:04:50
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下表是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数。下列说法正确的是
| 化学式 | HCN | CH3COOH | H2CO3 | AgCl | Ag2CrO4 |
| Ka或Ksp | Ka=4.9×10-10 | Ka=1.75×10-5 | Ka1=4.5×10-7,Ka2=4.7×10-11 | Ksp=1.8×10-10 | Ksp=2.0×10-12 |
A.常温下,相同浓度的①CH3COONH4、②NH4HCO3、③NH4HSO4溶液中,c(NH )由大到小的顺序是①>②>③ )由大到小的顺序是①>②>③ |
B.25℃时,等物质的量浓度的各溶液pH关系为:pH(CH3COOH )> pH(H2CO3 )>pH( ) ) |
| C.相同物质的量浓度的CH3COONa和NaCN的混合溶液中,各离子浓度大小关系为:c(Na+)>c( CH3COO-)>c(CN-)>c(OH-) >c(H+) |
D.向浓度均为1×10-3 mol·L-1的KCl和K2CrO4的混合溶液中滴加1×10-3 mol·L-1的AgNO3溶液, 先形成沉淀 先形成沉淀 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】用 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.常温下, 的 的 溶液中,由水电离出的 溶液中,由水电离出的 的数目为 的数目为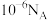 |
B.常温下, 溶液中,所含 溶液中,所含 总数为 总数为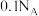 |
C.电解精炼铜时,若阳极质量减少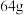 ,则电路中转移电子的数目一定为 ,则电路中转移电子的数目一定为 |
D.标准状况下 与 与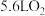 混合后气体的分子总数为 混合后气体的分子总数为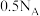 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是
| A.砷在通常状况下为固体 |
| B.砷的最高正化合价为+5 |
| C.砷的最高价氧化物的水化物砷(H3AsO4)的酸性比磷酸(H3PO4)强 |
| D.砷化氢(AsH3)不如氨气(NH3)稳定 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】能证明硫元素的非金属性弱于氯元素的事实是( )
| A.通常情况下硫为浅黄色固体,而氯气为黄绿色的气体 |
| B.硫不溶于水而氯气溶于水 |
C.跟金属或氢气反应时,硫被还原为 价,而氯被还原为 价,而氯被还原为 价 价 |
| D.跟Cu或Fe反应时,金属被硫氧化成低价态,而被氯气氧化成高价态 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】短周期主族元素X、Y、Z、W原子序数依次增大;X是地壳中含量最多的元素;Y原子最外层只有一个电子;Z位于元素周期表ⅣA族;W与X属于同一主族。下列说法正确的是
| A.原子半径:W>Z>Y |
| B.由X、Y组成的化合物中均不含共价键 |
| C.Z的单质可用于生产光导纤维 |
| D.X最简单气态氢化物的热稳定性比W的气态氢化物的热稳定性强 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】如图所示,化合物A是一种新型超分子晶体材料,其中X、Y、Z、W为原子序数依次增大的短周期元素,M与W位于同一主族,M的单质在常温下为液体,下列说法正确的是


| A.基态Y原子核外电子有7种空间运动状态 |
| B.电负性: Z<M<W |
| C.最高价氧化物对应水化物的酸性: W>Y |
| D.该化合物的阳离子中, Z和X之间以极性共价键结合 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】短周期主族元素X、Y、Z、W原子序数依次增大,X、W同主族,Y+与X2-具有相同的电子层结构,Z原子的最外层电子数等于X原子最外层电子数的一半,则下列叙述正确的是( )
| A.Y2X2中阴阳离子的个数比为1:1 |
| B.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| C.X和W形成的常见化合物WX2为直线型分子 |
| D.Y、Z的最高价氧化物的水化物之间能发生反应 |
您最近一年使用:0次

 溶液中:
溶液中:
 溶液中:
溶液中:


 ,其中X、Y、Z与氢元素形成的简单氢化物中均含10电子。下列叙述中错误的是
,其中X、Y、Z与氢元素形成的简单氢化物中均含10电子。下列叙述中错误的是

