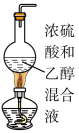
下列实验操作正确且能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 由 制备无水 制备无水 | 将 在HCl气流中加热 在HCl气流中加热 |
| B | 除去 中的 中的 气体 气体 | 依次通过盛有酸性 溶液和浓硫酸的洗气瓶 溶液和浓硫酸的洗气瓶 |
| C | 比较HClO和 的酸性强弱 的酸性强弱 | 室温下,用pH试纸测定同浓度的HClO和 溶液的pH 溶液的pH |
| D | 检验铝热反应(Al和 )反应后固体中是否含 )反应后固体中是否含 | 取反应后固体,溶于足量稀硫酸,滴加KSCN溶液,溶液不变红,说明不含 |
| A.A | B.B | C.C | D.D |
更新时间:2023-06-26 21:28:29
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】一定温度下,下列溶液的离子浓度关系式正确的是
| A.pH=5的H2S溶液中,c(H+)=c(HS—)=1×10-5mol·L-1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ |
D.某酸H2A在水溶液中存在H2A=H++HA—和HA— H++A2—,则只有溶质NaHA的水溶液中可能存在c(Na+)>c(HA—)>c(OH—)>c(H+) H++A2—,则只有溶质NaHA的水溶液中可能存在c(Na+)>c(HA—)>c(OH—)>c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列有关电解质溶液的说法正确的是
| A.保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 |
| B.将Na2CO3、Na2SO3、FeCl3溶液蒸干均得不到原溶质 |
| C.室温下,将pH=a的某一元酸HA加水稀释10倍后,新的pH<a+1,则HA为弱酸 |
| D.室温下,NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.23 g C2H6O中C-O数目一定为0.5NA |
B.1 L0.5 mol/L的(NH4)2溶液中 数目为NA 数目为NA |
| C.46 gNO2被NaOH完全吸收,转移电子数目为0.5NA |
| D.22.4 LCO和CO2的混合气体中碳原子数为NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列盐溶液呈中性的是
A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,用1 L 1 mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是

| A.当吸收液呈中性时:c( Na+ ) = c( HSO3-) + 2c(SO32-) |
| B.M 点时溶液中:c(SO32-)>c(HSO3-) |
| C.Na2SO3溶液中:c(Na+)>32-)>c(HSO3-)> c(OH-)>c(H+) |
| D.向N点的吸收液中加水可使溶液的pH由6. 2升高到7. 4 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列关于物质的制备、鉴别与除杂的说法正确的是
| A.乙烷中混有少量乙烯:通入氢气在一定条件下反应,使乙烯转化为乙烷 |
| B.只用溴水就能将苯、己烯、四氯化碳、淀粉碘化钾溶液区分开 |
| C.氯气与甲烷按照比例 2:1 在光照条件下反应制备纯净的二氯甲烷 |
| D.苯与溴水混合后加入 FeBr3,发生放热反应,制备密度大于水的溴苯 |
您最近一年使用:0次
单选题
|
适中
(0.65)
真题
名校
【推荐2】下列过程没有发生化学反应的是
| A.用活性炭去除冰箱中的异味 |
| B.用热碱水清除炊具上残留的油污 |
| C.用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D.用含硅胶、铁粉的透气小袋与食品一起密封包装 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】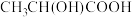 能与水混溶,且不易挥发。实验室用如下图所示的装置制备
能与水混溶,且不易挥发。实验室用如下图所示的装置制备 晶体:先用氢气排尽装置中的空气,再将A中的液体加入B中,然后滴加
晶体:先用氢气排尽装置中的空气,再将A中的液体加入B中,然后滴加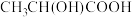 溶液,反应后向三颈烧瓶中加入乙醇,再过滤、洗涤和干燥,即可得到
溶液,反应后向三颈烧瓶中加入乙醇,再过滤、洗涤和干燥,即可得到 晶体。下列说法正确的是
晶体。下列说法正确的是
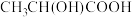 能与水混溶,且不易挥发。实验室用如下图所示的装置制备
能与水混溶,且不易挥发。实验室用如下图所示的装置制备 晶体:先用氢气排尽装置中的空气,再将A中的液体加入B中,然后滴加
晶体:先用氢气排尽装置中的空气,再将A中的液体加入B中,然后滴加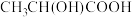 溶液,反应后向三颈烧瓶中加入乙醇,再过滤、洗涤和干燥,即可得到
溶液,反应后向三颈烧瓶中加入乙醇,再过滤、洗涤和干燥,即可得到 晶体。下列说法正确的是
晶体。下列说法正确的是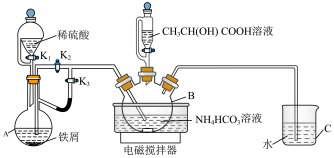
A.关闭 ,打开 ,打开 、 、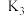 ,向盛有铁屑的圆底烧瓶中滴加稀硫酸生成硫酸亚铁,并用生成的 ,向盛有铁屑的圆底烧瓶中滴加稀硫酸生成硫酸亚铁,并用生成的 排尽装置中的空气 排尽装置中的空气 |
B.B中发生反应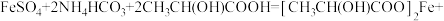  |
C.盛有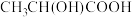 溶液的恒压滴液漏斗可以用分液漏斗代替 溶液的恒压滴液漏斗可以用分液漏斗代替 |
| D.装置C的作用是尾气处理,防止污染空气 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
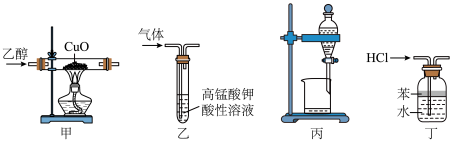
【推荐2】对下列装置或操作描述正确的是
| A | B | C | D |
|
|
|
|
| 用于实验室制乙烯 | 用于实验室制乙炔并检验乙炔 | 探究乙醇的还原性 | A为醋酸,B为碳酸钙,C为苯酚钠溶液,则可验证酸性:醋酸>碳酸>苯酚 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 的
的 溶液中的
溶液中的 气体,并防止液体倒吸
气体,并防止液体倒吸