以 为原料制备甲烷等能源具有较好的发展前景。
为原料制备甲烷等能源具有较好的发展前景。 催化(固体催化剂)加氢合成甲烷的反应为
催化(固体催化剂)加氢合成甲烷的反应为 。
。
(1)该反应中各化学键的键能数据如表所示:
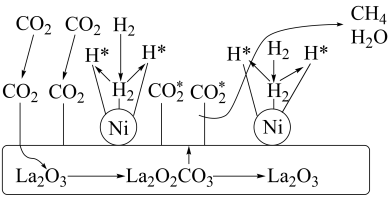
则生成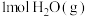 可以
可以___________ (填“放出”或“吸收”)___________  热量。
热量。
(2) 加氢制
加氢制 的一种催化机理如图,下列说法正确的是___________(填标号)。
的一种催化机理如图,下列说法正确的是___________(填标号)。
(3)保持温度不变,向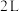 的恒容密闭容器中充入
的恒容密闭容器中充入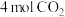 和
和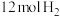 ,发生上述反应,若
,发生上述反应,若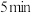 后反应达到平衡,此时测得
后反应达到平衡,此时测得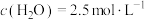 。
。
①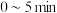 内,
内,
___________  ,
, 的转化率
的转化率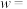
___________ (取整数) 。
。
②下列表述能说明该反应达到平衡状态的是___________ (填标号)。
A.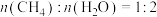
B.混合气体的密度不再发生改变
C.混合气体的平均相对分子质量不再改变
D.断开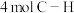 键的同时断开
键的同时断开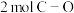 键
键
(4)图示装置可以把 蕴含的化学能转化为电能。
蕴含的化学能转化为电能。
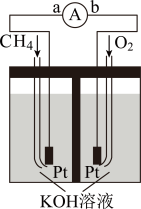
①电池工作时,溶液中的 向
向___________ (填“左”或“右”)移动,负极的电极反应式为___________ 。
②当外电路中转移 电子时,消耗的
电子时,消耗的 的体积是
的体积是___________ L(标准状况下)。
 为原料制备甲烷等能源具有较好的发展前景。
为原料制备甲烷等能源具有较好的发展前景。 催化(固体催化剂)加氢合成甲烷的反应为
催化(固体催化剂)加氢合成甲烷的反应为 。
。(1)该反应中各化学键的键能数据如表所示:
| 化学键 |  | C—H | H—O | H—H |
键能 | 750 | 413 | 463 | 436 |
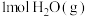 可以
可以 热量。
热量。(2)
 加氢制
加氢制 的一种催化机理如图,下列说法正确的是___________(填标号)。
的一种催化机理如图,下列说法正确的是___________(填标号)。
A.反应过程中的催化剂为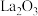 和 和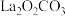 |
B.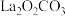 可以释放 可以释放 |
C. 经过 经过 时,断键裂解产生 时,断键裂解产生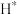 的过程为放热过程 的过程为放热过程 |
D. 加氢制 加氢制 的过程需要 的过程需要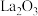 与 与 共同完成 共同完成 |
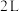 的恒容密闭容器中充入
的恒容密闭容器中充入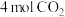 和
和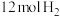 ,发生上述反应,若
,发生上述反应,若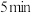 后反应达到平衡,此时测得
后反应达到平衡,此时测得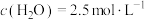 。
。①
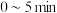 内,
内,
 ,
, 的转化率
的转化率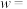
 。
。②下列表述能说明该反应达到平衡状态的是
A.
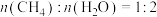
B.混合气体的密度不再发生改变
C.混合气体的平均相对分子质量不再改变
D.断开
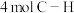 键的同时断开
键的同时断开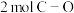 键
键(4)图示装置可以把
 蕴含的化学能转化为电能。
蕴含的化学能转化为电能。
①电池工作时,溶液中的
 向
向②当外电路中转移
 电子时,消耗的
电子时,消耗的 的体积是
的体积是
更新时间:2023-07-07 12:00:16
|
相似题推荐
【推荐1】1905年哈珀开发实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈珀也因此获得了1918年的诺贝尔化学奖。一百多年 过去了,对合成氨的研究依然没有止步。
(1)工业合成氨的反应如下:N2+3H2 2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molN-H键放出的能量为391kJ,则由N2和H2生成2molNH3 的能量变化为
2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molN-H键放出的能量为391kJ,则由N2和H2生成2molNH3 的能量变化为__________ kJ。 下图能正确表示该反应中能量变化的是__________ (填“A”或“B”)。

(2)反应2NH3(g) N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物 NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物 NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。

根据上述数据回答:实验①②中,有一个实验使用了催化剂,它是实验_____ (填序号);实验③达平衡时NH3的转化率为___________ 。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_________ (填序号)。
a. NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
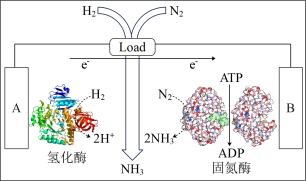
(3)近日美国犹他大学 Minteer教授成功构筑了H2—N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则A电极为_____ 极(填“正”、“负”),B电极发生的电极反应式为_______ ,该电池放电时溶液中的H+向___ 极移动(填“A”、“B”)。
(1)工业合成氨的反应如下:N2+3H2
 2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molN-H键放出的能量为391kJ,则由N2和H2生成2molNH3 的能量变化为
2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molN-H键放出的能量为391kJ,则由N2和H2生成2molNH3 的能量变化为
(2)反应2NH3(g)
 N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物 NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物 NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上述数据回答:实验①②中,有一个实验使用了催化剂,它是实验
a. NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
(3)近日美国犹他大学 Minteer教授成功构筑了H2—N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则A电极为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】学习化学反应原理能够指导促进人类生活质量的提高。
(1)氢气是最理想的能源。1g氢气完全燃烧放出热量121.6kJ,其中断裂1mol H-H键吸收436kJ,断裂1mol O=O键吸收496kJ,则形成1mol H-O键放出热量_______ kJ。
(2)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某兴趣小组拟将刻蚀电路板的反应2FeCl3+Cu=2FeCl2+CuCl2设计成原电池,则负极所用电极材料为_______ ,当线路中转移0.4mol电子时,则被腐蚀铜的质量为_______ g。
(3)CH4—空气碱性燃料电池的能量转化率高,某甲烷燃料电池如图所示。放电时,电子由铂极流出,经电流表流向石墨电极。
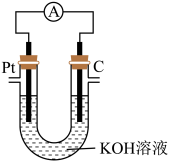
①在石墨电极附近充入_______ (填“CH4”或“空气”)。
②铂极上发生反应的电极反应式为_______ 。
(4)在开始工作的Zn、Cu原电池中,电解质的稀溶液中含CuSO4、H2SO4各0.100mol,则:当电路中通过的电子在0.200~0.300mol时,正极发生的电极反应式是_______ ;当电路中通过0.300mol电子时,电池中共产生标准状况下的气体_______ L。
(1)氢气是最理想的能源。1g氢气完全燃烧放出热量121.6kJ,其中断裂1mol H-H键吸收436kJ,断裂1mol O=O键吸收496kJ,则形成1mol H-O键放出热量
(2)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某兴趣小组拟将刻蚀电路板的反应2FeCl3+Cu=2FeCl2+CuCl2设计成原电池,则负极所用电极材料为
(3)CH4—空气碱性燃料电池的能量转化率高,某甲烷燃料电池如图所示。放电时,电子由铂极流出,经电流表流向石墨电极。

①在石墨电极附近充入
②铂极上发生反应的电极反应式为
(4)在开始工作的Zn、Cu原电池中,电解质的稀溶液中含CuSO4、H2SO4各0.100mol,则:当电路中通过的电子在0.200~0.300mol时,正极发生的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)已知上述反应中相关的化学键键能数据如下:
则该反应的△H=______ kJ·mol-1。
(2)为了加快该反应的速率,可以进行的措施是( ) 。
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=______ 。下列各项能说明该反应达到平衡的是( ) 。
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为_______________ 。
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(1)已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | C≡O(CO) |
| 键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
(2)为了加快该反应的速率,可以进行的措施是
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】李克强总理在十二届全国人大五次会议上作政府工作报告时强调:坚决打好蓝天保卫战。今年二氧化硫、氮氧化物排放量要分别下降3%,重点地区细颗粒物(PM2.5)浓度明显下降。其中二氧化硫、氮氧化物等的排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为___________
Ⅱ.脱碳:一定条件下CO2会和H2反应合成CH3OH。方程式为: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。现向2 L恒容密闭容器中加入2 mol CO2、6 mol H2,在恒温下发生反应。10 s后反应达到平衡,此时容器内CH3OH的浓度为0.5 mol·L-1,请回答以下问题:
(1)前10 s内的平均反应速率v(H2O)=___________ ;平衡时CO2的转化率为___________ 。
(2)下列叙述能说明原反应达到平衡状态的是___________ 。
a.单位时间内消耗n mol CH3OH的同时生成n mol CO2
b.1 mol CO2生成的同时有3 mol H-H键断裂
c.CO2和H2的浓度保持不变
d.容器内压强保持不变
e.CO2和H2的物质的量之比保持不变
Ⅲ.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中SO2溶解在水中,形成一种稀酸溶液,然后与Ca(OH)2浊液等发生中和反应。
(1)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是___________
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知SO2(g)与O2(g)反应生成SO3(g)为放热反应,则SO3(g)分解生成SO2(g)与O2(g)的反应为吸热反应
(2)请写出脱硫过程发生的主要化学方程式:___________ 。
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为
Ⅱ.脱碳:一定条件下CO2会和H2反应合成CH3OH。方程式为: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。现向2 L恒容密闭容器中加入2 mol CO2、6 mol H2,在恒温下发生反应。10 s后反应达到平衡,此时容器内CH3OH的浓度为0.5 mol·L-1,请回答以下问题:
(1)前10 s内的平均反应速率v(H2O)=
(2)下列叙述能说明原反应达到平衡状态的是
a.单位时间内消耗n mol CH3OH的同时生成n mol CO2
b.1 mol CO2生成的同时有3 mol H-H键断裂
c.CO2和H2的浓度保持不变
d.容器内压强保持不变
e.CO2和H2的物质的量之比保持不变
Ⅲ.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中SO2溶解在水中,形成一种稀酸溶液,然后与Ca(OH)2浊液等发生中和反应。
(1)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知SO2(g)与O2(g)反应生成SO3(g)为放热反应,则SO3(g)分解生成SO2(g)与O2(g)的反应为吸热反应
(2)请写出脱硫过程发生的主要化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I “碘钟”实验中,3I-+S2O82-===I3—+2SO42-的反应速率可以用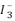 遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
回答下列问题:
(1)该实验的目的是____________________________________________________________ 。
(2)显色时间t1为________ 。
(3)通过分析比较上述数据,得到的结论是___________________________________________________ 。
II根据反应4FeS2+11O2===2Fe2O3+8SO2,试回答下列问题。
(1)通常选用哪些物质来表示该反应的化学反应速率____________ 。
(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为________ 。
(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为________ 。
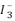 遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
(1)该实验的目的是
(2)显色时间t1为
(3)通过分析比较上述数据,得到的结论是
II根据反应4FeS2+11O2===2Fe2O3+8SO2,试回答下列问题。
(1)通常选用哪些物质来表示该反应的化学反应速率
(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为
(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)下图中表示NO2的变化的曲线是___________ (填字母);
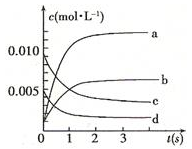
(2)800℃,反应达到平衡时,NO的转化率是___________ ;
(3)用O2表示从0~2s内该反应的平均速率v=___________ 。
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___________ (填选项);
A.2v生(NH3)=v耗(CO2) B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变 D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___________ (填选项);
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___________ 形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。

 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(moll) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是

(2)800℃,反应达到平衡时,NO的转化率是
(3)用O2表示从0~2s内该反应的平均速率v=
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。(1)下列不能判断该分解反应已经达到化学平衡状态的是
A.2v生(NH3)=v耗(CO2) B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变 D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】合成气(主要成分为CO、H2及少量CO、H2O)在工业上有广泛用途。合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g) ΔH<0。将CO与H2混合气体充入密闭容器中,投料比
CH3OH(g) ΔH<0。将CO与H2混合气体充入密闭容器中,投料比 =
= ,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OHK)]与温度(T)、压强(p)之间的关系如图所示。
,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OHK)]与温度(T)、压强(p)之间的关系如图所示。
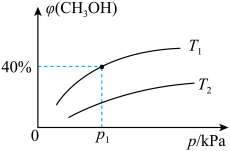
(1)T1、p1时,CO的转化率为_______ (保留3位有效数字)﹔压强平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)。在该条件下,若CO、H2、CH3OH气体的起始物质的量之比为2∶1∶2,则反应开始时v(CO)正______ v(CO)逆。
(2)恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是_______ 。
 CH3OH(g) ΔH<0。将CO与H2混合气体充入密闭容器中,投料比
CH3OH(g) ΔH<0。将CO与H2混合气体充入密闭容器中,投料比 =
= ,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OHK)]与温度(T)、压强(p)之间的关系如图所示。
,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OHK)]与温度(T)、压强(p)之间的关系如图所示。
(1)T1、p1时,CO的转化率为
(2)恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是
| A.CO、H2的物质的量浓度不再随时间的变化而变化 |
| B.混合气体的平均摩尔质量不再随时间的变化而变化 |
| C.混合气体的密度不再随时间的变化而变化 |
| D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______
(2)该反应为______ 反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是______ .
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为______ ℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)⇌CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为 ______ .
(5)在密闭容器中进行反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H1=akJ•mol-1
反应②2CO(g)+O2(g)⇌2CO2(g)△H2=b kJ•mol-1
反应③2Fe(s)+O2(g)⇌2FeO(s)△H3
则△H3=______ (用含a、b的代数式表示).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为
(5)在密闭容器中进行反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H1=akJ•mol-1
反应②2CO(g)+O2(g)⇌2CO2(g)△H2=b kJ•mol-1
反应③2Fe(s)+O2(g)⇌2FeO(s)△H3
则△H3=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】某温度下CO2加氢制甲醇的总反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应为放热反应,在固定容积为2.0L的密闭容器中充入0.8mol的CO2和2.4mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。
CH3OH(g)+H2O(g),该反应为放热反应,在固定容积为2.0L的密闭容器中充入0.8mol的CO2和2.4mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。
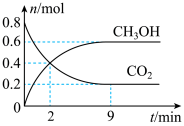
请回答:
(1)对于该反应,反应物的化学键断裂要吸收的能量________ (填“大于”、“小于”或“等于”)生成物的化学键形成要放出的能量。
(2)下列措施能加快反应速率的是________ (填标号)。
A.往容器中充入H2 B.往容器充入N2 C.及时分离出CH3OH
D.增大容器体积 E.选择高效的催化剂
(3)2min内H2的反应速率为__________ 。
(4)该反应达平衡时的压强是开始时压强的__________ 。
(5)恒温恒容条件下,不能说明反应已达平衡状态的是________ (填标号)。
A. CO2(g)体积分数保持不变
B.容器中气体压强保持不变
C.混合气体的密度保持不变
D. H2的生成速率是H2O生成速率的3倍
E.容器中CH3OH浓度与H2O浓度之比为1:1
F.容器内混合气体的平均相对分子质量保持不变
(6)将上述反应制得的甲醇设计成燃料电池,具有启动快、效率高等优点,装置如图所示(A、B为多孔碳棒)。

①实验测得OH向B电极定向移动,则________ (填“A”或“B”)处电极入口通甲醇。
②写出负极电极方程式________ 。
 CH3OH(g)+H2O(g),该反应为放热反应,在固定容积为2.0L的密闭容器中充入0.8mol的CO2和2.4mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。
CH3OH(g)+H2O(g),该反应为放热反应,在固定容积为2.0L的密闭容器中充入0.8mol的CO2和2.4mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。
请回答:
(1)对于该反应,反应物的化学键断裂要吸收的能量
(2)下列措施能加快反应速率的是
A.往容器中充入H2 B.往容器充入N2 C.及时分离出CH3OH
D.增大容器体积 E.选择高效的催化剂
(3)2min内H2的反应速率为
(4)该反应达平衡时的压强是开始时压强的
(5)恒温恒容条件下,不能说明反应已达平衡状态的是
A. CO2(g)体积分数保持不变
B.容器中气体压强保持不变
C.混合气体的密度保持不变
D. H2的生成速率是H2O生成速率的3倍
E.容器中CH3OH浓度与H2O浓度之比为1:1
F.容器内混合气体的平均相对分子质量保持不变
(6)将上述反应制得的甲醇设计成燃料电池,具有启动快、效率高等优点,装置如图所示(A、B为多孔碳棒)。

①实验测得OH向B电极定向移动,则
②写出负极电极方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(C—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________ 。
相关化学键的键能如下表所示:
(2)为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO 2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
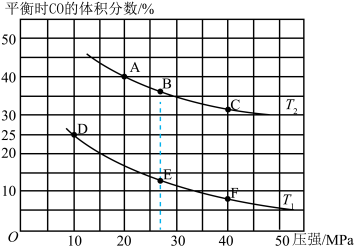
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有___________ (填标号)。
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=___________ MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。保留4位小数)。
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的___________ 点(填标号)。
(3)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________ 。
(4)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中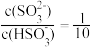 ,则该混合溶液的pH=
,则该混合溶液的pH=___________ (25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
(5)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:

①电极b上发生的是___________ 反应(填“氧化”或“还原”)。
②电极a的电极反应为_______________________ 。
(1)亚硝酰氯(C—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为
相关化学键的键能如下表所示:
| 化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
| 键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO
 2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的
(3)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为
(4)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中
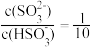 ,则该混合溶液的pH=
,则该混合溶液的pH=(5)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:

①电极b上发生的是
②电极a的电极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题。
(1)下图可以表示正乙烷。

①该模型称为正己烷的___________ 模型。
②它易与氯气发生反应,该有机反应类型称为___________ 。
③它的某种同系物在同温同压下蒸气的密度是 的64倍,则其分子式为
的64倍,则其分子式为___________ 。
(2)甲烷既是最简单的有机物,也是重要的燃料。 完全燃烧时生成
完全燃烧时生成 和
和 时放出
时放出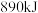 的热量。
的热量。
①下列关于甲烷的说法中不正确的是___________ 。
A.甲烷在空气中燃烧只能生成 和
和
B.甲烷是天然气的主要成分,天然气为化石燃料
C.若将甲烷燃烧设计成燃料电池,甲烷在负极反应
D. 没有同分异构体,说明甲烷为正四面体分子
没有同分异构体,说明甲烷为正四面体分子
②根据下列键能数据计算 键键能为
键键能为___________  。
。
(3)化学能在一定条件下能够转化为电能、热能、光能等其他形式的能量状态。请按照要求解决相关问题。
①根据构成原电池的本质判断,下列反应可以设计成原电池的是___________ (填序号)。
A. B.
B.
C. D.
D.
②铅酸蓄电池是最常见的二次电池。放电时的化学方程式为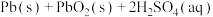
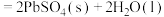 。负极反应式为
。负极反应式为___________ 。
③已知正己烷(液体)的热值约为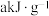 ,试写出
,试写出 正己烷完全燃烧生成
正己烷完全燃烧生成 液态水的热化学方程式
液态水的热化学方程式___________ 。
(1)下图可以表示正乙烷。

①该模型称为正己烷的
②它易与氯气发生反应,该有机反应类型称为
③它的某种同系物在同温同压下蒸气的密度是
 的64倍,则其分子式为
的64倍,则其分子式为(2)甲烷既是最简单的有机物,也是重要的燃料。
 完全燃烧时生成
完全燃烧时生成 和
和 时放出
时放出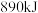 的热量。
的热量。①下列关于甲烷的说法中不正确的是
A.甲烷在空气中燃烧只能生成
 和
和
B.甲烷是天然气的主要成分,天然气为化石燃料
C.若将甲烷燃烧设计成燃料电池,甲烷在负极反应
D.
 没有同分异构体,说明甲烷为正四面体分子
没有同分异构体,说明甲烷为正四面体分子②根据下列键能数据计算
 键键能为
键键能为 。
。| 化学键 |  |  |  |
键能 | 416 | 496 | 463 |
(3)化学能在一定条件下能够转化为电能、热能、光能等其他形式的能量状态。请按照要求解决相关问题。
①根据构成原电池的本质判断,下列反应可以设计成原电池的是
A.
 B.
B.
C.
 D.
D.
②铅酸蓄电池是最常见的二次电池。放电时的化学方程式为
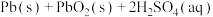
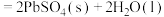 。负极反应式为
。负极反应式为③已知正己烷(液体)的热值约为
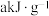 ,试写出
,试写出 正己烷完全燃烧生成
正己烷完全燃烧生成 液态水的热化学方程式
液态水的热化学方程式
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
【推荐3】烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,B、C、D是生活中两种常见的有机物,E是一种有水果香味的物质。A可发生如图所示的一系列化学反应。

请回答下列问题:
(1)A的结构简式是___________ 。
(2)反应①和③的有机反应类型分别是___________ 、___________ 。
(3)F是一种高分子化合物,其结构简式是___________ 。
(4)反应②生成的有机物C中含有的官能团名称为:___________ ;反应④的方程式为:___________ 。
(5)实验室常用如图装置制取E。

①试管b中所盛装的液体是___________ 。装置中球形干燥管除起冷凝作用外,另一个作用是___________ 。②含有羧基的E的同分异构体有___________ 种。
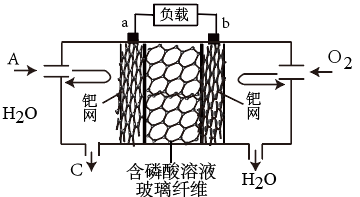
(6)新型燃料电池以A为原料制备C并获得电能,工作原理如图所示。a极的电极反应式为___________

请回答下列问题:
(1)A的结构简式是
(2)反应①和③的有机反应类型分别是
(3)F是一种高分子化合物,其结构简式是
(4)反应②生成的有机物C中含有的官能团名称为:
(5)实验室常用如图装置制取E。

①试管b中所盛装的液体是
(6)新型燃料电池以A为原料制备C并获得电能,工作原理如图所示。a极的电极反应式为

您最近一年使用:0次



