Mn是元素周期表中第25号元素,它的氧化物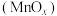 可用于催化醇的氧化氰化,反应如下:
可用于催化醇的氧化氰化,反应如下:
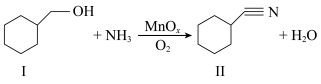
回答下列问题:
(1)组成物质Ⅰ的元素中,电负性最大是_____ (填元素符号)。
(2)物质Ⅱ中C原子的杂化轨道类型有_____ ; 该分子中含有
该分子中含有 键
键_____ mol。
(3) 的VSEPR模型为
的VSEPR模型为_____ ;已知 ,但该反应不及Na与
,但该反应不及Na与 的反应剧烈,从共价键的角度分析,可能的原因是
的反应剧烈,从共价键的角度分析,可能的原因是_____ 。
(4)Mn元素在周期表中的位置是_____ ;基态Mn原子的核外电子有_____ 种空间运动状态。
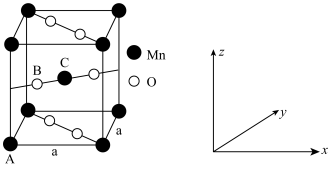
(5)某种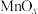 晶体的晶胞如下图所示,该晶体中Mn元素的化合价为
晶体的晶胞如下图所示,该晶体中Mn元素的化合价为_____ 。已知该晶胞底面是边长为 的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为
的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为 、
、 、
、 ,则Mn与O形成化学键的键长为
,则Mn与O形成化学键的键长为_____ cm(用含a、m、n的代数式表示)。
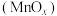 可用于催化醇的氧化氰化,反应如下:
可用于催化醇的氧化氰化,反应如下:
回答下列问题:
(1)组成物质Ⅰ的元素中,电负性最大是
(2)物质Ⅱ中C原子的杂化轨道类型有
 该分子中含有
该分子中含有 键
键(3)
 的VSEPR模型为
的VSEPR模型为 ,但该反应不及Na与
,但该反应不及Na与 的反应剧烈,从共价键的角度分析,可能的原因是
的反应剧烈,从共价键的角度分析,可能的原因是(4)Mn元素在周期表中的位置是
(5)某种
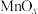 晶体的晶胞如下图所示,该晶体中Mn元素的化合价为
晶体的晶胞如下图所示,该晶体中Mn元素的化合价为 的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为
的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为 、
、 、
、 ,则Mn与O形成化学键的键长为
,则Mn与O形成化学键的键长为
更新时间:2023-09-14 16:27:24
|
相似题推荐
【推荐1】第四周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态Cu原子电子排布式为:__________ 。
(2)过渡金属单质及化合物是有机合成反应的重要催化剂。
例如:
①苯甲醇中碳原子的杂化类型是___________ 。
②苯甲醇的沸点比苯甲醛_______ 。(填“高”或“低”)
③苯甲醛分子中三种非金属元素C、O、H的电负性由大到小的顺序是____________ 。
(3)多数过渡金属的配离子在水中有颜色,其显色与配合物分裂能有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,用 表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,
表示,中心离子电荷数越大,中心与配体距离越近,则作用越强, 越大。分裂能(
越大。分裂能( )Co(H2O)62+
)Co(H2O)62+_______ Co(H2O)63+(填“ > ”“〈”或“ =”)。
(4)钨与碳组成一种特殊材料,其晶体的晶胞如图1所示,它的熔点为2870℃、硬度类似金刚石,预测它的晶体类型是_________ 。

(5)Fe的一种晶体如图2所示,设阿伏加 德罗常数的值为NA,铁原子的半径是r cm,该晶体的密度是ρ g/cm3,则铁的相对原子质量为___ (只列出计算式)

(1)基态Cu原子电子排布式为:
(2)过渡金属单质及化合物是有机合成反应的重要催化剂。
例如:

①苯甲醇中碳原子的杂化类型是
②苯甲醇的沸点比苯甲醛
③苯甲醛分子中三种非金属元素C、O、H的电负性由大到小的顺序是
(3)多数过渡金属的配离子在水中有颜色,其显色与配合物分裂能有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,用
 表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,
表示,中心离子电荷数越大,中心与配体距离越近,则作用越强, 越大。分裂能(
越大。分裂能( )Co(H2O)62+
)Co(H2O)62+(4)钨与碳组成一种特殊材料,其晶体的晶胞如图1所示,它的熔点为2870℃、硬度类似金刚石,预测它的晶体类型是

(5)Fe的一种晶体如图2所示,设阿伏加 德罗常数的值为NA,铁原子的半径是r cm,该晶体的密度是ρ g/cm3,则铁的相对原子质量为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】硫是组成生命的重要元素。回答下列问题:
(1)基态S原子含有___________ 种能量不同的电子,其价层电子排布图是___________ 。
(2)S单质的常见形式为 (
(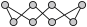 ),其中S原子采用的轨道杂化方式是
),其中S原子采用的轨道杂化方式是___________ 。
(3)已知化合物 (
( )中键角α为124°,β为96°,α>β的原因主要是
)中键角α为124°,β为96°,α>β的原因主要是___________ 。
(4) 的结构简图如图所示,其中不存在的作用力有
的结构简图如图所示,其中不存在的作用力有___________ (填字母)。
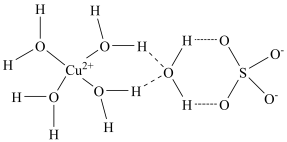
A.氢键 B.共价键 C.金属键 D.配位键
 的空间构型是
的空间构型是___________ ,写出一个与 互为等电子体的阴离子的化学式
互为等电子体的阴离子的化学式___________ 。
(5)ZnS在光导体材料、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶体密度为 ,若将a位置
,若将a位置 离子的分数坐标确定为(0,0,0),则b位置
离子的分数坐标确定为(0,0,0),则b位置 离子的分数坐标为
离子的分数坐标为___________ , 离子与
离子与 离子的最近距离为
离子的最近距离为___________ pm(列出计算式,阿伏加德罗常数用 表示)。
表示)。

(1)基态S原子含有
(2)S单质的常见形式为
 (
( ),其中S原子采用的轨道杂化方式是
),其中S原子采用的轨道杂化方式是(3)已知化合物
 (
( )中键角α为124°,β为96°,α>β的原因主要是
)中键角α为124°,β为96°,α>β的原因主要是(4)
 的结构简图如图所示,其中不存在的作用力有
的结构简图如图所示,其中不存在的作用力有
A.氢键 B.共价键 C.金属键 D.配位键
 的空间构型是
的空间构型是 互为等电子体的阴离子的化学式
互为等电子体的阴离子的化学式(5)ZnS在光导体材料、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶体密度为
 ,若将a位置
,若将a位置 离子的分数坐标确定为(0,0,0),则b位置
离子的分数坐标确定为(0,0,0),则b位置 离子的分数坐标为
离子的分数坐标为 离子与
离子与 离子的最近距离为
离子的最近距离为 表示)。
表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】(1)Ti元素被誉为“太空金属”。基态Ti原子的价电子排布式为____ ,其中有____ 个未成对电子,其中最高能层的电子占据能级的电子云轮廓图为____ 。
(2)C、N、O三种元素,第一电离能由大到小顺序为____ ,电负性最大的是____ 。
(3)与 互为等电子体的一种分子为
互为等电子体的一种分子为____ (用化学式表示); 的立体构型为
的立体构型为____ 。
(4)元素N有多种氢化物均具有重要的用途。N2H4分子中含有___ 个σ键;NH3的VSEPR构型是_____ 。
(5)Cu晶体的堆积模型是面心立方最密堆积,晶胞中Cu的配位数为____ 。下列金属晶体也采取这种堆积模型的是___ 。(填标号)
A.Na B.Po C.Mg D.Ag
(6)Cu与Cl形成化合物的晶胞如图所示(黑球代表Cu原子)。
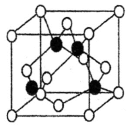
该化合物化学式为____ 。已知阿伏加德罗常数为NA,则该晶体边长为apm,该晶体的密度表达式为_____ g·cm-3。
(2)C、N、O三种元素,第一电离能由大到小顺序为
(3)与
 互为等电子体的一种分子为
互为等电子体的一种分子为 的立体构型为
的立体构型为(4)元素N有多种氢化物均具有重要的用途。N2H4分子中含有
(5)Cu晶体的堆积模型是面心立方最密堆积,晶胞中Cu的配位数为
A.Na B.Po C.Mg D.Ag
(6)Cu与Cl形成化合物的晶胞如图所示(黑球代表Cu原子)。

该化合物化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】工业上以Ni的氧化物作催化剂,将丙烯氨氧化制得丙烯腈( CH2=CHCN),然后以H3PO4-K3PO4等作为电解质溶液,电解丙烯腈制已二腈。已知总反应的化学方程式为:4CH2=CHCN+2H2O O2↑+2NC(CH2)4CN。
O2↑+2NC(CH2)4CN。
(1)基态Ni原子价层电子的轨道表达式为_______ ;在上述总反应的化学方程式中所涉及到的各元素中,电负性由小到大的顺序为_______ 。
(2)PO43-的空间构型是_______ ,CH2=CHCN中碳原子的杂化方式为_______ 。
(3)NC(CH2)4CN分子中σ键与π键数目之比为_______ 。
(4)已知K3PO4是离子晶体,写出其主要物理性质_____ (写出2条即可)。
(5)反应中核心元素碳有金刚石、石墨等多种同素异形体。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a____ b(填“>”、“=”或“<”),原因________ 。
(6)金刚石的晶胞结构如下图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为_________ 。

(7)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)
①石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是___ (填“变大”、“变小”“不变”)。
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯的单面理论面积约为_______ m3(列出计算式即可)。
 O2↑+2NC(CH2)4CN。
O2↑+2NC(CH2)4CN。(1)基态Ni原子价层电子的轨道表达式为
(2)PO43-的空间构型是
(3)NC(CH2)4CN分子中σ键与π键数目之比为
(4)已知K3PO4是离子晶体,写出其主要物理性质
(5)反应中核心元素碳有金刚石、石墨等多种同素异形体。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a
(6)金刚石的晶胞结构如下图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为

(7)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)
①石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯的单面理论面积约为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】铁和硒( :第四周期ⅥA)都是人体必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
:第四周期ⅥA)都是人体必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
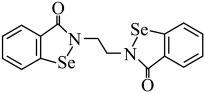
(1)乙烷硒啉是一种抗癌新药,其结构式如下:
①基态Se原子的核外电子排布式为___________ 。
②比较键角大小:气态 分子
分子___________  离子(填“>”“<”或“=”),原因是:
离子(填“>”“<”或“=”),原因是:___________ 。
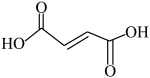
(2)富马酸亚铁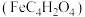 是一种补铁剂。富马酸分子的结构式如图所示:
是一种补铁剂。富马酸分子的结构式如图所示:
①富马酸分子中 键与
键与 键的数目比为
键的数目比为___________ 。
②富马酸亚铁中各元素的电负性由大到小的顺序为___________ 。
③请写出亚铁离子的价层电子轨道表示式___________ 。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将
,将 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:
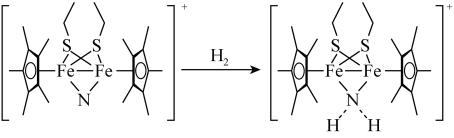
产物 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为___________ 。
 :第四周期ⅥA)都是人体必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
:第四周期ⅥA)都是人体必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:(1)乙烷硒啉是一种抗癌新药,其结构式如下:

①基态Se原子的核外电子排布式为
②比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”),原因是:
离子(填“>”“<”或“=”),原因是:(2)富马酸亚铁
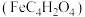 是一种补铁剂。富马酸分子的结构式如图所示:
是一种补铁剂。富马酸分子的结构式如图所示:
①富马酸分子中
 键与
键与 键的数目比为
键的数目比为②富马酸亚铁中各元素的电负性由大到小的顺序为
③请写出亚铁离子的价层电子轨道表示式
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化
 ,将
,将 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:
产物
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】氮族元素包括氮、磷、砷、锑、铋,它们的单质及其化合物在生产生活中具有十分重要的应用。回答下列问题:
(1)As元素原子核外电子占据的最高能层的符号是___ 。Bi3+的价层电子排布式为__ 。
(2)NH3、PH3、AsH3分子的键角大小顺序为__ 。HNO3的酸性强于HNO2的原因是__ 。
(3)我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl。其中N 为平面五边形结构,N的杂化方式为
为平面五边形结构,N的杂化方式为__ ,N 离子中含有的大
离子中含有的大 键表示为
键表示为__ ,该盐中所含元素的电负性大小顺序为____ ,H3O+的空间构型是___ 。
(4)氨硼烷(NH3BH3)是种具有潜力的固体储氢材料,分子中接受电子对的原子是___ 。与氨硼烷互为等电子体的分子是的___ (写名称),其熔点比(NH3BH3低,原因是___ 。
(5)PCl5固体是离子化合物,是由PCl 和PCl
和PCl 组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为___ g•cm-3(写出数学表达式)。
(1)As元素原子核外电子占据的最高能层的符号是
(2)NH3、PH3、AsH3分子的键角大小顺序为
(3)我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl。其中N
 为平面五边形结构,N的杂化方式为
为平面五边形结构,N的杂化方式为 离子中含有的大
离子中含有的大 键表示为
键表示为(4)氨硼烷(NH3BH3)是种具有潜力的固体储氢材料,分子中接受电子对的原子是
(5)PCl5固体是离子化合物,是由PCl
 和PCl
和PCl 组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】雄黄(As4S4)、雌黄(As2S3)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
(1)基态硫原子核外电子的运动轨道数有_______ 种;其核外电子运动最高能级的电子云轮廓图的形状为_______ 。
(2)下列有关微粒性质的排列顺序错误的是_______。
(3)已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是_______ 。
(4)CS2分子中,共价键的类型有_______ ,C原子的杂化轨道类型是_______ ,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______ 。
(5)金属Zn晶体中的原子堆积方式如图,六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为_______ g·cm-3(列出计算式)。

(1)基态硫原子核外电子的运动轨道数有
(2)下列有关微粒性质的排列顺序错误的是_______。
| A.元素的电负性:P<O<F | B.元素的第一电离能:C<N<O |
C.离子半径: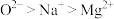 | D.原子的未成对电子数: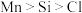 |
(4)CS2分子中,共价键的类型有
(5)金属Zn晶体中的原子堆积方式如图,六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为

您最近一年使用:0次
【推荐2】钴及其化合物有重要的用途,探究其结构有重要意义。
(1)基态Co的价层电子排布式是 ,轨道表示式是
,轨道表示式是_______ ,在元素周期表中,该元素属于_______ (填“d”或“ds”)区。
(2) 是
是 的一种重要配合物。
的一种重要配合物。
①该配合物的一种配体是 ,
, 的空间结构呈
的空间结构呈_______ 形,是_______ (填“极性”或“非极性”)分子。
②该配合物中 参与杂化的6个能量相近的空轨道分别是2个3d轨道、1个
参与杂化的6个能量相近的空轨道分别是2个3d轨道、1个_______ 轨道和3个_______ 轨道。
③涉及实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量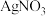 溶液,
溶液,_______ (补全实验操作和数据)。相对分子质量: 250.5
250.5  143.5
143.5
(3)钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。

①图2中Ⅱ型小立方体分别是b、_______ (填字母序号)。
②钴蓝晶体中三种原子个数比
_______ 。
③用 表示阿伏加德罗常数的值,则钴蓝晶胞密度为
表示阿伏加德罗常数的值,则钴蓝晶胞密度为_______  (列出表达式)。
(列出表达式)。
(1)基态Co的价层电子排布式是
 ,轨道表示式是
,轨道表示式是(2)
 是
是 的一种重要配合物。
的一种重要配合物。①该配合物的一种配体是
 ,
, 的空间结构呈
的空间结构呈②该配合物中
 参与杂化的6个能量相近的空轨道分别是2个3d轨道、1个
参与杂化的6个能量相近的空轨道分别是2个3d轨道、1个③涉及实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取
 该配合物,先加水溶解,再加足量
该配合物,先加水溶解,再加足量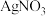 溶液,
溶液, 250.5
250.5  143.5
143.5(3)钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。

①图2中Ⅱ型小立方体分别是b、
②钴蓝晶体中三种原子个数比

③用
 表示阿伏加德罗常数的值,则钴蓝晶胞密度为
表示阿伏加德罗常数的值,则钴蓝晶胞密度为 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】 、
、 是近年来常用的高温表层超导材料,其母体常
是近年来常用的高温表层超导材料,其母体常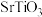 。请回答下列与之相关的问题:
。请回答下列与之相关的问题:
(1)基态 原子的电子排布式为
原子的电子排布式为__________ , 的第一电离能比
的第一电离能比 大,其原因
大,其原因__________ 。
(2)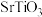 为白色结晶粉末,熔点2020℃。
为白色结晶粉末,熔点2020℃。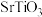 的晶体类型为
的晶体类型为__________ , 的空间构型为
的空间构型为__________ 。
(3)用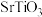 做电极材料,通过光电解可将
做电极材料,通过光电解可将 和
和 催化合成
催化合成 ,其工作原理如图所示,羟基自由基
,其工作原理如图所示,羟基自由基 的电子式为
的电子式为__________ , 、
、 、
、 中键角的大小顺序为
中键角的大小顺序为__________ 。

(4) 、
、 、
、 形成的一种新型超导材料的晶胞如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
形成的一种新型超导材料的晶胞如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。 原子①的坐标为
原子①的坐标为 ,
, 原子②的坐标为
原子②的坐标为 ,
, 原子③的坐标为
原子③的坐标为 ,则
,则 原子④的坐标为
原子④的坐标为__________ ;已知晶胞参数如图所示,晶胞棱边夹角均为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为__________  (列式表示)。
(列式表示)。

 、
、 是近年来常用的高温表层超导材料,其母体常
是近年来常用的高温表层超导材料,其母体常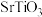 。请回答下列与之相关的问题:
。请回答下列与之相关的问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 的第一电离能比
的第一电离能比 大,其原因
大,其原因(2)
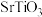 为白色结晶粉末,熔点2020℃。
为白色结晶粉末,熔点2020℃。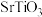 的晶体类型为
的晶体类型为 的空间构型为
的空间构型为(3)用
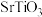 做电极材料,通过光电解可将
做电极材料,通过光电解可将 和
和 催化合成
催化合成 ,其工作原理如图所示,羟基自由基
,其工作原理如图所示,羟基自由基 的电子式为
的电子式为 、
、 、
、 中键角的大小顺序为
中键角的大小顺序为
(4)
 、
、 、
、 形成的一种新型超导材料的晶胞如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
形成的一种新型超导材料的晶胞如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。 原子①的坐标为
原子①的坐标为 ,
, 原子②的坐标为
原子②的坐标为 ,
, 原子③的坐标为
原子③的坐标为 ,则
,则 原子④的坐标为
原子④的坐标为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为 (列式表示)。
(列式表示)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】镍及硫酸镍在新型材料、新型电池的生产中有着十分广泛的应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备纯镍或硫酸镍的流程如下:
②常温下溶度积常数:Ksp(NiS)=1.07×10-21、Ksp(CuS)=1.27×10-36。
(1)步骤①中焦炭和石英也可用于工业制粗硅,则工业制粗硅化学反应为_______ ;炉气使酸性高锰酸钾溶液褪色的离子方程式为_______ 。
(2)步骤⑥以MS(含CuS)作阳极、NiSO4溶液作电解液电解可在_______ 极(填“阴”或“阳”)获得粗镍。粗镍的电解精炼需要将电解液的pH控制在2~5之间,下列有关说法错误的是_______ (填序号)。
A.防止溶液的酸性过强造成H+放电,在阴极生成H2
B.防止溶液的酸性过弱使Ni2+转化成Ni(OH)2沉淀
C.若溶液的pH<2,可加入NiO或Ni(OH)2固体调节溶液的pH
D.使粗镍中所含的杂质Cu在阳极放电而进入电解液中
(3)化学上常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+,若该溶液中的c(Ni2+)=0.107mol·L-1,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:_______ 。
(4)硫化镍晶胞如图1所示,单原子层硫化镍的结构如图2所示。_______ 。
②单层硫化镍晶体图2中,已知硫离子半径为apm,忽略镍离子半径,NA是阿伏加德罗常数的值。则单层硫化镍晶体每平方米含硫化镍的质量为_______ g。

②常温下溶度积常数:Ksp(NiS)=1.07×10-21、Ksp(CuS)=1.27×10-36。
(1)步骤①中焦炭和石英也可用于工业制粗硅,则工业制粗硅化学反应为
(2)步骤⑥以MS(含CuS)作阳极、NiSO4溶液作电解液电解可在
A.防止溶液的酸性过强造成H+放电,在阴极生成H2
B.防止溶液的酸性过弱使Ni2+转化成Ni(OH)2沉淀
C.若溶液的pH<2,可加入NiO或Ni(OH)2固体调节溶液的pH
D.使粗镍中所含的杂质Cu在阳极放电而进入电解液中
(3)化学上常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+,若该溶液中的c(Ni2+)=0.107mol·L-1,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:
(4)硫化镍晶胞如图1所示,单原子层硫化镍的结构如图2所示。

②单层硫化镍晶体图2中,已知硫离子半径为apm,忽略镍离子半径,NA是阿伏加德罗常数的值。则单层硫化镍晶体每平方米含硫化镍的质量为
您最近一年使用:0次
【推荐2】Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为______ ,其中心原子采取______ 杂化;化合物N在固态时 的晶体类型为______ 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为______ 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为______ (写分子式)。
(4)Z原子基态时的外围电子排布式为______ ;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为______ 。
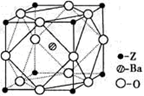
(5)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为______ 。
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为
(2)R、X、Y三种元素的第一电离能由小到大的顺序为
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为
(4)Z原子基态时的外围电子排布式为

(5)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态 Ge 原子的简化电子排布式为_______ 。
(2)Ge 与 C 是同族元素,C 原子之间可以形成双键、三键,但 Ge 原子之间难以形成双键或三键。从原子结构角度分析,原因是_______ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_______ 。
(4)Ge 单晶具有金刚石型结构,其中 Ge 原子的杂化方式为_______ ,微粒之间存在的作用力是_______ 。
(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为 Ge 单晶的晶胞,其中原子坐标参数 A 为(0, 0,0);B 为(1/2 ,0,1/2);C 为(1/2 ,1/2 ,0);则 D 原子的坐标参数为_______ 。与 C 原子最近的原子有_______ 个。
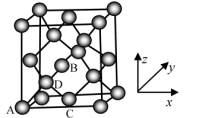
②晶胞参数,描述晶胞的大小和形状,已知 Ge 单晶的晶胞参数 a=565.76 pm,其密度为_______ g·cm-3(列出计算式即可)。
(1)基态 Ge 原子的简化电子排布式为
(2)Ge 与 C 是同族元素,C 原子之间可以形成双键、三键,但 Ge 原子之间难以形成双键或三键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为 Ge 单晶的晶胞,其中原子坐标参数 A 为(0, 0,0);B 为(1/2 ,0,1/2);C 为(1/2 ,1/2 ,0);则 D 原子的坐标参数为

②晶胞参数,描述晶胞的大小和形状,已知 Ge 单晶的晶胞参数 a=565.76 pm,其密度为
您最近一年使用:0次



