铬、铁、钴、铜等金属及其化合物在工业上有重要用途。请回答:
(1)基态铬原子的价电子排布图为 (填序号)。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl +2CrO2Cl2+3COCl2↑。
①上述描述中涉及的非金属元素电负性由大到小的顺序是__________ (填序号)。
A.C>Cl>O B.C<Cl<O C.O>Cl>C D.C<O<Cl
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于_____ 晶体。
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配合物的化学式应该写为__________ (填序号)。
A.[Cr(H2O)4Cl] Cl2·2H2O B.[Cr(H2O)4Cl2] Cl·2H2O
C.[Cr(H2O)4Cl2] Cl D.[Cr(H2O)3Cl3]·H2O
(3)Co3+与NO 形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
①配体 的立体构型为
的立体构型为__________ (填序号)。
A. 三角锥形 B. 平面三角形 C.直线形 D.V形
② 的中心原子的杂化类型为
的中心原子的杂化类型为__________ (填序号)。
A. sp B. sp2 C.sp3 D.dsp2
③N原子中有_______ 种能量不同的电子。
(4)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示。

化学式为_____ 。该晶胞中只由铁原子构成的晶胞堆积模型为__________ 。若两个最近的Fe原子间的距离为a nm,则该晶体的密度是______________ (填序号)g/cm3(设阿伏加德罗常数的值为NA)。
A. B.
B. ×1030 C.
×1030 C. ×
× ×1027 D.
×1027 D.  ×1021
×1021
(5)如上述晶胞将N原子放在顶点,则Fe原子会在晶胞中出现的位置是棱心和__________ 。
(1)基态铬原子的价电子排布图为 (填序号)。
A. | B. |
C.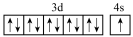 | D. |
①上述描述中涉及的非金属元素电负性由大到小的顺序是
A.C>Cl>O B.C<Cl<O C.O>Cl>C D.C<O<Cl
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配合物的化学式应该写为
A.[Cr(H2O)4Cl] Cl2·2H2O B.[Cr(H2O)4Cl2] Cl·2H2O
C.[Cr(H2O)4Cl2] Cl D.[Cr(H2O)3Cl3]·H2O
(3)Co3+与NO
 形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。①配体
 的立体构型为
的立体构型为A. 三角锥形 B. 平面三角形 C.直线形 D.V形
②
 的中心原子的杂化类型为
的中心原子的杂化类型为A. sp B. sp2 C.sp3 D.dsp2
③N原子中有
(4)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示。

化学式为
A.
 B.
B. ×1030 C.
×1030 C. ×
× ×1027 D.
×1027 D.  ×1021
×1021(5)如上述晶胞将N原子放在顶点,则Fe原子会在晶胞中出现的位置是棱心和
更新时间:2023-09-10 12:53:53
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】丙酮酸(CH3COCOOH)、硫氰酸( HSCN)和氨硼烷(NH3BH3)是化学中一些热点物质。
(1)氨硼烷的结构式如图所示:
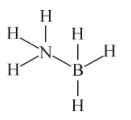
已知:H-N键的共用电子对偏离H,H-B键的共用电子对偏向H。H、B、N元素的电负性由大到小排序为_______ (填元素符号)。
(2)常温下加入蒸馏水分别稀释V0 mL硫氰酸溶液、丙酮酸溶液,得到溶液体积均为VmL。溶液pH与 之间关系如图所示。
之间关系如图所示。
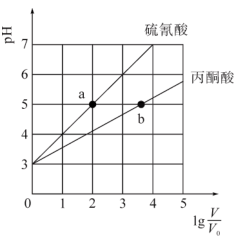
①起始时c( HSCN)_______ c(CH3CO-COOH)(填“>”“<”或“=”),判断的依据是_______ 。
②c(OH-) :a_______ b(填“>”“<”或“=”),判断的依据是_______ 。
③ =3时,加热上述两种溶液,
=3时,加热上述两种溶液, 会
会_______ (填“增大”减小”或“不变”)(不考虑酸挥发等损失)。
④等体积、等物质的量浓度的KSCN溶液(X)、CH3COCOOK溶液(Y)中,离子总浓度:X_______ Y(填“>”“<”或“=”)。
(3)已知:缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加少量强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH相对稳定。当缓冲溶液中弱酸(或弱碱)与弱酸根离子(或弱碱的阳离子)浓度相等时缓冲能力最大。CH3COCOONa和CH3COCOOH组成的缓冲溶液中,缓冲能力最大时pH=3。
①室温下,CH3COCOOH的电离常数Ka为_______ 。
②用平衡移动原理解释“缓冲原理”:_______ 。
(1)氨硼烷的结构式如图所示:

已知:H-N键的共用电子对偏离H,H-B键的共用电子对偏向H。H、B、N元素的电负性由大到小排序为
(2)常温下加入蒸馏水分别稀释V0 mL硫氰酸溶液、丙酮酸溶液,得到溶液体积均为VmL。溶液pH与
 之间关系如图所示。
之间关系如图所示。
①起始时c( HSCN)
②c(OH-) :a
③
 =3时,加热上述两种溶液,
=3时,加热上述两种溶液, 会
会④等体积、等物质的量浓度的KSCN溶液(X)、CH3COCOOK溶液(Y)中,离子总浓度:X
(3)已知:缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加少量强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH相对稳定。当缓冲溶液中弱酸(或弱碱)与弱酸根离子(或弱碱的阳离子)浓度相等时缓冲能力最大。CH3COCOONa和CH3COCOOH组成的缓冲溶液中,缓冲能力最大时pH=3。
①室温下,CH3COCOOH的电离常数Ka为
②用平衡移动原理解释“缓冲原理”:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】锌及其化合物在生产生活中应用广泛。回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
(2)一种香豆素衍生物( )可作为测定
)可作为测定 的荧光探针,其原理如下图所示。已知
的荧光探针,其原理如下图所示。已知 中
中 结构的异构化和旋转会导致荧光减弱。
结构的异构化和旋转会导致荧光减弱。

① 所含元素(C、H、O、N)电负性从大到小的顺序为
所含元素(C、H、O、N)电负性从大到小的顺序为_______ ;
② 中N原子的杂化类型为
中N原子的杂化类型为_______ ;
③加入 后,体系荧光增强的原因是
后,体系荧光增强的原因是_______ 。
(3) 可用于配制炉甘石洗剂,具有收敛和保护皮肤的作用。
可用于配制炉甘石洗剂,具有收敛和保护皮肤的作用。 中阴离子
中阴离子 的空间构型为
的空间构型为_______ ,与 互为等电子体的分子有
互为等电子体的分子有_______ (任写一种)。
(4) 水溶液可作为工业零件淬火的冷却介质。已知
水溶液可作为工业零件淬火的冷却介质。已知 的熔点为275℃,而
的熔点为275℃,而 的熔点为782℃,两者熔点相差较大,其原因是
的熔点为782℃,两者熔点相差较大,其原因是_______ 。
(5) 是一种性能优异的荧光材料,在自然界中有立方
是一种性能优异的荧光材料,在自然界中有立方 和六方
和六方 两种晶型,其晶胞结构如下图所示:
两种晶型,其晶胞结构如下图所示:

①立方 中,
中, 填充在
填充在 形成的
形成的_______ 空隙中;
②六方 的晶体密度为
的晶体密度为_______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为(2)一种香豆素衍生物(
 )可作为测定
)可作为测定 的荧光探针,其原理如下图所示。已知
的荧光探针,其原理如下图所示。已知 中
中 结构的异构化和旋转会导致荧光减弱。
结构的异构化和旋转会导致荧光减弱。
①
 所含元素(C、H、O、N)电负性从大到小的顺序为
所含元素(C、H、O、N)电负性从大到小的顺序为②
 中N原子的杂化类型为
中N原子的杂化类型为③加入
 后,体系荧光增强的原因是
后,体系荧光增强的原因是(3)
 可用于配制炉甘石洗剂,具有收敛和保护皮肤的作用。
可用于配制炉甘石洗剂,具有收敛和保护皮肤的作用。 中阴离子
中阴离子 的空间构型为
的空间构型为 互为等电子体的分子有
互为等电子体的分子有(4)
 水溶液可作为工业零件淬火的冷却介质。已知
水溶液可作为工业零件淬火的冷却介质。已知 的熔点为275℃,而
的熔点为275℃,而 的熔点为782℃,两者熔点相差较大,其原因是
的熔点为782℃,两者熔点相差较大,其原因是(5)
 是一种性能优异的荧光材料,在自然界中有立方
是一种性能优异的荧光材料,在自然界中有立方 和六方
和六方 两种晶型,其晶胞结构如下图所示:
两种晶型,其晶胞结构如下图所示:
①立方
 中,
中, 填充在
填充在 形成的
形成的②六方
 的晶体密度为
的晶体密度为 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子层排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层上只有未成对电子,其内层所有轨道全部充满,但并不是第ⅠA族元素。回答下列问题:
(1)基态G原子的价电子排布式为_______ 。第三周期基态原子未成对电子数与G相同且电负性最大的元素是_______ (填元素名称),GQ受热分解生成G2Q和Q2,请从原子结构角度说明GQ受热易分解的原因_______ 。
(2)Z、Q、M三种元素的第一电离能从大到小的顺序为_______ (填元素符号)
(3)X与Q形成原子个数比为1:1的化合物的化学式为_______ 。
(4)Z、M、E所形成的简单离子的半径由大到小的顺序为_______ (填离子符号)
(5)X、Y、Z、Q的电负性由大到小的顺序为_______ (填元素符号)
(1)基态G原子的价电子排布式为
(2)Z、Q、M三种元素的第一电离能从大到小的顺序为
(3)X与Q形成原子个数比为1:1的化合物的化学式为
(4)Z、M、E所形成的简单离子的半径由大到小的顺序为
(5)X、Y、Z、Q的电负性由大到小的顺序为
您最近一年使用:0次
【推荐1】过渡金属元素在工业生产中发挥着重要作用。技术人员晒制蓝图时,用K3[Fe(C2O4)3]●3H2O(三草酸合铁酸钾晶体)作感光剂,再以K3[Fe(CN)6](六氰合铁酸钾)溶液作显影剂。
请回答以下问题:
(1)铁元素位于元素周期表的___________ 区,Fe3+的基态价电子排布图为___________ ;在上述两种钾盐中第一电离能最大的元素为___________ 。
(2)C与Si为同主族元素,高纯硅制备过程中会生成SiHCl3、SiCl4等中间产物。 已知电负性:H>Si,则SiHCl3中H的化合价为___________ ;SiCl4中硅原子的杂化类型是___________ ; 沸点:SiHCl3<SiC14原因是___________ 。
(3)复兴号亚运智能动车组列车材质用到Mn、Co等元素。Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],CH3CN中σ 键与π 键数目之比为___________ ;CH3CN与Mn形成___________ 键。
(4)时速600千米的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图),晶胞参数(晶胞棱长)为a D(1D= 10-10m),其中阴离子(N3-)采用面心立方最密堆积方式,则1个晶胞中含有___________ 个TiN;该氮化钛的密度为___________ g/cm3(列出计算式,阿伏加德罗常数的值为NA)。
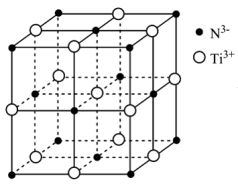
请回答以下问题:
(1)铁元素位于元素周期表的
(2)C与Si为同主族元素,高纯硅制备过程中会生成SiHCl3、SiCl4等中间产物。 已知电负性:H>Si,则SiHCl3中H的化合价为
(3)复兴号亚运智能动车组列车材质用到Mn、Co等元素。Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],CH3CN中σ 键与π 键数目之比为
(4)时速600千米的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图),晶胞参数(晶胞棱长)为a D(1D= 10-10m),其中阴离子(N3-)采用面心立方最密堆积方式,则1个晶胞中含有

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式_____________
(2)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态:①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是_________ (填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(3)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是____ 。
②O3分子的中心原子杂化类型为______ ;与O3互为等电子体的是______ (任意写一种)。
(4)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl 2Na3OCl+H2↑,在该反应中,形成的化学键有
2Na3OCl+H2↑,在该反应中,形成的化学键有_____ (填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(5)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dg·cm−3。

①Na3OCl晶胞中,O位于各顶点位置,Cl位于______ 位置。
②用a、d表示阿伏加 德罗常数的值NA=_____ (列计算式)。
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式
(2)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态:①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是
A.④②①③ B.④②③① C.①②④③ D.①④③②
(3)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是
②O3分子的中心原子杂化类型为
(4)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl
 2Na3OCl+H2↑,在该反应中,形成的化学键有
2Na3OCl+H2↑,在该反应中,形成的化学键有A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(5)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dg·cm−3。

①Na3OCl晶胞中,O位于各顶点位置,Cl位于
②用a、d表示阿伏加 德罗常数的值NA=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
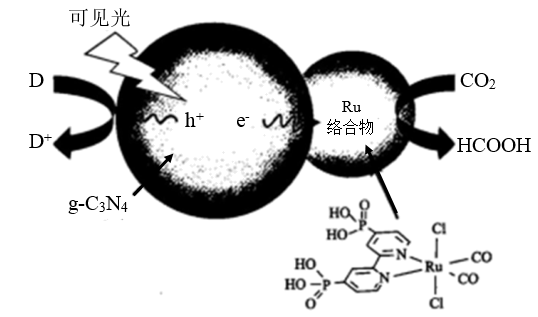
【推荐3】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图。
(1)基态碳原子的价电子排布图为___________ 。
(2)1molHCOOH中含有的σ键数目为___________ ,HCOOH的沸点比CO2高的原因为___________ 。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___________ 。
(4)Ru络合物中与Ru配位的原子有N、___________ 。
(5)一类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
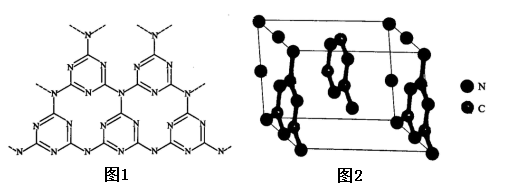
①g-C3N4中氮原子的杂化类型是______________ 。
②根据图2,在图1中用平行四边形画出一个最小重复单元。______________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加 德罗常数的值为NA,则g-C3N4的密度为______________ g.cm-3。

(1)基态碳原子的价电子排布图为
(2)1molHCOOH中含有的σ键数目为
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为
(4)Ru络合物中与Ru配位的原子有N、
(5)一类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是
②根据图2,在图1中用平行四边形画出一个最小重复单元。
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加 德罗常数的值为NA,则g-C3N4的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铜氨溶液含有 ,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
(1) 溶液呈蓝色是因为含有水合铜离子
溶液呈蓝色是因为含有水合铜离子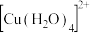 ,结构示意图如图所示:基态
,结构示意图如图所示:基态 原子核外电子排布式为
原子核外电子排布式为_______ 。
向 溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含
溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含 的铜氨溶液。
的铜氨溶液。
①比较键角:NH3_______ NH (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
②该实验中, 与
与 结合能力
结合能力_______ (填“大于”“小于”或“等于”) 与
与 结合能力,解释原因:
结合能力,解释原因:_______ 。
③经实验发现:金属铜与氨水和过氧化氢的混合溶液反应也可得到 。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是_______ ,反应的离子方应程式为_______ 。
(3)某种铜的氯化物晶胞形状为立方体,结构如图所示。
已知该晶胞的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 。则该晶胞的边长为
。则该晶胞的边长为_______  (列出计算式)。
(列出计算式)。
 ,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。(1)
 溶液呈蓝色是因为含有水合铜离子
溶液呈蓝色是因为含有水合铜离子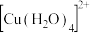 ,结构示意图如图所示:基态
,结构示意图如图所示:基态 原子核外电子排布式为
原子核外电子排布式为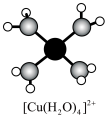
向
 溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含
溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含 的铜氨溶液。
的铜氨溶液。①比较键角:NH3
 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。②该实验中,
 与
与 结合能力
结合能力 与
与 结合能力,解释原因:
结合能力,解释原因:③经实验发现:金属铜与氨水和过氧化氢的混合溶液反应也可得到
 。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是(3)某种铜的氯化物晶胞形状为立方体,结构如图所示。
已知该晶胞的密度为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 。则该晶胞的边长为
。则该晶胞的边长为 (列出计算式)。
(列出计算式)。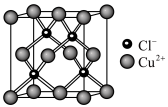
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】Cu是生活中常见的金属元素,在材料、农业、医药等领域具有广泛应用。回答下列问题:
(1)Cu位于周期表的___________ 区;从结构角度分析,比较Cu+与Cu2+的稳定性并说明原因___________ 。
(2)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。

X中Cu2+的配位数是___________ ,两种配体分别为___________ 。
(3)CuFeS2晶体属四方晶系,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。M点、N点原子的分数坐标分别为(0,0,0)、 。下图中B所示结构单元不能作为CuFeS2晶胞的原因是
。下图中B所示结构单元不能作为CuFeS2晶胞的原因是___________ ,X点硫原子的分数坐标为___________ ,晶胞中四面体空隙的占有率为___________ ,晶胞中硫原子间的最短距离为___________ pm。

(1)Cu位于周期表的
(2)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。

X中Cu2+的配位数是
(3)CuFeS2晶体属四方晶系,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。M点、N点原子的分数坐标分别为(0,0,0)、
 。下图中B所示结构单元不能作为CuFeS2晶胞的原因是
。下图中B所示结构单元不能作为CuFeS2晶胞的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】水杨醛亚胺的钴配合物可吸收 形成氧载体,用于燃料油的氧化脱疏。
形成氧载体,用于燃料油的氧化脱疏。
(1)制备钴配合物。向烧瓶中加入水杨醛亚胺(A)、无水乙醇,水浴加热条件下迅速加入醋酸钴溶液。生成的沉淀冷却至室温后,抽滤,重结晶,干燥,得到水杨醛亚胺的钻配合物(B)。

①基态 核外电子排布式为
核外电子排布式为_______ 。配合物B中的配位原子是_______ 。
②可供选择的实验装置如图所示,应选_______ (填序号)用于制备,理由有_______ 。

③为避免反应过程中生成的钴配合物(B)吸收 ,可采用的方法为
,可采用的方法为_______ 。
(2)制备醋酸钴溶液。利用废钴镍电池的金属电极芯(主要成分Co、Ni,还含少量Fe)可生产醋酸钴溶液。已知: 可将
可将 氧化:
氧化: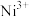 氧化性极强,在水溶液中不存在;在实验条件下,部分阳离子沉淀时溶液
氧化性极强,在水溶液中不存在;在实验条件下,部分阳离子沉淀时溶液 如下表。
如下表。
①酸性溶液中加入 可将
可将 氧化为
氧化为 ,其离子方程式为
,其离子方程式为_______ 。
②请补充完整实验方案:取一定量已粉碎的电极芯,加入稀 充分溶解后过滤,所得滤液中含
充分溶解后过滤,所得滤液中含 、
、 、
、 ,
,_______ ,加入 ,溶液生成
,溶液生成 沉淀,用
沉淀,用 溶解得到醋酸钴溶液(实验中须使用的试剂:
溶解得到醋酸钴溶液(实验中须使用的试剂: 溶液、稀
溶液、稀 、
、 溶液、
溶液、 溶液)。
溶液)。
 形成氧载体,用于燃料油的氧化脱疏。
形成氧载体,用于燃料油的氧化脱疏。(1)制备钴配合物。向烧瓶中加入水杨醛亚胺(A)、无水乙醇,水浴加热条件下迅速加入醋酸钴溶液。生成的沉淀冷却至室温后,抽滤,重结晶,干燥,得到水杨醛亚胺的钻配合物(B)。

①基态
 核外电子排布式为
核外电子排布式为②可供选择的实验装置如图所示,应选

③为避免反应过程中生成的钴配合物(B)吸收
 ,可采用的方法为
,可采用的方法为(2)制备醋酸钴溶液。利用废钴镍电池的金属电极芯(主要成分Co、Ni,还含少量Fe)可生产醋酸钴溶液。已知:
 可将
可将 氧化:
氧化: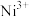 氧化性极强,在水溶液中不存在;在实验条件下,部分阳离子沉淀时溶液
氧化性极强,在水溶液中不存在;在实验条件下,部分阳离子沉淀时溶液 如下表。
如下表。| 沉淀物 |  |  |  |  |  |
| 开始沉淀 | 2.2 | 7.4 | 7.6 | 0.1 | 7.6 |
| 完全沉淀 | 3.2 | 8.9 | 9.4 | 1.1 | 9.2 |
 可将
可将 氧化为
氧化为 ,其离子方程式为
,其离子方程式为②请补充完整实验方案:取一定量已粉碎的电极芯,加入稀
 充分溶解后过滤,所得滤液中含
充分溶解后过滤,所得滤液中含 、
、 、
、 ,
, ,溶液生成
,溶液生成 沉淀,用
沉淀,用 溶解得到醋酸钴溶液(实验中须使用的试剂:
溶解得到醋酸钴溶液(实验中须使用的试剂: 溶液、稀
溶液、稀 、
、 溶液、
溶液、 溶液)。
溶液)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】我国是世界上最早制得和使用铜的国家,铜及其化合物在日常生产和生活中有着广泛的应用。回答下列问题:
(1)Cu在元素周期表中位_______ 区,基态Cu2+价层电子的电子排布图(轨道表达式)为_______ 。
(2)由Cu2+形成的配合物种类繁多,在配离子[Cu(NH3)4]2+中,其配体的立体构型为_______ , 在[Cu(CN)4] 2−中,与其配体互为等电子体的一种分子是_______ (写化学式)。
(3)Cu2+能与吡咯( )的阴离子(
)的阴离子(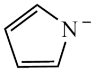 )形成双吡咯铜。
)形成双吡咯铜。
① 中C和N原子的杂化均为
中C和N原子的杂化均为_______ 。
②1mol 含有
含有_______ molσ键,分子中的大π键可用符号π 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π ,则
,则 中的大π键应表示为
中的大π键应表示为_______ 。
(4)试从原子结构角度解释在高温下CuO能分解生成Cu2O的原因_______ 。
(5)高温超导体“钇钡铜氧”广泛应用于超导输电、磁悬浮列车等,其晶胞结构如图:
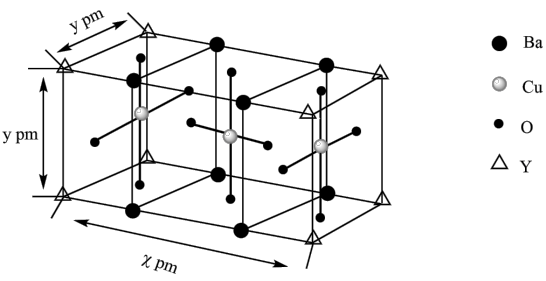
该物质以Y2O3、BaCO3和CuO为原料烧结而成,其原料物质的量之比为_______ ,若阿伏加德罗常数的值为NA,则该晶体的密度为_______ g·cm−3(列出计算表达式)。
(1)Cu在元素周期表中位
(2)由Cu2+形成的配合物种类繁多,在配离子[Cu(NH3)4]2+中,其配体的立体构型为
(3)Cu2+能与吡咯(
 )的阴离子(
)的阴离子( )形成双吡咯铜。
)形成双吡咯铜。①
 中C和N原子的杂化均为
中C和N原子的杂化均为②1mol
 含有
含有 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π ,则
,则 中的大π键应表示为
中的大π键应表示为(4)试从原子结构角度解释在高温下CuO能分解生成Cu2O的原因
(5)高温超导体“钇钡铜氧”广泛应用于超导输电、磁悬浮列车等,其晶胞结构如图:

该物质以Y2O3、BaCO3和CuO为原料烧结而成,其原料物质的量之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】(1)O基态原子核外电子排布式为____ 。H2O VSEPR模型名称为_____ ,立体构型为___ 。O3____ 极性分子(填“是”或“不是”)。
(2)利用热化学法来测定晶格能是由Born与Haber首先提出来的,其实质是利用Hess定律,构成一个热化学循环。
已知:Na(s)+ Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
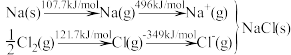
可知,Na原子的第一电离能为_____ kJ·mol-1;Cl-Cl键键能为______ kJ·mol-1;NaCl晶格能为_____ kJ·mol-1。
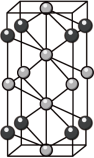
(3)高压下NaCl 晶体和 Na 或 Cl2反应,可以形成不同组成、不同结构的晶体,如图是其中一种晶体的晶胞(大球为氯原子, 小球为钠原子),其化学式为________ 。
(4)金属Na晶体中的原子堆积方式称为体心立方堆积,晶胞参数为a nm,空间利用率为________ (列出计算式)。
(2)利用热化学法来测定晶格能是由Born与Haber首先提出来的,其实质是利用Hess定律,构成一个热化学循环。
已知:Na(s)+
 Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1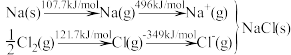
可知,Na原子的第一电离能为
(3)高压下NaCl 晶体和 Na 或 Cl2反应,可以形成不同组成、不同结构的晶体,如图是其中一种晶体的晶胞(大球为氯原子, 小球为钠原子),其化学式为

(4)金属Na晶体中的原子堆积方式称为体心立方堆积,晶胞参数为a nm,空间利用率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】锂碳、铝、铬是重要的元素,在工业生产和科技中有重要的应用。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为_____________ 。
(2)金属锂是锂电池重要的组成部分。Li、Be、B 原子的第一电离能由大到小的顺序为______ 。
(3)LiAlH4是有机合成中常用的还原剂。AlH4-的空间构型为___________ 。
(4)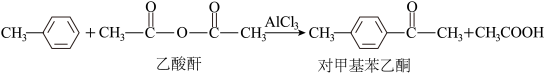
①乙酸酐分子中碳原子轨道的杂化类型为________ 。
②l mol对甲基苯乙酮分子中含有的σ键的数目为_______
③甲苯分子难溶于水的原因是________ 。
(5)已知铬酸钙晶胞如图所示,该晶体密度为ρ g·cm-1,NA是阿伏加 德罗常数的值。Ca离子周围距离最近且相等的O有_____ 个。相邻两个面心氧离子最短核间距(d)为_______ pm。
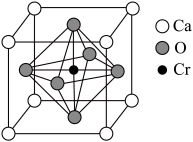
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为
(2)金属锂是锂电池重要的组成部分。Li、Be、B 原子的第一电离能由大到小的顺序为
(3)LiAlH4是有机合成中常用的还原剂。AlH4-的空间构型为
(4)

①乙酸酐分子中碳原子轨道的杂化类型为
②l mol对甲基苯乙酮分子中含有的σ键的数目为
③甲苯分子难溶于水的原因是
(5)已知铬酸钙晶胞如图所示,该晶体密度为ρ g·cm-1,NA是阿伏加 德罗常数的值。Ca离子周围距离最近且相等的O有

您最近一年使用:0次



