我国是世界上最早制得和使用铜的国家,铜及其化合物在日常生产和生活中有着广泛的应用。回答下列问题:
(1)Cu在元素周期表中位_______ 区,基态Cu2+价层电子的电子排布图(轨道表达式)为_______ 。
(2)由Cu2+形成的配合物种类繁多,在配离子[Cu(NH3)4]2+中,其配体的立体构型为_______ , 在[Cu(CN)4] 2−中,与其配体互为等电子体的一种分子是_______ (写化学式)。
(3)Cu2+能与吡咯( )的阴离子(
)的阴离子(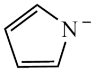 )形成双吡咯铜。
)形成双吡咯铜。
① 中C和N原子的杂化均为
中C和N原子的杂化均为_______ 。
②1mol 含有
含有_______ molσ键,分子中的大π键可用符号π 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π ,则
,则 中的大π键应表示为
中的大π键应表示为_______ 。
(4)试从原子结构角度解释在高温下CuO能分解生成Cu2O的原因_______ 。
(5)高温超导体“钇钡铜氧”广泛应用于超导输电、磁悬浮列车等,其晶胞结构如图:
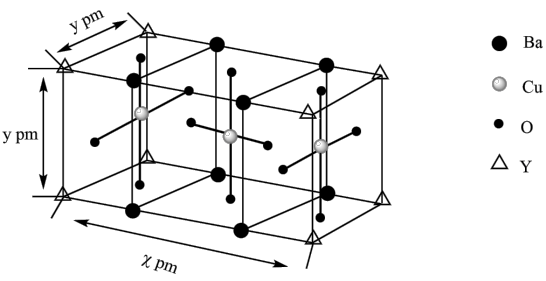
该物质以Y2O3、BaCO3和CuO为原料烧结而成,其原料物质的量之比为_______ ,若阿伏加德罗常数的值为NA,则该晶体的密度为_______ g·cm−3(列出计算表达式)。
(1)Cu在元素周期表中位
(2)由Cu2+形成的配合物种类繁多,在配离子[Cu(NH3)4]2+中,其配体的立体构型为
(3)Cu2+能与吡咯(
 )的阴离子(
)的阴离子( )形成双吡咯铜。
)形成双吡咯铜。①
 中C和N原子的杂化均为
中C和N原子的杂化均为②1mol
 含有
含有 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π ,则
,则 中的大π键应表示为
中的大π键应表示为(4)试从原子结构角度解释在高温下CuO能分解生成Cu2O的原因
(5)高温超导体“钇钡铜氧”广泛应用于超导输电、磁悬浮列车等,其晶胞结构如图:

该物质以Y2O3、BaCO3和CuO为原料烧结而成,其原料物质的量之比为
更新时间:2022-05-15 20:16:43
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】SDIC是一种性能稳定的高效广谱杀菌消毒剂,广泛用于环境水处理、食品加工、公共场所等清洁消毒,结构如图甲所示。其中W、X、Y、R、Z均为短周期元素且原子序数依次增大,Z在同周期主族元素中原子半径最小,且Z与Y位于不同周期。
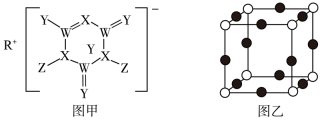
回答下列问题:
(1)SDIC中,电负性最大的元素是___________ (填元素名称)。
(2)某离子晶体中含有X3-和M+两种离子,其中M+核外电子正好充满K、L、M三个能层,则M的元素符号是___________ ,该晶体晶胞结构如图乙所示,则X3-的配位数为___________ 。
(3)X的最简单氢化物分子与1个H+结合形成离子时键角___________ (填“变大”、“变小”或“不变”),原因是___________ 。
(4)SDIC的原子发射光谱中呈现特征颜色的微观原因是___________ 。
(5)在由R和Y的单核离子组成的晶体中,阴离子的排列方式为面心立方最密堆积,阳离子填充在全部的正四面体空隙中。已知晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体密度为___________ g·cm-3(列出计算式)。
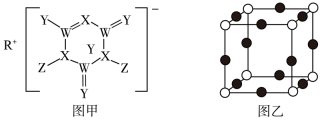
回答下列问题:
(1)SDIC中,电负性最大的元素是
(2)某离子晶体中含有X3-和M+两种离子,其中M+核外电子正好充满K、L、M三个能层,则M的元素符号是
(3)X的最简单氢化物分子与1个H+结合形成离子时键角
(4)SDIC的原子发射光谱中呈现特征颜色的微观原因是
(5)在由R和Y的单核离子组成的晶体中,阴离子的排列方式为面心立方最密堆积,阳离子填充在全部的正四面体空隙中。已知晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】I.价电子对互斥(简称VSEPR)理论可用于预测简单分子的空间结构。请回答下列问题:
(1)利用价电子对互斥理论推断下列分子或离子的空间结构:
①SO
______ ;②PO
______ ;③HCN_______ 。
(2)利用价电子对互斥理论推断键角的大小:
①SnBr2分子中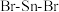 的键角
的键角_______ (填“>”“<”或“=”,下同)120°;
②PCl3分子中 的键角
的键角_______ 109°28′。
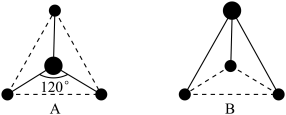
(3)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据图所示的这两种微粒的球棍模型,写出相应的化学式:A:_______ ;B:_______ 。
II.如图表示不同类型共价键形成时原子轨道重叠情况:
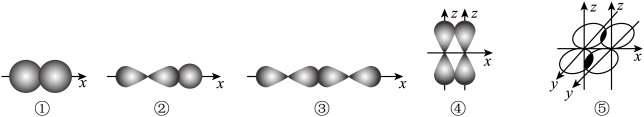
(4)其中形成的化学键属于轴对称的有_______ 。
(5)列物质中,通过方式①形成化学键的是_______ ;通过方式②形成化学键的是_______ ;只通过方式③形成化学键的是_______ ;同时含有③、④、⑤三种方式化学键的物质是_______ 。
A.Cl2 B.HCl C.N2 D.H2
(6)某有机物分子的结构简式为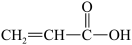 ,该分子中有
,该分子中有_______ 个σ键,有_______ 个π键,有_______ 种极性键,_______ (填“有”或“没有”)非极性键。
(1)利用价电子对互斥理论推断下列分子或离子的空间结构:
①SO


(2)利用价电子对互斥理论推断键角的大小:
①SnBr2分子中
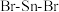 的键角
的键角②PCl3分子中
 的键角
的键角(3)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据图所示的这两种微粒的球棍模型,写出相应的化学式:A:

II.如图表示不同类型共价键形成时原子轨道重叠情况:

(4)其中形成的化学键属于轴对称的有
(5)列物质中,通过方式①形成化学键的是
A.Cl2 B.HCl C.N2 D.H2
(6)某有机物分子的结构简式为
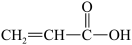 ,该分子中有
,该分子中有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】如图是元素周期表的一部分:
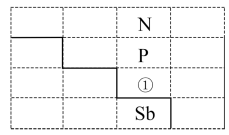
(1)写出元素①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。
(2)基态锑(Sb)原子的价电子排布式为___________ 。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+离子的空间构型为___________ ,写出一种与[H2F]+互为等电子体的分子___________ 。)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由___________ 提供(填元素符号)
(3)下列说法正确的是___________
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,解释GaN、GaP熔点变化原因___________ 。
(5)GaN晶胞结构如图1所示,已知六棱柱底边边长为a cm。
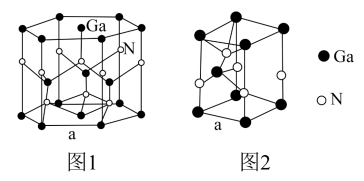
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为___________ ;
②从GaN晶体中分割出的平行六面体如图2.若该平行六面体的体积为 a3 cm3,GaN晶体的密度为
a3 cm3,GaN晶体的密度为___________ g/cm3 (用a、NA表示)。

(1)写出元素①的元素符号
(2)基态锑(Sb)原子的价电子排布式为
(3)下列说法正确的是___________
| A.N2H4分子中含5个σ键和1个π键 |
| B.基态P原子中,电子占据的最高能级符号为M |
| C.Sb 位于p区 |
| D.升温实现:液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键 |
| 物质 | GaN | GaP |
| 熔点/℃ | 1700 | 1480 |
(5)GaN晶胞结构如图1所示,已知六棱柱底边边长为a cm。

①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为
②从GaN晶体中分割出的平行六面体如图2.若该平行六面体的体积为
 a3 cm3,GaN晶体的密度为
a3 cm3,GaN晶体的密度为
您最近一年使用:0次
【推荐1】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理”的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的电子排布式是[Ar]__ 。氮化镓是一种新型材料,可把手机信号放大10倍,氮化镓的功效与电子跃迁有关,而元素的光谱也与电子的跃迁有关。下列变化过程不会产生原子光谱的是__ (填字母序号)。
A.[Ar]3d44s2→[Ar]3d54s1
B.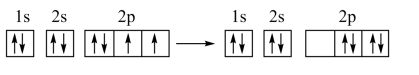
C.
D.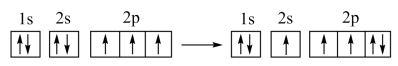
(2)锂离子电池是现代高性能电池的代表,LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为___ ,P、O、S的第一电离能从大到小的顺序为___ 。
(3)在硫酸铜溶液中加入过量KCN,可生成配位化合物离子[Cu(CN)4]2-,则1mol[Cu(CN)4]2-中含有的σ键的数目为___ ;写出一种与CN-互为等电子体的单质的分子式___ 。
(4)钙和钴都是第四周期元素,且原子的最外层电子数相同,钴的熔沸点远高于钙,其原因是___ 。
(5)Na2S的晶胞结构如图所示。已知Na+的半径为0.102nm,S2-的半径为0.184nm,则Na2S的晶胞参数a=___ cm(列出计算式即可)。
(1)基态Ga原子的电子排布式是[Ar]
A.[Ar]3d44s2→[Ar]3d54s1
B.

C.

D.

(2)锂离子电池是现代高性能电池的代表,LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为
(3)在硫酸铜溶液中加入过量KCN,可生成配位化合物离子[Cu(CN)4]2-,则1mol[Cu(CN)4]2-中含有的σ键的数目为
(4)钙和钴都是第四周期元素,且原子的最外层电子数相同,钴的熔沸点远高于钙,其原因是
(5)Na2S的晶胞结构如图所示。已知Na+的半径为0.102nm,S2-的半径为0.184nm,则Na2S的晶胞参数a=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】X是合成碳酸二苯酯的一种有效的氧化还原催化助剂,可由EDTA与Fe3+反应得到。
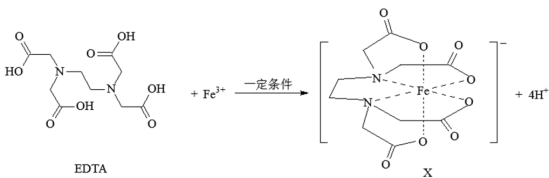
(1)EDTA中碳原子杂化轨道类型为___ ;EDTA中四种元素的电负性由小到大的顺序为___ 。
(2)NH5是离子化合物,各原子均满足2电子或8电子稳定结构,NH5的电子式是___ 。
(3)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点(540.6℃)比正二十一烷的沸点(100℃)高的原因是___ 。
(4)1mol碳酸分子中含有σ键的数目为___ 。
(5)X中的配位原子是___ 。
(6)Mo能与CO形成化学式为Mo(CO)6的配合物,其中Mo的化合价为___ ,其配体分子与N2具有相似的化学结构,则该配体分子中σ键与π键数目之比为__ 。

(1)EDTA中碳原子杂化轨道类型为
(2)NH5是离子化合物,各原子均满足2电子或8电子稳定结构,NH5的电子式是
(3)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点(540.6℃)比正二十一烷的沸点(100℃)高的原因是
(4)1mol碳酸分子中含有σ键的数目为
(5)X中的配位原子是
(6)Mo能与CO形成化学式为Mo(CO)6的配合物,其中Mo的化合价为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】回答下列问题:
(1)钌(Ru)基催化剂在低温下活性高,工业上常用该催化剂替代铁系催化剂催化合成氨,以RuCl3/SiO2为模板制备钌基催化剂及催化合成氨过程如图所示,请回答下列问题。
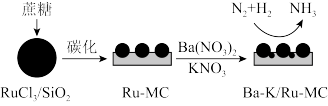
Ru在Fe的下一周期且与Fe同族。
①Ru在元素周期表中的位置为____ 。
②一个基态Fe2+和Fe3+未成对电子数之比为____ 。
③NH3的键角____ (填“大于”或“小于”)PH3,其原因为____ 。
④NO 有多种等电子体,其中和NO
有多种等电子体,其中和NO 互为等电子体的分子有
互为等电子体的分子有___ 。
⑤多原子分子中,若原子都在同一平面上,且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成大π键。大π元键可用π 表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO
表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO 的大π元键可表示为
的大π元键可表示为___ 。
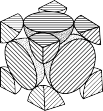
(2)经X射线衍射测定发现,晶体钻在417℃以上堆积方式的剖面图如图所示,则晶体钴堆积方式为____ ,钴原子的配位数是____ ,若该堆积方式下的晶胞参数为acm,(阿伏加德罗常数为NA),则钴原子的半径为___ pm。
(1)钌(Ru)基催化剂在低温下活性高,工业上常用该催化剂替代铁系催化剂催化合成氨,以RuCl3/SiO2为模板制备钌基催化剂及催化合成氨过程如图所示,请回答下列问题。
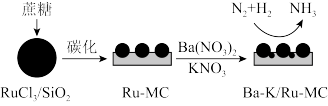
Ru在Fe的下一周期且与Fe同族。
①Ru在元素周期表中的位置为
②一个基态Fe2+和Fe3+未成对电子数之比为
③NH3的键角
④NO
 有多种等电子体,其中和NO
有多种等电子体,其中和NO 互为等电子体的分子有
互为等电子体的分子有⑤多原子分子中,若原子都在同一平面上,且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成大π键。大π元键可用π
 表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO
表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO 的大π元键可表示为
的大π元键可表示为(2)经X射线衍射测定发现,晶体钻在417℃以上堆积方式的剖面图如图所示,则晶体钴堆积方式为

您最近一年使用:0次
【推荐1】储氢材料是科学研究的热点之一。
(1)无机盐储氢原理:NaHCO3(s)+H2(g)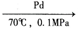 HCOONa+H2O,HCOONa中的化学键类型有
HCOONa+H2O,HCOONa中的化学键类型有____ ;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________ 。
(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2 C6H12(环己烷);C6H5-CH3(甲苯)+3H2
C6H12(环己烷);C6H5-CH3(甲苯)+3H2 C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)
①甲苯分子中碳原子的杂化类型是__________ ;
②能体现环己烷分子的空间构型的键线式为____________ 。
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2 TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为______________ ,CO与N2互为等电子体,标准状况下,VL CO分子形成Ni(CO)4中含o键数目为________ 。
②基态钛原子中电子能量最高的电子排布图为_________
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为_______ 已知钛的氧化物晶胞参数为a·10-3μm,NA代表阿伏伽德罗常数的值,则该晶体的密度为_______ g·cm-3。
(1)无机盐储氢原理:NaHCO3(s)+H2(g)
 HCOONa+H2O,HCOONa中的化学键类型有
HCOONa+H2O,HCOONa中的化学键类型有(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2
 C6H12(环己烷);C6H5-CH3(甲苯)+3H2
C6H12(环己烷);C6H5-CH3(甲苯)+3H2 C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)①甲苯分子中碳原子的杂化类型是
②能体现环己烷分子的空间构型的键线式为
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2
 TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为
②基态钛原子中电子能量最高的电子排布图为
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】卤族元素能形成多种物质。
(1)基态Br原子的核外电子排布式为[Ar]_________________ ,有_______ 个未成对电子。
(2)比较下列卤化钠的熔点和沸点,分析其变化规律及原因:_______________________ 。
(3)SnCl2的链状聚合结构式如图所示,其中存在的化学键是_____________ 。
(4)氧氰[(OCN)2]是一种拟卤素,其结构式为N≡C-O-O-C≡N。1mol(OCN)2分子中含有σ键的数目为_______ 个;其中C原子的杂化方式为_________ ;O、C、N第一电离能由大到小的顺序为_________ 。
(5)如图为一种铜的溴化物晶胞,晶胞参数为apm。
①晶胞中,Br原子采取A1型最密堆积,则Br的原子半径是_________ pm(用含a的计算式表示,下同)。
②该铜的溴化物密度为________ g·cm-3。
(1)基态Br原子的核外电子排布式为[Ar]
(2)比较下列卤化钠的熔点和沸点,分析其变化规律及原因:
| 卤化物 | NaCl | NaBr | NaI |
| 熔点/K | 1074 | 1020 | 934 |
| 沸点/K | 1686 | 1663 | 1577 |
(3)SnCl2的链状聚合结构式如图所示,其中存在的化学键是
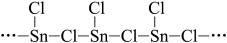
(4)氧氰[(OCN)2]是一种拟卤素,其结构式为N≡C-O-O-C≡N。1mol(OCN)2分子中含有σ键的数目为
(5)如图为一种铜的溴化物晶胞,晶胞参数为apm。
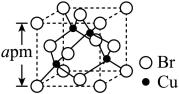
①晶胞中,Br原子采取A1型最密堆积,则Br的原子半径是
②该铜的溴化物密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
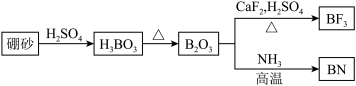
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________ 、________________________ ;
(2)基态B原子的电子排布式为________ ;B和N相比,电负性较大的是________ ,BN中B元素的化合价为________ ;
(3)在BF3分子中,F—B—F的键角是________ ,B原子的杂化轨道类型为________ ,BF3和过量NaF作用可生成NaBF4, 的立体构型为________ ;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为__________ ,层间作用力为________________________ ;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________ 个氮原子、________ 个硼原子,立方氮化硼的密度是________ g·cm-3 (只要求列算式,不必计算出数值,阿伏加 德罗常数为NA)。

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F—B—F的键角是
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】《化学世界》刊载了我国科学家的研究成果:在钴锰氧化物(Co,Mn)3O4的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。
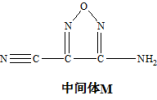
回答下列问题:
(1)基态钴原子价层电子排布式为___ 。基态锰原子有___ 种空间运动状态不同的电子。
(2)中间体M分子中,碳原子的杂化类型是___ 。
(3)Co3+、Co2+能与NH3、H2O、SCN-等配体组成配合物。
①1 mol [Co(NH3)6]3+含σ键数目为___ 。
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式[S=C=N]-,SCN-与金属离子形成的配合物中配位原子是___ 。
(4)第三电离能(I3):Mn>Fe,理由是___ 。
(5)KMnF3晶体有钙钛矿型的立方结构,晶胞结构如图1所示。
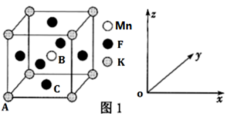
①若原子坐标参数A为(0,0,0);B为( ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为___ 。
②若阿伏加德罗常数的值为NA,晶胞参数为a nm,则晶体密度为___ g•cm-3。
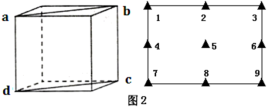
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为___ (填阿拉伯数字序号)。

回答下列问题:
(1)基态钴原子价层电子排布式为
(2)中间体M分子中,碳原子的杂化类型是
(3)Co3+、Co2+能与NH3、H2O、SCN-等配体组成配合物。
①1 mol [Co(NH3)6]3+含σ键数目为
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式[S=C=N]-,SCN-与金属离子形成的配合物中配位原子是
(4)第三电离能(I3):Mn>Fe,理由是
(5)KMnF3晶体有钙钛矿型的立方结构,晶胞结构如图1所示。


①若原子坐标参数A为(0,0,0);B为(
 ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为②若阿伏加德罗常数的值为NA,晶胞参数为a nm,则晶体密度为
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】稀土是重要的战略资源,在目前已探明的稀土储量中,我国居第一。我国已经形成了对全球稀土产业链的统治力,在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才能实现产出。我国科学家最早研究的是稀土——钴化合物的结构。请回答下列问题:
(1)钴原子的核外电子排布式为___ ,其M层上共有__ 个不同运动状态的电子。
(2)酞菁钴的结构如图所示。
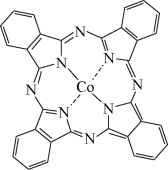
①酞菁钴中C原子的杂化类型是___ 。
②酞菁钴中所含元素原子的第一电离能由小到大的顺序是___ 。
③酞菁钴中三种非金属原子的电负性由大到小的顺序为___ 。
④酞菁钴中N、C原子分别与H原子可形成N2H4和C2H4,试判断其沸点的高低:N2H4__ C2H4(填“>”或“<”),其原因是__ 。
(3)[Co(NH3)6]3+的几何构型与氯化钠晶胞中钠离子占据的空隙类型相同,则其几何构型为___ ,若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成__ 种不同的结构。
(4)稀土钴系(Sm-Co)永磁合金的六方晶胞结构如图所示。已知同一层的Sm-Sm的最近距离为apm,不同层间Sm-Sm的最近距离为bpm。

①Sm-Co永磁合金的化学式为___ 。
②已知阿伏加 德罗常数的值为NA,则该合金的密度ρ为___ g/cm3(列出计算表达式)。
(1)钴原子的核外电子排布式为
(2)酞菁钴的结构如图所示。

①酞菁钴中C原子的杂化类型是
②酞菁钴中所含元素原子的第一电离能由小到大的顺序是
③酞菁钴中三种非金属原子的电负性由大到小的顺序为
④酞菁钴中N、C原子分别与H原子可形成N2H4和C2H4,试判断其沸点的高低:N2H4
(3)[Co(NH3)6]3+的几何构型与氯化钠晶胞中钠离子占据的空隙类型相同,则其几何构型为
(4)稀土钴系(Sm-Co)永磁合金的六方晶胞结构如图所示。已知同一层的Sm-Sm的最近距离为apm,不同层间Sm-Sm的最近距离为bpm。

①Sm-Co永磁合金的化学式为
②已知阿伏加 德罗常数的值为NA,则该合金的密度ρ为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】铁、钴、镍位于元素周期表中第四周期第Ⅷ族,它们的单质及其化合物在化工生产中用途广泛.回答下列问题:
(1)基态铁原子价电子排布图为________________ ;第四周期元素中基态原子未成对电子数与钴相同的还有________ (填元素符号);
(2)向含 的溶液中加入过量氨水,最终会得到黄色的
的溶液中加入过量氨水,最终会得到黄色的 ,在空气中易被氧化为橙黄色的
,在空气中易被氧化为橙黄色的 ;
;
①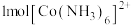 中含有
中含有 键的物质的量为
键的物质的量为________ ; 中存在
中存在________ (填选项字母);
A. 键 B.离子键 C.配位键 D.金属键
键 B.离子键 C.配位键 D.金属键
②与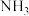 相比,
相比, 中的
中的
________ (填“较大”或“较小”),原因为________________ ;
③ 被氧化为
被氧化为 的离子方程式为
的离子方程式为________________ ;
(3)由钾、镍、氟三种元素组成的某晶体常应用于光化学领域,其四方晶胞结构及晶胞参数如图.该晶体中镍的配位数为________ ;设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为________ 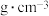 (列出计算式即可);
(列出计算式即可);
(1)基态铁原子价电子排布图为
(2)向含
 的溶液中加入过量氨水,最终会得到黄色的
的溶液中加入过量氨水,最终会得到黄色的 ,在空气中易被氧化为橙黄色的
,在空气中易被氧化为橙黄色的 ;
;①
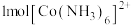 中含有
中含有 键的物质的量为
键的物质的量为 中存在
中存在A.
 键 B.离子键 C.配位键 D.金属键
键 B.离子键 C.配位键 D.金属键②与
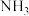 相比,
相比, 中的
中的
③
 被氧化为
被氧化为 的离子方程式为
的离子方程式为(3)由钾、镍、氟三种元素组成的某晶体常应用于光化学领域,其四方晶胞结构及晶胞参数如图.该晶体中镍的配位数为
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为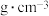 (列出计算式即可);
(列出计算式即可);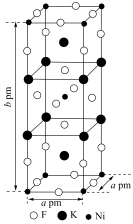
您最近一年使用:0次



