不同温度下,三个体积均为1L的密闭容器中发生反应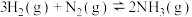

 。实验测得起始、平衡时的有关数据如下表。下列说法正确的是
。实验测得起始、平衡时的有关数据如下表。下列说法正确的是

 。实验测得起始、平衡时的有关数据如下表。下列说法正确的是
。实验测得起始、平衡时的有关数据如下表。下列说法正确的是| 容器编号 | 温度(K) | 起始物质的量/mol | 平衡物质的量/mol | ||
 |  |  |  | ||
| Ⅰ |  | 3 | 1 | 0 | 2.4 |
| Ⅱ |  | 1.2 | 0.4 | 0.2 | 1.2 |
| Ⅲ |  | 2 | 0.2 | 0.2 | |
| A.容器Ⅲ中的反应起始时向逆反应方向进行 | B. |
| C.平衡时,容器Ⅰ中反应放出的热量为55.56kJ | D.容器Ⅰ和容器Ⅱ中反应的化学平衡常数相同 |
更新时间:2023-10-13 16:04:45
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】关于如图所示转化关系(X代表卤素),说法不正确的是


A. △H3<0 △H3<0 |
B.反应热与反应的途径无关,所以 |
C. 键、 键、 键、 键、 键键能依次减小,所以途径Ⅱ吸收的热量依次增多 键键能依次减小,所以途径Ⅱ吸收的热量依次增多 |
| D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列说法正确的是
②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,
则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,
则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.甲烷燃烧热的热化学方程式CH4(g) + 2O2(g) = CO2(g) +2H2O(g)ΔH= -Q kJ·mol-1 |
| C.已知:①2H2(g)+O2(g)=2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l)ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1, |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】下列关于化学平衡的说法不正确的是
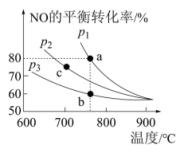

A. ,达到平衡时, ,达到平衡时,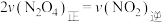 |
B.恒温恒容条件下,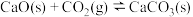 ,容器中含足量 ,容器中含足量 和 和 固体,达到平衡后再充入 固体,达到平衡后再充入 ,达到新平衡时容器内的压强不变 ,达到新平衡时容器内的压强不变 |
C.恒温恒压下,在一容积可变的容器中, 达到平衡时, 达到平衡时, 、 、 、 、 各 各 ,若此时再充入 ,若此时再充入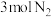 ,则平衡正向移动 ,则平衡正向移动 |
D.一定条件下,在密闭容器中充入等物质的量的CO和NO,发生反应 测得NO的平衡转化率与温度及压强的关系如上图所示。NO的物质的量浓度:b点<a点 测得NO的平衡转化率与温度及压强的关系如上图所示。NO的物质的量浓度:b点<a点 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】 催化加氢是碳中和的重要手段之一,以下是
催化加氢是碳中和的重要手段之一,以下是 加氢时发生的两个主要反应:
加氢时发生的两个主要反应:
反应Ⅰ: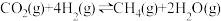
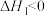
反应Ⅱ:
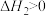
在体积为1L的两个恒容密闭容器中分别按表中所示充入一定量的 和H2,平衡体系中物质的量分数X(CO)和X(CH4)[
和H2,平衡体系中物质的量分数X(CO)和X(CH4)[ 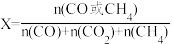 ]随温度变化关系如图所示。
]随温度变化关系如图所示。
 催化加氢是碳中和的重要手段之一,以下是
催化加氢是碳中和的重要手段之一,以下是 加氢时发生的两个主要反应:
加氢时发生的两个主要反应:反应Ⅰ:
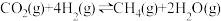
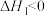
反应Ⅱ:

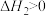
在体积为1L的两个恒容密闭容器中分别按表中所示充入一定量的
 和H2,平衡体系中物质的量分数X(CO)和X(CH4)[
和H2,平衡体系中物质的量分数X(CO)和X(CH4)[ 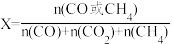 ]随温度变化关系如图所示。
]随温度变化关系如图所示。| 容器 | 起始物质的量/mol | |
| CO2 | H2 | |
| 甲 | 0.1 | 0.3 |
| 乙 | 1 | 3 |
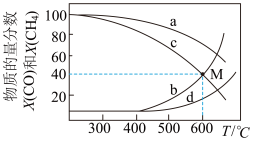
A.随着温度升高,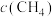 增大 增大 |
| B.曲线d表示甲容器中X(CO)随温度的变化 |
| C.600℃达到平衡时,甲容器中反应Ⅱ的平衡常数为2.4 |
D.M点对应 的总转化率为40% 的总转化率为40% |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】如图所示,关闭K,向甲中充入2molX(g)和2molY(g),向乙中充入1molX(g)和1molY(g),起始 ,在相同温度下,两容器中均发生反应
,在相同温度下,两容器中均发生反应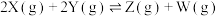
 。打开K,反应达到平衡时,
。打开K,反应达到平衡时,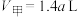 。下列说法正确的是
。下列说法正确的是
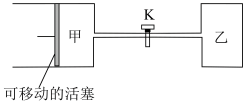
 ,在相同温度下,两容器中均发生反应
,在相同温度下,两容器中均发生反应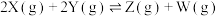
 。打开K,反应达到平衡时,
。打开K,反应达到平衡时,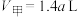 。下列说法正确的是
。下列说法正确的是
A.若不打开K,则平衡后,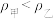 |
B.若不打开K,反应达到平衡时,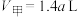 |
| C.打开K,反应达到平衡后,W的物质的量分数为12.5% |
| D.打开K,反应达到平衡后,n(反应物)=4n(生成物) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列有关说法正确的是
 N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A.反应在0~3 s内的平均速率v(NO2)=0.24 mol·L−1·s−1 |
| B.在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍 |
| C.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L−1,则反应的ΔH>0 |
| D.在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20% |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】25℃时,将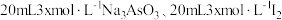 和
和 溶液混合,发生反应:
溶液混合,发生反应: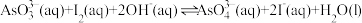 。溶液中
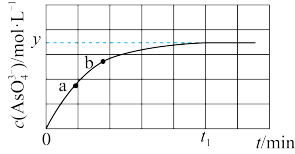
。溶液中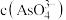 与反应时间
与反应时间 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
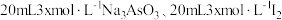 和
和 溶液混合,发生反应:
溶液混合,发生反应: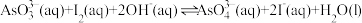 。溶液中
。溶液中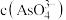 与反应时间
与反应时间 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A. 用 用 表示的平均反应速率为 表示的平均反应速率为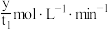 |
B.当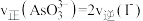 时,反应达到平衡状态 时,反应达到平衡状态 |
| C.a点的逆反应速率小于b点的正反应速率 |
D.平衡时溶液的 ,则该反应的平衡常数 ,则该反应的平衡常数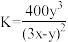 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】一定温度下,在甲、乙、丙三个体积均为10L的恒容密闭容器中分别发生反应 ,实验过程中测得的相关数据如下表所示。下列说法错误的是
,实验过程中测得的相关数据如下表所示。下列说法错误的是
 ,实验过程中测得的相关数据如下表所示。下列说法错误的是
,实验过程中测得的相关数据如下表所示。下列说法错误的是| 容器 | 温度/℃ | 物质的起始加入量 | 平衡时Z的物质的量 |
| 甲 | 1000 | 1molX、1molY、0molZ | 0.6mol |
| 乙 | 1000 | 2molX、2molY、0molZ | |
| 丙 | 1200 | 0molX、0molY、1molZ | 0.5mol |
| A.该反应的正反应放热 |
| B.平衡时逆反应速率:v(丙)>v(甲) |
| C.平衡时Z的物质的量:n(乙)>2n(甲) |
D.1200℃时,该反应的平衡常数 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】羰基硫(COS)常用作粮食熏蒸剂,制取反应为 CO(g)+H2S(g)  COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
下列说法错误的是
 COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。| 实验 | 温度/℃ | n起始/mol | 平衡时 | 所需时间 | |||
| CO | H2S | COS | H2 | n(CO)/mol | min | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 | e |
| 2 | 150 | 7.0 | 7.0 | 3.0 | 3.0 | a | f |
| 3 | 200 | 20.0 | 20.0 | 0 | 0 | 16.0 | g |
| A.实验1 反应开始到平衡整个过程中放出的热量为 90kJ |
| B.实验2 达平衡时,a>7.0 |
| C.实验3 时间:g<e |
| D.实验3 CO 达到平衡时的转化率比实验1 小 |
您最近一年使用:0次

 B(g) ΔH<0。达平衡后再向容器中充入a mol A,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
B(g) ΔH<0。达平衡后再向容器中充入a mol A,再次达到平衡后,与原平衡比较,下列叙述不正确的是( ) xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是


