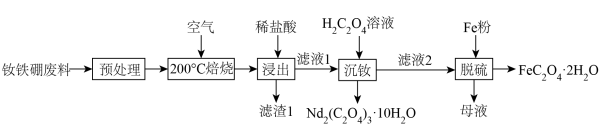
钕铁硼废料是一种具有较高经济价值的废弃物,主要成分为稀土元素钕(Nd)、Fe、B.一种采用分步沉淀从钕铁硼油泥中回收Nd2(C2O4)3·10H2O和FeC2O4·2H2O的工艺流程如图:
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择___________ (填化学式)溶液。
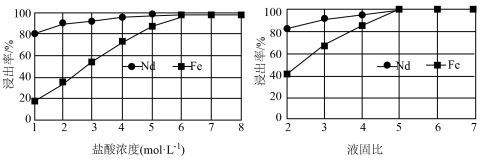
(2)“滤渣1”的主要成分是___________ (填名称)。“浸出”时,盐酸浓度和液固比对钕、铁的浸出率影响如图所示,则浸出过程的最佳条件是___________ 。___________ 。
(4)“沉铁”时,加入铁粉的作用是___________ 。
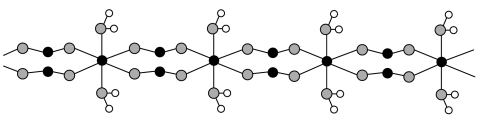
(5)FeC2O4·2H2O晶体结构片段如图所示。___________ ;碳原子采用___________ 杂化。现测定草酸亚铁晶体纯度。准确称取Wg样品于锥形瓶,加入适量的稀硫酸,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液bmL。滴定反应: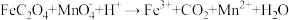 (未配平)。该样品纯度为
(未配平)。该样品纯度为___________ %。
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择
(2)“滤渣1”的主要成分是
(4)“沉铁”时,加入铁粉的作用是
(5)FeC2O4·2H2O晶体结构片段如图所示。
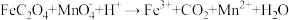 (未配平)。该样品纯度为
(未配平)。该样品纯度为
更新时间:2023-11-01 17:00:21
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
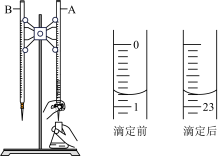
【推荐1】I.如图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答下列问题:
(1)仪器A的名称是___________ ;
(2)消耗盐酸的体积___________ mL。
(3)实验操作可分解为如下几步:
①移取15.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2~3滴酚酞
②用标准溶液润洗酸式滴定管2~3次
③把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准盐酸溶液注入酸式滴定管至0刻度以上2~3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
正确操作的顺序是(填序号)②→_____→_____→____→①→____,___________ 。
(4)对下列几种假定情况进行讨论(填“偏高”“偏低”或“无影响”):
①若滴定前锥形瓶未用待测液润洗,对测定结果的影响是___________ ;
②标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是___________ 。
II.工业废水中常含有一定量氧化性较强的 ,利用滴定原理测定
,利用滴定原理测定 含量方法如下:
含量方法如下:
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应: + 6I-+14H+ = 2Cr3+ + 3I2 + 7H2O。
+ 6I-+14H+ = 2Cr3+ + 3I2 + 7H2O。
步骤III:向锥形瓶中滴入几滴淀粉溶液。用滴定管量取0.1000mol·L-1Na2S2O3溶液进行滴定,已知反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6,数据记录如下:
(5)步骤III中滴定达到终点的实验现象是______________________ 。
(6)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的 的含量为
的含量为___________ mol·L-1。

请回答下列问题:
(1)仪器A的名称是
(2)消耗盐酸的体积
(3)实验操作可分解为如下几步:
①移取15.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2~3滴酚酞
②用标准溶液润洗酸式滴定管2~3次
③把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准盐酸溶液注入酸式滴定管至0刻度以上2~3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
正确操作的顺序是(填序号)②→_____→_____→____→①→____,
(4)对下列几种假定情况进行讨论(填“偏高”“偏低”或“无影响”):
①若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
②标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是
II.工业废水中常含有一定量氧化性较强的
 ,利用滴定原理测定
,利用滴定原理测定 含量方法如下:
含量方法如下:步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应:
 + 6I-+14H+ = 2Cr3+ + 3I2 + 7H2O。
+ 6I-+14H+ = 2Cr3+ + 3I2 + 7H2O。步骤III:向锥形瓶中滴入几滴淀粉溶液。用滴定管量取0.1000mol·L-1Na2S2O3溶液进行滴定,已知反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6,数据记录如下:
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | 19.88 |
(5)步骤III中滴定达到终点的实验现象是
(6)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的
 的含量为
的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】铁氰化钾俗称赤血盐,化学式为K3[Fe(CN)6],可溶于水,常用作分析试剂。实验室用Cl2在60~65℃时氧化K4[Fe(CN)6]制备K3[Fe(CN)6]的装置如图所示(夹持装置省略)。回答下列问题:
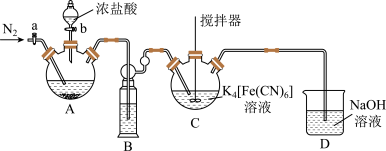
(1)装置B中试剂是___________ ;装置C 最好的加热方式为___________ (填“水浴”或“油浴”),C中反应的离子方程式为___________ 。
(2)反应结束后通入N2一段时间的目的是___________ 。
(3)实验室用于检验溶液中是否含有Fe2+的试剂是:___________ (填“ K3[Fe(CN)6]”或“K4[Fe(CN)6]”)若含有Fe2+,实验现象为:___________ 。
(4)工业上可用铁氰化钾法测定蔗糖(C12H22O11)的水解程度(杂质不参与反应)。
Ⅰ.反应原理:铁氰化钾在碱性溶液中有氧化性,能将葡萄糖(或果糖)氧化,反应的化学方程式为
C6H12O6+6 K3[Fe(CN)6]+6KOH= (CHOH)4·(COOH)2 +6 K4[Fe(CN)6]+4H2O
Ⅱ.实验步骤:
i.称取纯净的蔗糖1.000g,置于锥形瓶中,加入少量水溶解:再加5 mL 2mol·L-1稀硫酸、摇匀,加热20分钟:
ii.向i中所得溶液加入KOH调节pH至碱性;
iii.加入2滴次甲基兰指示剂,用cmol·L-1铁氰化钾标准液滴定,终点时消耗标准液V mL。
已知:铁氰化钾溶液中加入次甲基兰指示剂,溶液迅速变蓝。
①蔗糖的水解程度为___________ %(用含c、V的代数式表示)。
②下列操作会导致测定结果偏低的是___________ (填序号)。
a.配制铁氰化钾溶液时,转移操作未洗涤烧杯
b.溶液变蓝立即读数,后又恢复无色
c.滴定前俯视,滴定后仰视

(1)装置B中试剂是
(2)反应结束后通入N2一段时间的目的是
(3)实验室用于检验溶液中是否含有Fe2+的试剂是:
(4)工业上可用铁氰化钾法测定蔗糖(C12H22O11)的水解程度(杂质不参与反应)。
Ⅰ.反应原理:铁氰化钾在碱性溶液中有氧化性,能将葡萄糖(或果糖)氧化,反应的化学方程式为
C6H12O6+6 K3[Fe(CN)6]+6KOH= (CHOH)4·(COOH)2 +6 K4[Fe(CN)6]+4H2O
Ⅱ.实验步骤:
i.称取纯净的蔗糖1.000g,置于锥形瓶中,加入少量水溶解:再加5 mL 2mol·L-1稀硫酸、摇匀,加热20分钟:
ii.向i中所得溶液加入KOH调节pH至碱性;
iii.加入2滴次甲基兰指示剂,用cmol·L-1铁氰化钾标准液滴定,终点时消耗标准液V mL。
已知:铁氰化钾溶液中加入次甲基兰指示剂,溶液迅速变蓝。
①蔗糖的水解程度为
②下列操作会导致测定结果偏低的是
a.配制铁氰化钾溶液时,转移操作未洗涤烧杯
b.溶液变蓝立即读数,后又恢复无色
c.滴定前俯视,滴定后仰视
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铂、镁在现代工业中有着极为重要的应用,某化工厂从含铂废料(主要成分为Pt,含少量MgO、Fe2O3、Al2O3、SiO2,表面沉积着有机物)中回收铂,并获得MgCl2•6H2O的工艺流程如图所示:
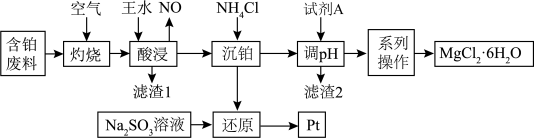
该工艺条件下,相关金属离子开始沉淀和完全沉淀时的pH如表:
(1)灼烧含铂废料最主要的目的是_______ 。
(2)滤渣1的主要成分为______ ,“沉铂”得到的沉淀(NH4)2PtCl6(氯铂酸铵)中铂元素的化合价为______ 。
(3)“还原”步骤中氯铂酸铵沉淀与Na2SO3溶液反应的主要离子方程式为_______ 。
(4)“试剂A”可选用______ ,pH的调控范围为______ 。
a.盐酸 b.NaOH溶液 c.氨水 d.MgO
(5)“系列操作”中最后的步骤为在HCl氛围中结晶,原因是_______ 。
(6)某小组为测定Na2SO3溶液浓度进行以下探究:取25.00mLNa2SO3样品溶液于锥形瓶中,滴入3~4滴稀硫酸酸化,用0.0200mol/LKMnO4标准溶液滴定,达到滴定终点的判断依据是当滴入最后半滴KMnO4标准溶液,锥形瓶中溶液由______ 。平行测定三次,平均消耗KMnO4标准溶液24.30mL,计算样品溶液中Na2SO3的浓度为______ mol/L。

该工艺条件下,相关金属离子开始沉淀和完全沉淀时的pH如表:
| Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀 | 2.2 | 3.5 | 9.5 |
| 完全沉淀 | 3.2 | 4.7 | 11.1 |
(1)灼烧含铂废料最主要的目的是
(2)滤渣1的主要成分为
(3)“还原”步骤中氯铂酸铵沉淀与Na2SO3溶液反应的主要离子方程式为
(4)“试剂A”可选用
a.盐酸 b.NaOH溶液 c.氨水 d.MgO
(5)“系列操作”中最后的步骤为在HCl氛围中结晶,原因是
(6)某小组为测定Na2SO3溶液浓度进行以下探究:取25.00mLNa2SO3样品溶液于锥形瓶中,滴入3~4滴稀硫酸酸化,用0.0200mol/LKMnO4标准溶液滴定,达到滴定终点的判断依据是当滴入最后半滴KMnO4标准溶液,锥形瓶中溶液由
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】锗是一种重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用湿法炼锌渣(主要含有GeO2、ZnO、FeO、Fe2O3、SiO2)制备高纯锗的工艺流程:
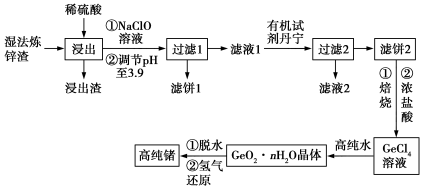
已知:①GeO2为两性化合物。
②常温下,部分金属阳离子转化为氢氧化物沉淀的pH见下表。
③有机试剂丹宁沉淀金属离子的沉淀率见下表。
(1)“浸出”时加热的目的是_______ ;浸出渣的主要成分是_______ (填化学式)。
(2)浸出后加入NaClO溶液的作用是_______ (用离子方程式表示)。加入NaClO溶液后调节溶液的pH至3.9的原因是_______ 。
(3)“滤液2”中主要含有的金属阳离子是_______ (填离子符号)。
(4)GeCl4与高纯水反应的化学方程式为_______ 。
(5)若含锗3.2%的湿法炼锌渣的质量为5kg,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为_______ (保留3位有效数字)。

已知:①GeO2为两性化合物。
②常温下,部分金属阳离子转化为氢氧化物沉淀的pH见下表。
| 离子 | Fe2+ | Fe3+ | Zn2+ | Ge4+ |
| 开始沉淀pH | 7.5 | 2.2 | 6.2 | 8.2 |
| 完全沉淀pH | 9.0 | 3.2 | 8.2 | 11.2 |
| 离子 | Fe2+ | Fe3+ | Zn2+ | Ge4+ |
| 沉淀率(%) | 0 | 99 | 0 | 97~98.5 |
(2)浸出后加入NaClO溶液的作用是
(3)“滤液2”中主要含有的金属阳离子是
(4)GeCl4与高纯水反应的化学方程式为
(5)若含锗3.2%的湿法炼锌渣的质量为5kg,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:
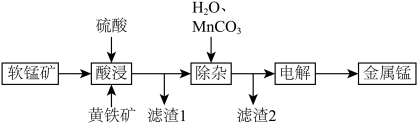
已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:____________________________ 。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是_______________ (填化学式)。
(3)除杂步骤中加入的MnCO3的作用是____________________________ ,该过程需调节溶液pH的范围是___________________________ ,若把pH调得过高,其后果是_________________________ 。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为____________________ ,电解后阳极的电解质溶液可返回_______________________ (填“酸浸”“除杂”或“电解”)工序继续使用。

已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
| 金属离子 | Fe3+ | Mn2+ | Al3+ |
| 开始沉淀的pH | 2.7 | 8.3 | 3.2 |
| 沉淀完全的pH | 3.7 | 9.8 | 5.0 |
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是
(3)除杂步骤中加入的MnCO3的作用是
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】工业.上用菱锰矿( )[含
)[含 、
、 、
、 等杂质]为原料制取二氧化锰,其流程示意图如下:
等杂质]为原料制取二氧化锰,其流程示意图如下:
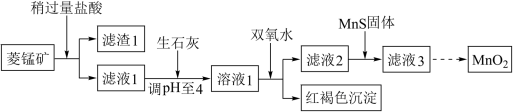
已知生成氢氧化物沉淀的 :
:
注:金属离子的起始浓度为
回答下列问题:
(1) 元素在周期表中位置是
元素在周期表中位置是__________ ,属于__________ 区元素(选填“s”、“p”、“d”或s")。
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是___________ ;盐酸溶解 的化学方程式是
的化学方程式是____________________ 。
(3)向溶液1中加入双氧水时,反应的离子方程式是______________________________ 。
(4)滤液2中加入稍过量的难溶电解质 ,以除去
,以除去 ,反应的离子方程式是
,反应的离子方程式是____________________ 。
(5)将 转化为
转化为 的一种方法是氧化法。其具体做法是用酸化的
的一种方法是氧化法。其具体做法是用酸化的 溶液将
溶液将 氧化,该反应的离子方程式:
氧化,该反应的离子方程式: __________
 。
。
(6)将 转化为
转化为 的另一种方法是电解法。
的另一种方法是电解法。
①生成 的电极反应式是
的电极反应式是______________________________ 。
②若在上述 溶液中加入一定量的
溶液中加入一定量的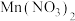 粉末,则无
粉末,则无 产生。其原因是
产生。其原因是____________________ 。
 )[含
)[含 、
、 、
、 等杂质]为原料制取二氧化锰,其流程示意图如下:
等杂质]为原料制取二氧化锰,其流程示意图如下:
已知生成氢氧化物沉淀的
 :
:
|
|
|
| |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |

回答下列问题:
(1)
 元素在周期表中位置是
元素在周期表中位置是(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是
 的化学方程式是
的化学方程式是(3)向溶液1中加入双氧水时,反应的离子方程式是
(4)滤液2中加入稍过量的难溶电解质
 ,以除去
,以除去 ,反应的离子方程式是
,反应的离子方程式是(5)将
 转化为
转化为 的一种方法是氧化法。其具体做法是用酸化的
的一种方法是氧化法。其具体做法是用酸化的 溶液将
溶液将 氧化,该反应的离子方程式:
氧化,该反应的离子方程式:  。
。(6)将
 转化为
转化为 的另一种方法是电解法。
的另一种方法是电解法。①生成
 的电极反应式是
的电极反应式是②若在上述
 溶液中加入一定量的
溶液中加入一定量的 粉末,则无
粉末,则无 产生。其原因是
产生。其原因是
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐1】克罗吗宁(Cromakalim)是一种钾通道激活剂,其合成路线如下:
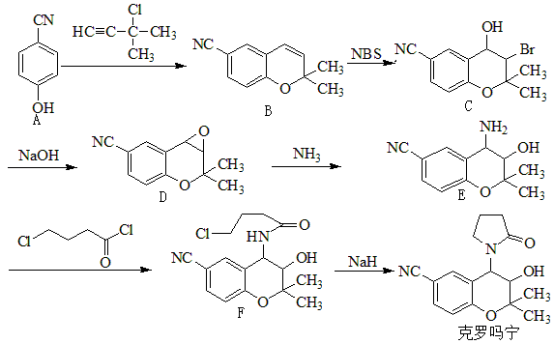
(1)D分子中手性碳原子的数目为___________ 。
(2)E分子中采取sp2杂化与采取sp3杂化的碳原子的数目之比为___________ 。
(3)B→C的过程中,有分子式为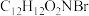 的副产物X生成,但实际合成时不需要除去X的原因是
的副产物X生成,但实际合成时不需要除去X的原因是___________ 。
(4)B的一种同分异构体Y同时满足下列条件,写出Y的结构简式:___________ 。
①分子中含有氨基( )
)
②能与足量浓溴水发生取代和加成反应。
③分子中不同化学环境的氢原子数目比为1∶2∶2∶6。
(5)设计以1,3-丁二烯、NBS和 为原料制备
为原料制备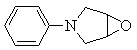 的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。___________

(1)D分子中手性碳原子的数目为
(2)E分子中采取sp2杂化与采取sp3杂化的碳原子的数目之比为
(3)B→C的过程中,有分子式为
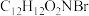 的副产物X生成,但实际合成时不需要除去X的原因是
的副产物X生成,但实际合成时不需要除去X的原因是(4)B的一种同分异构体Y同时满足下列条件,写出Y的结构简式:
①分子中含有氨基(
 )
)②能与足量浓溴水发生取代和加成反应。
③分子中不同化学环境的氢原子数目比为1∶2∶2∶6。
(5)设计以1,3-丁二烯、NBS和
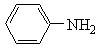 为原料制备
为原料制备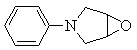 的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
(1)判断离子AB2-离子的空间构型为__________ 。A、B、C 3种元素第一电离能由大到小的顺序为__________________ 。(用相应的元素符号表示)
(2)元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是_________ 。
(3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是___________ 。
(4)元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如右图所示。该化合物的化学式为___________ 。

(5)向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的核外电子排布式为_________________ 。
②1 mol该配合物中含配位键的数目为___________ 。
(1)判断离子AB2-离子的空间构型为
(2)元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是
(3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是
(4)元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如右图所示。该化合物的化学式为

(5)向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的核外电子排布式为
②1 mol该配合物中含配位键的数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】锆(Zr)是40号元素,位于第五周期ⅣB族,锆可溶于氢氟酸和王水,锆及其化合物在陶瓷、耐火材料等多个领域有着重要用途。请回答下列相关问题。
(1)基态锆原子的价电子排布图(轨道表示式)是___ 。
(2)ZrSiO4和ZrSiO3是锆的两种硅酸盐,二者含有的阳离子Zr4+和Zr2+中比较稳定的是____ ,原因是___ 。SiO32-的空间构型是____ ,SiO42-中的Si原子的杂化类型是____ 。
(3)[Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___ (填元素符号),该离子中含有的化学键种类不包括___ (填选项序号)。
A.极性键 B.非极性键 C.σ键 D.π键
(4)立方氧化锆是一种人工合成的氧化物,由于硬度极高且外观接近钻石常被用作钻石的替代品,其晶胞结构如图所示,立方氧化锆的化学式是___ ,锆原子的配位数是____ 。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为__ g/cm3。

(1)基态锆原子的价电子排布图(轨道表示式)是
(2)ZrSiO4和ZrSiO3是锆的两种硅酸盐,二者含有的阳离子Zr4+和Zr2+中比较稳定的是
(3)[Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是
A.极性键 B.非极性键 C.σ键 D.π键
(4)立方氧化锆是一种人工合成的氧化物,由于硬度极高且外观接近钻石常被用作钻石的替代品,其晶胞结构如图所示,立方氧化锆的化学式是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO 的工艺流程如下:
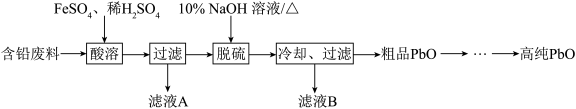
(1)铅蓄电池放电时负极的电极反应________ 。
(2)酸溶过程中含铅废料需要粉碎,其目的是__________ ,在 Fe2+催化下,PbO2和Pb 反应生成PbSO4,生成 1molPbSO4转移电子的物质的量__________ mol。
(3)滤液A 中含有的主要阳离子是______ (填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为______ 。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是______
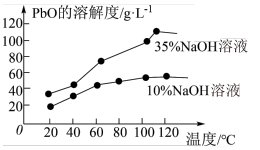
(6)PbO 溶解在NaOH 溶液中,存在平衡:PbO(s)+NaOH(aq) NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量
NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______ (填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______ ,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。

(1)铅蓄电池放电时负极的电极反应
(2)酸溶过程中含铅废料需要粉碎,其目的是
(3)滤液A 中含有的主要阳离子是
(4)脱硫过程发生的主要反应的离子方程式为
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是
(6)PbO 溶解在NaOH 溶液中,存在平衡:PbO(s)+NaOH(aq)
 NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量
NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)自然界中存在游离态的铁,通常称为____________ 。
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如图(部分操作和条件略):
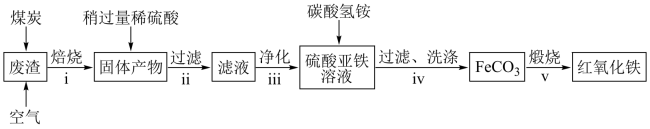
回答下列问题:
①在步骤i焙烧的目的是________ 。步骤ii的滤渣为_________ 。
②在步骤iii操作中,滴加氨水除Al3+。若常温时由1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5 mol·L-1,则溶液的pH为_______ 。
③在步骤iv中发生的反应中有一种气态产物,它是_________ (写化学式)。
④步骤v中,发生反应的化学方程式为_______________________ 。
(3)工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4),可降低生产成本且产品质量优。工艺流程如下:
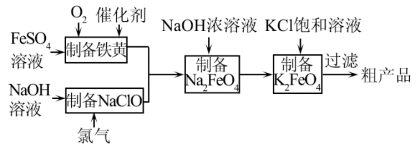
①由图知需先制得高铁酸钠溶液,然后加入饱和KCl溶液转化为高铁酸钾,说明相同温度下溶解度:高铁酸钾______ 高铁酸钠(填“>”或“<”)。
②写出由铁黄制备高铁酸钠的离子方程式_____________________________________ 。
③高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:
3Zn+2K2FeO4+8H2O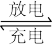 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的正极反应式为___________________________________ 。
(1)自然界中存在游离态的铁,通常称为
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如图(部分操作和条件略):

回答下列问题:
①在步骤i焙烧的目的是
②在步骤iii操作中,滴加氨水除Al3+。若常温时由1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5 mol·L-1,则溶液的pH为
③在步骤iv中发生的反应中有一种气态产物,它是
④步骤v中,发生反应的化学方程式为
(3)工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4),可降低生产成本且产品质量优。工艺流程如下:

①由图知需先制得高铁酸钠溶液,然后加入饱和KCl溶液转化为高铁酸钾,说明相同温度下溶解度:高铁酸钾
②写出由铁黄制备高铁酸钠的离子方程式
③高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:
3Zn+2K2FeO4+8H2O
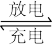 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH放电时电池的正极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上,处理低品位黄铜矿[二硫化亚铁铜( )含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( ),相关流程如下图。
),相关流程如下图。
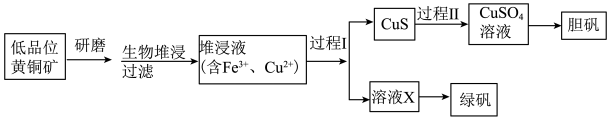
资料:①生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)生物堆浸前,需先将矿石进行研磨,目的是___________ 。
(2)生物堆浸过程的反应在T.f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为: 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)生物堆浸过程中,应控制溶液的pH在___________ 范围内。
(4) 在过程I中被还原为
在过程I中被还原为 。
。
①若过程I中只加入一种试剂,在下列常见还原剂中可选择___________ 。
a. b.
b. c.
c. d.Cu
d.Cu
② 做还原剂时,通常被氧化为
做还原剂时,通常被氧化为 。过程I中若加入
。过程I中若加入 固体,则发生反应的离子方程式有
固体,则发生反应的离子方程式有___________ (忽略该过程中所有涉及配合物的反应)。
③为判断堆浸液中 是否被完全还原,可取少量溶液X,向其中加入
是否被完全还原,可取少量溶液X,向其中加入___________ (填试剂的化学式),观察溶液颜色变化。
(5)向过程I所得固体中加入___________ (填试剂的化学式),过滤,可得CuS固体。然后加 和稀硫酸,CuS
和稀硫酸,CuS完全溶解 ,用离子方程式表示 的作用是
的作用是___________ 。
(6)绿矾的纯度可通过“ 滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量
滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量 固体做催化剂。用物质的量浓度为cmol/L的
固体做催化剂。用物质的量浓度为cmol/L的 溶液滴定。至
溶液滴定。至___________ 时,恰好完全反应。此时,消耗 溶液的体积为VmL。则绿矾晶体质量分数的计算式为
溶液的体积为VmL。则绿矾晶体质量分数的计算式为___________ 。( 摩尔质量为278g/mol)
摩尔质量为278g/mol)
 )含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( ),相关流程如下图。
),相关流程如下图。
资料:①生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
 |  |  | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(1)生物堆浸前,需先将矿石进行研磨,目的是
(2)生物堆浸过程的反应在T.f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:
 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为(3)生物堆浸过程中,应控制溶液的pH在
(4)
 在过程I中被还原为
在过程I中被还原为 。
。①若过程I中只加入一种试剂,在下列常见还原剂中可选择
a.
 b.
b. c.
c. d.Cu
d.Cu②
 做还原剂时,通常被氧化为
做还原剂时,通常被氧化为 。过程I中若加入
。过程I中若加入 固体,则发生反应的离子方程式有
固体,则发生反应的离子方程式有③为判断堆浸液中
 是否被完全还原,可取少量溶液X,向其中加入
是否被完全还原,可取少量溶液X,向其中加入(5)向过程I所得固体中加入
 和稀硫酸,CuS
和稀硫酸,CuS 的作用是
的作用是(6)绿矾的纯度可通过“
 滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量
滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量 固体做催化剂。用物质的量浓度为cmol/L的
固体做催化剂。用物质的量浓度为cmol/L的 溶液滴定。至
溶液滴定。至 溶液的体积为VmL。则绿矾晶体质量分数的计算式为
溶液的体积为VmL。则绿矾晶体质量分数的计算式为 摩尔质量为278g/mol)
摩尔质量为278g/mol)
您最近一年使用:0次







