反应Ⅰ:2CH3OH(g)=HCOOCH3(g)+2H2(g) K1,△H1=+51.2kJ•mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g) K2,△H2=+90.1kJ•mol-1
回答下列问题:
(1)反应HCOOCH3(g)=2CO(g)+2H2(g)的△H3=
(2)对于反应Ⅰ:增大压强,平衡
(3)在400kPa、铜基催化剂存在下,向密闭容器中通入CH3OH进行Ⅰ、Ⅱ两个反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
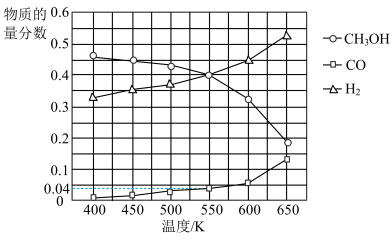
①随温度升高,CH3OH的平衡组成比例呈现如图所示趋势的原因是
②550K时,反应2CH3OH(g)=HCOOCH3(g)+2H2(g)的平衡常数Kp=
③研究表明,在700K以后升高体系温度,HCOOCH3的产率下降,可能的原因是
相似题推荐
Ⅰ.利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,发生反应如下:
①CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)②CO2(g)+3H2(g)
 CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)(1)反应①过程中能量变化如下图所示,下列说法正确的是
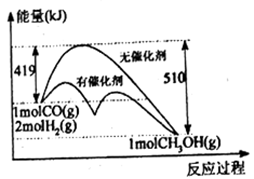
A.①反应的△H=逆反应活化能-正反应活化能
B.把1molCO(g)和2molH2(g)充入密闭容器中充分反应,达平衡时放出的热量为91kJ
C.从图中信息可知加入催化剂能改变反应历程和热效应
D.相同条件下,CO(g)和H2(g)反应生成1mol液态CH3OH放出的热量大于91kJ
(2) 现利用①和②两个反应合成CH3OH, 已知CO可使反应的催化剂寿命下降。
若氢碳比表示为f= [(n(H2)-n(CO2)]/[(n(CO)-n(CO2)],则理论上f=
Ⅱ.甲醇可用于制取甲酸甲酯,其反应方程式为:CH3OH(g)+CO(g)
 HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
(3)从反应压强对甲醇转化率的影响“效率”图和生产成本角度分析,工业制取甲酸甲酯应选择的最佳压强是
(4)实际工业生产中采用的温度是80℃,其理由是
Ⅲ.甲醇还可以用于合成二甲醚,发生的反应为2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)已知该反应在某温度下的平衡常数为900,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol/L) | 1.25 | 0.9 | 0.9 |
(5)比较此时正、逆反应速率的大小: v正
(6) 若加入CH3OH后,经6min反应达到平衡,则该时间内平均反应速率v (CH3OH) =
【推荐2】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-49.6kJ/mol
CH3OH(g)+H2O(g)△H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g)△H2=+23.4kJ/mol
2CH3OH(g)△H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H3
CH3OCH3(g)+3H2O(g)△H3
(1)△H3=
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=

(5)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显 +HCO
+HCO +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
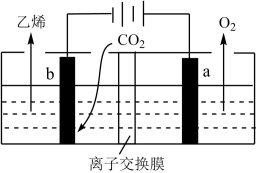
(6)据文献报道,CO2可以在酸性水溶液中用情性电极电解得到乙烯,其原理如图所示。b电极上的电极反应式
I.工业上一般在恒容密闭容器中采用下列反应合成甲醇:
 。
。(1)该反应在不同温度下的化学平衡常数
 如下表。
如下表。温度/ | 250 | 300 | 350 |
 | 2.041 | 0.270 | 0.012 |

②由表中数据判断该反应的

③某温度下,将
 和
和 充入
充入 的密闭容器中,充分反应后,达到平衡时测得
的密闭容器中,充分反应后,达到平衡时测得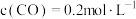 ,则此时的温度为
,则此时的温度为 。
。(2)要提高
 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是a.增加
 的浓度 b.加入催化剂 c.升温 d.加入
的浓度 b.加入催化剂 c.升温 d.加入 e.加入惰性气体 f.分离出甲醇
e.加入惰性气体 f.分离出甲醇II.
(3)已知:
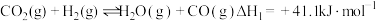 ;
;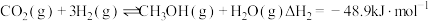 。
。则
 催化氢化合成
催化氢化合成 的热化学方程式:
的热化学方程式:(4)在一定条件下,发生
 催化氢化合成甲醇的反应。体系中
催化氢化合成甲醇的反应。体系中 的平衡转化率
的平衡转化率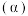 与
与 和
和 的关系如图所示,
的关系如图所示, 和
和 分别表示温度或压强。
分别表示温度或压强。
①
 表示的物理量是
表示的物理量是②判断
 与
与 的大小关系:
的大小关系:
 ,并简述理由:
,并简述理由:(1)一定条件下由丙烷制备丙烯有以下两种方式:
反应i:

 ;
;反应ii:
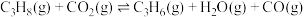
 。
。已知上述反应中相关的键能数据如表所示。
| 化学键 |  |  |  |  |
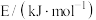 | 436 | 413 | 348 | 615 |

 。
。(2)在
 温度下,将
温度下,将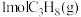 和
和 充入恒容密闭容器中,在一定条件下发生反应i、ii。测得
充入恒容密闭容器中,在一定条件下发生反应i、ii。测得 转化率及体系内压强随时间的变化关系如图所示(忽略温度对催化剂活性的影响)。
转化率及体系内压强随时间的变化关系如图所示(忽略温度对催化剂活性的影响)。
 时,
时, 的平衡转化率是
的平衡转化率是②
 时,从反应开始到反应达到平衡,用
时,从反应开始到反应达到平衡,用 的分压变化表示的化学反应速率为
的分压变化表示的化学反应速率为 。
。③
 时,反应i的
时,反应i的
 。
。(3)在一定条件下,
 与
与 合成甲醇的反应为
合成甲醇的反应为
 ,已知速率方程
,已知速率方程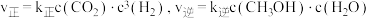 ,
, 、
、 是速率常数,只受温度影响。图甲、图乙分别表示平衡常数、速率常数的对数
是速率常数,只受温度影响。图甲、图乙分别表示平衡常数、速率常数的对数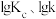 与温度的倒数
与温度的倒数 之间的关系。降低温度,
之间的关系。降低温度,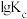 的变化曲线为
的变化曲线为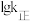 的变化曲线为
的变化曲线为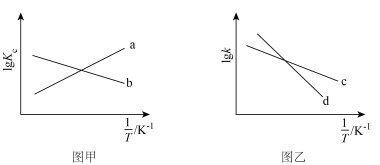
 在催化剂表面发生以下反应:
在催化剂表面发生以下反应:反应iii.
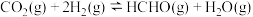
 ;
;反应iv.

 。
。在密闭容器中,保持投料比不变,将
 与
与 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲烷选择性
转化率和甲烷选择性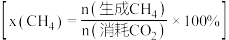 随温度变化关系如图所示。若
随温度变化关系如图所示。若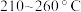 时,催化剂的活性受温度影响不大,则
时,催化剂的活性受温度影响不大,则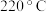 后图中曲线下降的原因是
后图中曲线下降的原因是 的转化率会降低,原因是
的转化率会降低,原因是
已知:CH2=CHCH3与H2O发生加成反应的化学方程式如下(a、b均大于0):
Ⅰ:
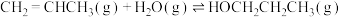
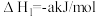
Ⅱ:
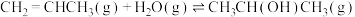

“反应Ⅰ”和“反应Ⅱ”均满足范特霍夫方程
 (R为热力学常数,C为不同反应常数),其平衡常数与温度的关系如图1所示,T1℃时,在初始压强为400 kPa的恒容密闭容器中,按1:1的物质的量之比充入CH2=CHCH3(g)和H2O(g)发生反应I和反应Ⅱ,产物的分压随时间变化如图2所示:
(R为热力学常数,C为不同反应常数),其平衡常数与温度的关系如图1所示,T1℃时,在初始压强为400 kPa的恒容密闭容器中,按1:1的物质的量之比充入CH2=CHCH3(g)和H2O(g)发生反应I和反应Ⅱ,产物的分压随时间变化如图2所示: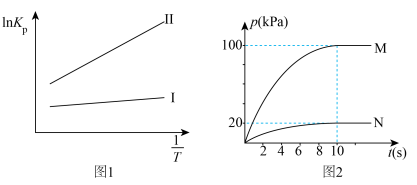
(2)若反应Ⅱ的熵变为△S(Ⅱ),则反应Ⅲ:
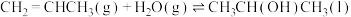 的熵变△S(Ⅲ)
的熵变△S(Ⅲ)(3)由图可知“反应Ⅰ”和“反应Ⅱ”的焓变△H1
(4)若在绝热恒容容器中发生上述反应,则下列事实能说明反应达到平衡状态的是___________(填标号)。
| A.容器内气体的压强不变 |
| B.容器内温度不变 |
| C.容器内气体的密度不再改变 |
| D.容器内n(CH2=CHCH3):n(H2O)的比值不变 |
(5)①图2中表示CH3CH(OH)CH3的曲线为
②图2中CH2=CHCH3(g)的平衡转化率为
③T1℃时,反应Ⅱ的平衡常数Kp=
④若其他条件不变,T1℃时,向压强为400kPa的恒压密闭容器中,充入n(CH2=CHCH3):n(H2O)=1:1的混合气体,达到新平衡时,CH3CH(OH)CH3(g)的平衡产率将
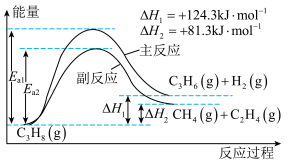
(1)由上图可知,主反应在
(2)丙烷脱氢制丙烯的过程中。恒压时向原料气中掺入高温水蒸气,则 K(主反应)
(3)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为 104 Pa 和 105 Pa)。
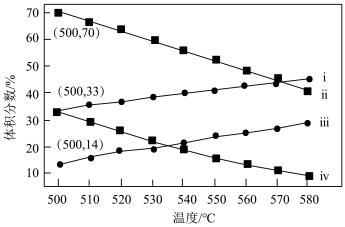
105 Pa 时,图中表示丙烯的曲线是
II、一定温度下,在 3.0L 密闭容器中,通入 0.10mol CH4和 0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/kPa) | 480 | 544 | 576 | 592 | 600 | 600 |
(4)已知 4min 时容器中甲烷为 0.04mol,计算 0~4min 内 υ (NO2)=

(5)在一恒容密闭容器中,通入一定量 CH4和 NO2,测得在相同时间内,不同温度下,NO2 的转化率随温度的变化如图。c 点
(1)传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g)
 C2H4(g)+H2(g) ΔH。
C2H4(g)+H2(g) ΔH。①已知:298K时,相关物质的相对能量如图:
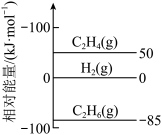
②
(2)乙烷氧化裂解制乙烯[主反应为C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g)
C2H4(g)+H2O(g)①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g)
 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中
 的变化情况。
的变化情况。用该方法制备乙烯应该选择的适宜条件为:温度
 =
=(3)温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) △H<0 K=2。
HCOOH(g) △H<0 K=2。①实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=
②温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强
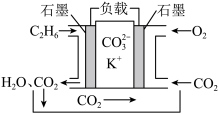
(4)某乙烷熔融燃料电池工作原理如下图所示:
(1)甲醇是重要的溶剂和燃料, 工业上用 CO 和 H2在一条件下制备 CH3OH 的反应为: CO(g)+2H2(g)
 CH3OH(g) △H<0
CH3OH(g) △H<0①T℃时,向容积为 2 L 的恒容密闭容器中充入 1 mol CO 和 1.2 mol H2,一段时间后达到平衡,此时 H2与CH3OH 的体积分数之比为2:5 ,该反应的平衡常数 K
②在一容积可变的密闭容器中充入一定物质的量的 CO 和 H2,测得 CO 在不同温度下的平衡转化率与压强的关系如图所示。a、b、c 三点平衡常数 K(a)、K(b)、K(c)的大小关系是
(2)沥青混凝土可作为2CO(g)+O2(g)
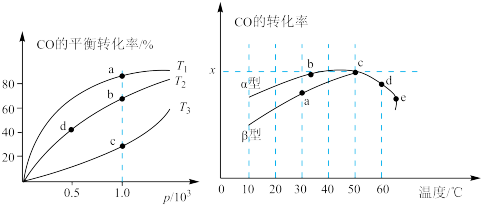
 2CO2(g)反应的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO 的转化率与温度的关系。
2CO2(g)反应的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO 的转化率与温度的关系。①a、b、c、d 四点中表示平衡状态的是
②e点转化率出现突变的原因可能是
(1)真空碳热还原一氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol﹣1
3AlCl(g)═2Al(l)+AlC13(g)△H=b kJ•mol﹣1
用含a、b的代数式表示反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g)△H=Q kJ•mol﹣1.在T1℃时,反应进行到不同时间测得各物质的浓度如下(时间单位为min,浓度单位为mol/L):
 | 0 | 10 | 20 | 30 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 |
| N2 | 0 | 0.16 | 0.25 | 0.25 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 |
①0~10min内,NO的平均反应速率v(NO)=
②30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.电极b表面发生的电极反应式为

 、
、 、
、 均为大气污染物,它们在一定条件下可以转化为其他物质,以减少对环境的污染。
均为大气污染物,它们在一定条件下可以转化为其他物质,以减少对环境的污染。(1)一定条件下,将
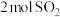 与
与 置于恒容密闭容器中发生反应
置于恒容密闭容器中发生反应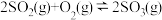 ,下列状态能说明该反应达到化学平衡的是
,下列状态能说明该反应达到化学平衡的是A.混合气体的密度保持不变
B.
 的转化率保持不变
的转化率保持不变C.
 和
和 的物质的量之比保持不变
的物质的量之比保持不变D.
 的消耗速率和
的消耗速率和 的消耗速率相等
的消耗速率相等(2)已知反应
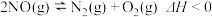 ,在不同条件时
,在不同条件时 的体积分数随时间
的体积分数随时间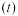 的变化如图甲所示。根据图象可以判断曲线
的变化如图甲所示。根据图象可以判断曲线 、
、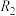 对应的下列反应条件中不同的是
对应的下列反应条件中不同的是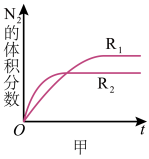
A.压强B.温度C.催化剂
(3)
 和
和 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: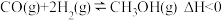 。现在体积为
。现在体积为 的恒容密闭容器(如图乙所示)中通入
的恒容密闭容器(如图乙所示)中通入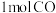 和
和 ,测定不同时间、不同温度下容器中
,测定不同时间、不同温度下容器中 的物质的量,结果如表所示:
的物质的量,结果如表所示:
 | 0 min | 10 min | 20 min | 30 min | 40 min |
T1 | 1 mol | 0.8 mol | 0.62 mol | 0.4 mol | 0.4 mol |
T2 | 1 mol | 0.7 mol | 0.5 mol | a | a |
①

 ,理由是
,理由是 时,第
时,第 时容器内压强不再改变,此时
时容器内压强不再改变,此时 的转化率为
的转化率为②若将
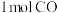 和
和 通入原体积为
通入原体积为 的恒压密闭容器(如图丙所示)中,
的恒压密闭容器(如图丙所示)中, 时该反应的平衡常数为
时该反应的平衡常数为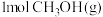 ,重新达到平衡时,
,重新达到平衡时, 在体系中的体积分数
在体系中的体积分数(1)根据下表中键能写出合成氨的热化学方程式
| 化学键 | H-H | O-H | N≡N | H-N |
| E/(kJ·mol-1) | 436 | 465 | 946 | 391 |

①T1、T2、T3由大到小的排序为
②在T2、60MPa条件下,A点v正
③图2表示500 °C、60 MPa条件下,合成氨反应原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡转化率为
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO
 5N2+6H2O,以n(NH3)﹕n(NO)分别为4﹕1、3﹕1、1﹕3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3)﹕n(NO)分别为4﹕1、3﹕1、1﹕3投料,得到NO脱除率随温度变化的曲线如图所示: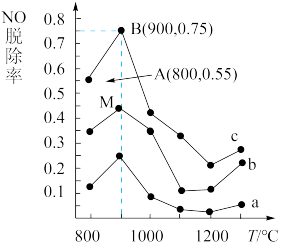
①曲线a对应的n(NH3)﹕n(NO)=
②曲线c中NO的起始浓度为4×10-4 mg/m3,从A点到B点(经过0.8 s,该时间段内NO的脱除速率
(4)用间接电化学法可对NO进行无害化处理,其原理如下图所示(质子膜允许H+和H2O通过),用离子方程式表示吸收塔内吸收NO的原理:

(1)
 的制取:
的制取: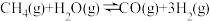 ,已知该反应中,当初始混合气中的
,已知该反应中,当初始混合气中的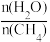 恒定时,温度、压强对平衡混合气
恒定时,温度、压强对平衡混合气 含量的影响如图所示:
含量的影响如图所示:
①图中,两条曲线表示压强的关系是:

 (填“>”、“=”或“<”),并简述理由
(填“>”、“=”或“<”),并简述理由②该反应为
(2)
 的富集:
的富集: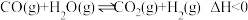
①
 时,向容积固定为
时,向容积固定为 的容器中充入
的容器中充入 水蒸气和
水蒸气和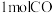 ,反应达平衡后,测得
,反应达平衡后,测得 的浓度为
的浓度为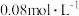 ,则平衡时
,则平衡时 的转化率为
的转化率为②保持温度仍为
 ,改变水蒸气和
,改变水蒸气和 的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成
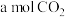 的同时消耗
的同时消耗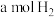
d.混合气中




