欲降低废水中重金属元素铬的毒性,可将Cr2O 转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
(1)某含铬废水处理的主要流程如下图所示:
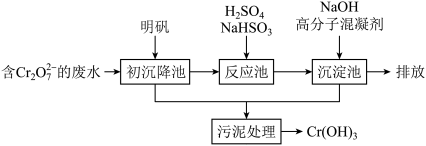
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)_______ 。
②请补充并配平以下反应池中发生主要反应的离子方程式:_______ 。
_______Cr2O +_______HSO
+_______HSO +_______=_______Cr3++_______SO
+_______=_______Cr3++_______SO +_______H2O
+_______H2O
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和_______ 。证明Cr3+沉淀完全的方法是_______ 。
(2)工业可用电解法来处理含Cr2O 废水。实验室利用如图模拟处理含Cr2O
废水。实验室利用如图模拟处理含Cr2O 的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
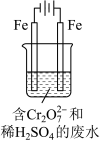
①Fe2+与酸性溶液中的Cr2O 反应的离子方程式是
反应的离子方程式是_______ ,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因_______ 。
③若溶液中含有0.01mol Cr2O ,则阳离子全部生成沉淀的物质的量是
,则阳离子全部生成沉淀的物质的量是_______ mol。
 转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |

①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
②请补充并配平以下反应池中发生主要反应的离子方程式:
_______Cr2O
 +_______HSO
+_______HSO +_______=_______Cr3++_______SO
+_______=_______Cr3++_______SO +_______H2O
+_______H2O③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和
(2)工业可用电解法来处理含Cr2O
 废水。实验室利用如图模拟处理含Cr2O
废水。实验室利用如图模拟处理含Cr2O 的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
①Fe2+与酸性溶液中的Cr2O
 反应的离子方程式是
反应的离子方程式是②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因
③若溶液中含有0.01mol Cr2O
 ,则阳离子全部生成沉淀的物质的量是
,则阳离子全部生成沉淀的物质的量是
2014·广东汕头·二模 查看更多[2]
更新时间:2019-01-30 18:14:09
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
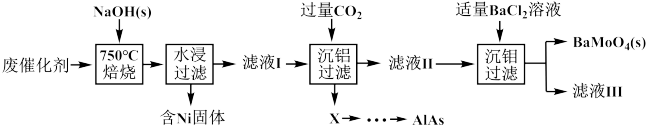
已知:25℃时,H2CO3的Ka1=4.5 × 10-7,Ka2=4.7 × 10-11;Ksp(BaMoO4)=3.5 × 10-8;Ksp(BaCO3)=2.6 × 10-9;该工艺中,pH>6.0时,溶液中Mo元素以MoO 的形态存在。
的形态存在。
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为___________ 。
(2)“沉铝”中,生成的沉淀X为___________ 。
(3)“沉钼”中,pH为7.0。
①生成BaMoO4的离子方程式为___________ 。
②若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c( ):c(MoO
):c(MoO )=
)=___________ (列出算式)时,应停止加入BaCl2溶液。
(4)①滤液III中,主要存在的钠盐有NaCl和Y,Y为___________ 。
②往滤液III中添加适量NaCl固体后,通入足量___________ (填化学式)气体,再通入足量CO2,可析出Y

已知:25℃时,H2CO3的Ka1=4.5 × 10-7,Ka2=4.7 × 10-11;Ksp(BaMoO4)=3.5 × 10-8;Ksp(BaCO3)=2.6 × 10-9;该工艺中,pH>6.0时,溶液中Mo元素以MoO
 的形态存在。
的形态存在。(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为
(2)“沉铝”中,生成的沉淀X为
(3)“沉钼”中,pH为7.0。
①生成BaMoO4的离子方程式为
②若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c(
 ):c(MoO
):c(MoO )=
)=(4)①滤液III中,主要存在的钠盐有NaCl和Y,Y为
②往滤液III中添加适量NaCl固体后,通入足量
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和+6价铬的含氧酸根离子等.如图是综合利用该酸洗废液的工艺流程:
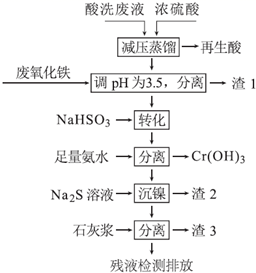
已知:
①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3⇌[Ni(NH3)6]2+
(1)再生酸中含有______ ,采取减压蒸馏的原因是______ (用化学方程式表示).
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是______ .
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子反应方程式:______ .
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:______ .
(5)滤渣3的主要成分为Ca(OH)2和_________________________ .
(6)经检测,最后的残液中c(Ca2+)=0.004mol•L-1,则残液中F-浓度为______ mg•L-1,[已知Ksp(CaF2)=4×10-11 mol3•L-3.

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3⇌[Ni(NH3)6]2+
(1)再生酸中含有
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子反应方程式:
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:
(5)滤渣3的主要成分为Ca(OH)2和
(6)经检测,最后的残液中c(Ca2+)=0.004mol•L-1,则残液中F-浓度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某研究小组用工业废料(主要含MgCO3、FeCO3和Al2O3等)回收镁的工艺流程如下:

(1)酸浸过程中采用粉碎原料、加热、搅拌、适当增大硫酸的浓度等措施的目的是______ ;用过氧化氢溶液氧化时,发生的反应离子方程式为_________ 。
(2)为了不影响产品的纯度,试剂a应选择______ (填编号)。
A.CuO B.Ca(OH)2 C.MgCO3 D.氨水
在用试剂a调节pH过程中,先生成的沉淀是______ ;当pH=5时,滤液1中Al3+和Fe3+的物质的量浓度之比为________ (已知:298K时,Ksp[Al(OH)3]=3.0×10-34,Ksp[Fe(OH)3]=4.0×10-38)。
(3)写出生成滤渣2的离子方程式____________ 。
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑ MgSO4+C=MgO+SO2↑+CO↑ MgSO4+3C=MgO+SO2↑+3CO↑
为测定煅烧后产生的气体中各组分含量,进行如下实验:将气体冷却至标准状况后取22.4mL气体,经Ba(OH)2溶液充分吸收,剩余7mL气体(标准状况);所得沉淀用足量硝酸溶解,再经过滤、洗涤、干燥、称量得沉淀0.1165g。则混合气体中SO2、CO2、CO体积比为_____ (填最简整数比)。

(1)酸浸过程中采用粉碎原料、加热、搅拌、适当增大硫酸的浓度等措施的目的是
(2)为了不影响产品的纯度,试剂a应选择
A.CuO B.Ca(OH)2 C.MgCO3 D.氨水
在用试剂a调节pH过程中,先生成的沉淀是
(3)写出生成滤渣2的离子方程式
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑ MgSO4+C=MgO+SO2↑+CO↑ MgSO4+3C=MgO+SO2↑+3CO↑
为测定煅烧后产生的气体中各组分含量,进行如下实验:将气体冷却至标准状况后取22.4mL气体,经Ba(OH)2溶液充分吸收,剩余7mL气体(标准状况);所得沉淀用足量硝酸溶解,再经过滤、洗涤、干燥、称量得沉淀0.1165g。则混合气体中SO2、CO2、CO体积比为
您最近一年使用:0次
【推荐1】工业用黄铜矿[主要成分CuFeS2,还含少量锌(Zn)、铅(Pb)的硫化物]冶炼铜的一种方法的流程如下:

(1)过程Ⅰ中发生下列反应:①CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2S;②CuCl + Cl- CuCl2-上述反应中盐酸的作用是
CuCl2-上述反应中盐酸的作用是________________________ 。
(2)过程Ⅱ中通入空气,将Fe2+转化FeOOH沉淀,离子方程式是_________________ 。
(3)Ⅳ中加入Na2CO3溶液的目的是______________________________________ 。
(4)Ⅴ中反应的离子方程式是______________________________ 。
(5)秉承绿色化学的理念,请提出在冶炼厂中处理和利用副产品NaCl溶液的方案,并说明理由:__________________________________________________ 。

(1)过程Ⅰ中发生下列反应:①CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2S;②CuCl + Cl-
 CuCl2-上述反应中盐酸的作用是
CuCl2-上述反应中盐酸的作用是(2)过程Ⅱ中通入空气,将Fe2+转化FeOOH沉淀,离子方程式是
(3)Ⅳ中加入Na2CO3溶液的目的是
(4)Ⅴ中反应的离子方程式是
(5)秉承绿色化学的理念,请提出在冶炼厂中处理和利用副产品NaCl溶液的方案,并说明理由:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)⇌2NO(g) ΔH=+180 kJ·mol−1,2CO(g)+O2(g)⇌2CO2(g) ΔH=-564 kJ·mol−1。
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=________________ ,该反应在________ 下能自发进行(填“高温”“低温”或“任意温度”)。
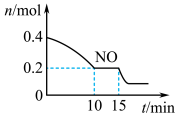
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T ℃时该反应的压力平衡常数Kp=________________ ;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3 mol,平衡将________ (填“向左”“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是___ (填字母)。
A. 增大CO浓度 B. 升温 C. 减小容器体积 D. 加入催化剂
Ⅱ.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10−2 Ka2=6.0×10−7。
(3)请通过计算证明,NaHSO3溶液显酸性的原因:____________________________________ 。
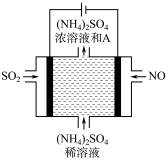
(4)如上方图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为________________________________________ ;若通入的NO体积为4.48 L(标况下),则另外一个电极通入的SO2质量至少为________ g。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)⇌2NO(g) ΔH=+180 kJ·mol−1,2CO(g)+O2(g)⇌2CO2(g) ΔH=-564 kJ·mol−1。
(1)2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T ℃时该反应的压力平衡常数Kp=
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是
A. 增大CO浓度 B. 升温 C. 减小容器体积 D. 加入催化剂
Ⅱ.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10−2 Ka2=6.0×10−7。
(3)请通过计算证明,NaHSO3溶液显酸性的原因:
(4)如上方图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大,X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)M在元素周期表中的位置为____________ 。
(2)X 与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)_______ ,在实验室中,制取该物质的反应原理是(写化学方程:式)________ 。
(3)MX与水反应可放出气体,该反应的化学方程式为____________ 。.
(4)常温下不能与G的单质发生反应的是(填序号)_________ 。
a.CuSO4溶液 b. Fe2O3 c.浓硫酸 d. NaOH溶液 e. Na2CO3固体
(5)工业上若以石墨为电极电解制G的单质,阳极产生混合气体的成分是(写化学式)______ 。
(1)M在元素周期表中的位置为
(2)X 与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)
(3)MX与水反应可放出气体,该反应的化学方程式为
(4)常温下不能与G的单质发生反应的是(填序号)
a.CuSO4溶液 b. Fe2O3 c.浓硫酸 d. NaOH溶液 e. Na2CO3固体
(5)工业上若以石墨为电极电解制G的单质,阳极产生混合气体的成分是(写化学式)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】环境监测显示,某城市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知: ΔH=-241.8kJ·mol-1
ΔH=-241.8kJ·mol-1
 ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________ 。
(2)①在101 kPa时,H2(g)在 1.00 mol O2(g)中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为________________________________ 。
②1.00 L 1.00 mol·L−1 H2SO4溶液与2.00 L 1.00 mol·L−1 NaOH溶液完全反应,放出114.6 kJ热量,表示其中和热的热化学方程式为____________________________ 。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

电极A的电极反应式为________ ;
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:
 ΔH=-241.8kJ·mol-1
ΔH=-241.8kJ·mol-1 ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:
(2)①在101 kPa时,H2(g)在 1.00 mol O2(g)中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为
②1.00 L 1.00 mol·L−1 H2SO4溶液与2.00 L 1.00 mol·L−1 NaOH溶液完全反应,放出114.6 kJ热量,表示其中和热的热化学方程式为
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

电极A的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】工业上采用CO和H2合成再生能源甲醇,反应为:2H2(g)+CO(g) CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)一定温度下,将1molCO与1molH2通入VL恒容密闭容器中发生反应。
①该反应能自发进行的条件是______ (填“高温”、“低温”或“任意温度”)
②下列说法正确的是______ 。
A.v正(H2)=2v逆(CO)时,反应达到化学平衡状态
B.达到平衡时CO与H2的转化率相等
C.恒温恒压,往原料气中通入少量稀有气体,CO的转化率会降低
D.该反应的正反应活化能大于逆反应活化能
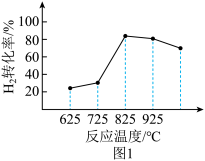
③图1为温度对H2合成甲醇反应的影响,请从反应速率和平衡的角度分析725℃以后H2百分含量随时间增长呈现该变化趋势的原因______ 。
(2)在恒温T、恒压P的条件下,将3.0molCO与4.5molH2通入容积可变的密闭容器中。达平衡时容器的体积为2L,CO的转化率为50%。
①此反应的正、逆反应速率与浓度的关系为v正=k正c(CO)·c2(H2),v逆=k逆c(CH3OH),其中k正、k逆为速率常数。在温度T下k正、k逆的关系式为k正=_____ k逆。
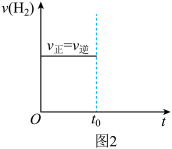
②若平衡时,在t0时刻再向容器中通入9.0molCO,在图2中画出充入CO后的v正、v逆随时间变化的图象_____ 。
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,请写出生成甲醇的电极反应式______ 。
 CH3OH(g) ΔH<0
CH3OH(g) ΔH<0(1)一定温度下,将1molCO与1molH2通入VL恒容密闭容器中发生反应。
①该反应能自发进行的条件是
②下列说法正确的是
A.v正(H2)=2v逆(CO)时,反应达到化学平衡状态
B.达到平衡时CO与H2的转化率相等
C.恒温恒压,往原料气中通入少量稀有气体,CO的转化率会降低
D.该反应的正反应活化能大于逆反应活化能
③图1为温度对H2合成甲醇反应的影响,请从反应速率和平衡的角度分析725℃以后H2百分含量随时间增长呈现该变化趋势的原因

(2)在恒温T、恒压P的条件下,将3.0molCO与4.5molH2通入容积可变的密闭容器中。达平衡时容器的体积为2L,CO的转化率为50%。
①此反应的正、逆反应速率与浓度的关系为v正=k正c(CO)·c2(H2),v逆=k逆c(CH3OH),其中k正、k逆为速率常数。在温度T下k正、k逆的关系式为k正=
②若平衡时,在t0时刻再向容器中通入9.0molCO,在图2中画出充入CO后的v正、v逆随时间变化的图象

(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,请写出生成甲醇的电极反应式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】如图是一个电化学过程的示意图.请回答下列问题:
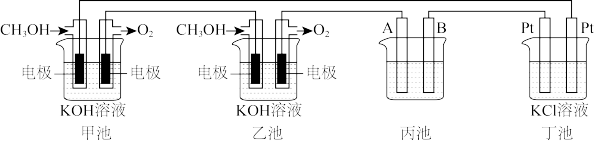
(1)通入CH3OH的电极的电极反应式为_______ .
(2)丙池是铜的精炼池,电解一段时间后烧杯中的溶液浓度会_______ (填“增大、减小、不变”),A电极反应式_______ (已知粗铜中含有Zn,Ag杂质).
(3)丁池中滴有酚酞,实验开始后观察到的现象_______ ,丁池采用无隔膜电解,产生的氯气可能会与KOH溶液接触仅得到KClO和H2,则相应的化学反应方程式为_______ 。
(4)若甲、乙两个电池氧气通入量均为20L(标准状况),且反应完全,则理论上通过丁池的电量为_______ (法拉第常数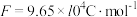 ),丁池最多能产生气体的总体积为
),丁池最多能产生气体的总体积为_______ L(标准状况)。

(1)通入CH3OH的电极的电极反应式为
(2)丙池是铜的精炼池,电解一段时间后烧杯中的溶液浓度会
(3)丁池中滴有酚酞,实验开始后观察到的现象
(4)若甲、乙两个电池氧气通入量均为20L(标准状况),且反应完全,则理论上通过丁池的电量为
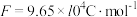 ),丁池最多能产生气体的总体积为
),丁池最多能产生气体的总体积为
您最近一年使用:0次



