工业上,合成氨反应:N2+3H2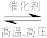 2NH3 ΔH<0的微观历程如图所示,用
2NH3 ΔH<0的微观历程如图所示,用 、
、 、
、 分别表示N2、H2、NH3,下列说法
分别表示N2、H2、NH3,下列说法不正确 的是

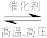 2NH3 ΔH<0的微观历程如图所示,用
2NH3 ΔH<0的微观历程如图所示,用 、
、 、
、 分别表示N2、H2、NH3,下列说法
分别表示N2、H2、NH3,下列说法
| A.②→③变化中断开了旧的化学键,是吸热过程 |
| B.③→④变化中形成了新的化学键,是放热过程 |
| C.合成氨工业上,采用高压可以提高反应的速率和NH3的平衡产率 |
| D.使用合适的催化剂,能改变反应的ΔH,提高合成氨反应的速率 |
更新时间:2023-11-22 19:07:35
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】根据图中包含的信息分析,下列叙述正确的是( )
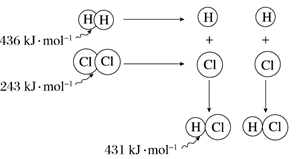

| A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量 |
| B.436 kJ·mol-1是指断开1 mol H2中的H-H键需要放出436 kJ的能量 |
| C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量 |
| D.431 kJ·mol-1是指生成2 mol HCl中的H—Cl键需要放出431 kJ的能量 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法正确的是

| A.状态I→状态II属于氧化还原反应 |
| B.状态II的总能量小于状态III的总能量 |
C.状态III→状态IV可用方程式表示为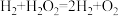 |
| D.该过程涉及极性键和非极性键的断裂和生成 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】科研人员利用复合材料光催化剂,构建一个还原和氧化反应分离的人工光合体系,其反应机理如图所示,其中Fe2+和Fe3+离子渗透Nafion膜可协同CO2、H2O分别反应。下列说法正确的是
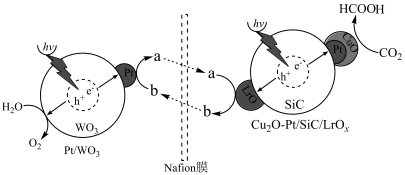

A.该人工光合体系的总反应为 |
| B.该反应能量转化形式为化学能→光能 |
| C.图中a、b分别代表Fe2+、Fe3+ |
| D.Cu2O—Pt上发生的反应为CO2+2e-+2H2O=HCOOH+2OH- |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
| A.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率 |
| B.化学反应速率为0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L |
| C.根据化学反应速率的大小可以判断化学反应进行的快慢 |
| D.对于化学反应来说,反应速率越大,反应现象越明显 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列叙述不正确的是
| A.反应CaSO4(s)═CaO(s)+SO3(g) ΔH>0在高温下能自发进行 |
| B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择甲基橙为指示剂 |
| C.平衡正向移动,反应物的转化率一定增大 |
| D.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)⇌CH3OH(g)。在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示。下列说法正确的是


| A.合成甲醇的反应为吸热反应 |
| B.A、B、C三点的平衡常数为KA=KB>KC |
| C.压强为p1>p2 |
| D.若达平衡状态A时,容器的容积为10L,则在平衡状态B时容器的容积也为10L |
您最近一年使用:0次



