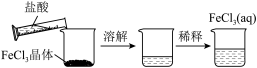
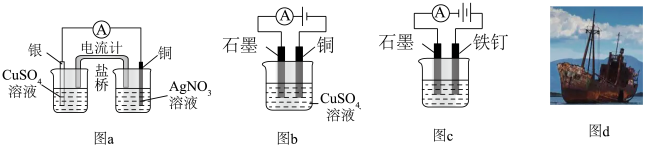
用如下实验装置进行相应实验,不能达到实验目的是
| A | B | C | D |
 |  |  | 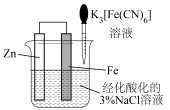 |
| 量取20.00mL溶液 | 蒸发 溶液得到 溶液得到 固体 固体 | 通过实验验证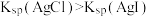 | 验证牺牲阳极法 |
| A.A | B.B | C.C | D.D |
更新时间:2023-12-12 20:51:48
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】设NA为阿伏加德罗常数的值。下列说法正确的是
| A.7g环丙烷含有的极性键数目为NA |
| B.56gFe高温下与足量水蒸气反应转移电子数为3NA |
| C.在含Fe3+的数目为NA的FeCl3溶液中,含有Cl-的数目为3NA |
| D.100mL18mol·L-1浓硫酸与足量Cu粉加热反应,产生SO2分子数为0.9NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列不能证明 是弱电解质的是
是弱电解质的是
 是弱电解质的是
是弱电解质的是A. 、溶液做导电实验,灯泡很暗 、溶液做导电实验,灯泡很暗 |
B.常温下,0.1mol/L的 溶液的 溶液的 |
C. 的 的 溶液稀释100倍后,溶液pH<3 溶液稀释100倍后,溶液pH<3 |
D.常温下, 溶液pH>7 溶液pH>7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】根据下列实验操作和现象所得到的结论正确的是
| 实验操作和现象 | 结论 | |
| A | 相同条件下,分别测量0.1 mol·L-1和0.01 mol·L-1醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B | 向Co2O3固体中滴加浓盐酸,有黄绿色气体生成 | 氧化性:Co2O3>Cl2 |
| C | 向滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,溶液红色逐渐褪去 | BaCl2溶液呈酸性 |
| D | 常温下,分别测量浓度均为0.1 mol·L-1的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】化学与生产、生活密切相关。下列说法错误的是
| A.氯化铵溶液可以除铁锈 | B.刷牙用含氟牙膏可使牙齿更坚固 |
| C.使用加酶洗衣粉时,温度越高效果越好 | D.铝盐与小苏打可以作泡沫灭火器药品 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】由下列实验操作及现象得出的相应结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向 溶液中滴入几滴 溶液中滴入几滴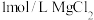 溶液,再加入 溶液,再加入 溶液 溶液 | 先产生白色沉淀,后沉淀颜色变深 |  沉淀可以转化为 沉淀可以转化为 沉淀 沉淀 |
| B | 用pH计分别测定等物质的量浓度的NaClO溶液和 溶液的pH 溶液的pH |   | 酸性: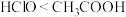 |
| C | 乙醇中加入浓 ,加热至170℃,产生的气体通入酸性 ,加热至170℃,产生的气体通入酸性 溶液 溶液 | 酸性 溶液紫红色褪去 溶液紫红色褪去 | 乙醇发生了消去反应 |
| C | 向 和 和 混合溶液中通入足量 混合溶液中通入足量 气体 气体 | 溶液变为浅绿色,有白色沉淀生成 |  被还原为 被还原为 ,白色沉淀为 ,白色沉淀为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】化学与生活息息相关,下列生活现象与所述的化学知识没有关联的是
选项 | 生活现象 | 化学知识 |
A | 75%的酒精用于杀菌消毒 | 乙醇具有氧化性 |
B | 夏天喝啤酒打嗝 | 气体的溶解平衡 |
C | 野外烧烤,用草木灰搓洗油腻的手 | 盐的水解 |
D | 镀锌钢管镀层破损后仍能防止生锈 | 原电池原理 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列叙述正确的是:
| A.使用催化剂可以改变反应的活化能,也可以改变反应的焓变。 |
| B.金属腐蚀分为析氢腐蚀和吸氧腐蚀 |
| C.电解饱和食盐水,阳极产物一定是氯气 |
| D.同种弱电解质溶液,增大物质的量浓度导电能力不一定增强 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】某实验小组将废铁屑(含硫化亚铁等杂质)和稀硫酸加入锥形瓶中,加热,充分反应,冷却后加入氨水,制得硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O],装置如下图(夹持仪器略去)。下列说法或操作错误的是
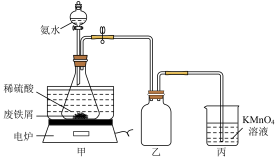

| A.乙装置是安全瓶 |
| B.将氨水滴入时,先缓慢打开活塞,再打开玻璃塞 |
| C.KMnO4溶液的作用是吸收H2S等尾气,防止污染空气 |
| D.锥形瓶中发生中和反应的离子方程式:NH3·H2O+H+=NH4++H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】如图是比较碳酸钠和碳酸氢钠热稳定性实验,棉花球沾有无水硫酸铜,下列说法不正确 的是
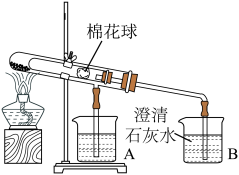

| A.小试管内盛装碳酸氢钠 |
| B.棉花球现象是变蓝色,说明碳酸氢钠受热不稳定 |
| C.烧杯A澄清石灰水不变浑浊,烧杯B澄清石灰水变浑浊 |
| D.两个烧杯中导管口均出现气泡,说明碳酸氢钠和碳酸钠受热都易分解 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】根据下列有关实验得出的结论一定正确的是
| 选项 | 实验 | 结论 |
| A | 在容积可变的密闭容器中发生反应:2NH3(g) N2(g)+3H2(g),向其中通入氩气 N2(g)+3H2(g),向其中通入氩气 | 反应速率减慢 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,将等质量的大理石块和大理石粉分别加入等体积的盐酸中 | 反应速率:粉状大理石>块状大理石 |
| D | 相同温度下,向盛有足量稀硫酸的甲、乙两支试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体 | 产生氢气的速率和体积:甲>乙 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次