完成下列问题。
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN中除H外其余三种元素的第一电离能由大到小的顺序为___________ 。1molPAN中含有的σ键数目为___________ 。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为_________ ,中心离子的外围电子排布图___________ 。
③相同压强下,HCOOH的沸点比CH3OCH3___________ (填高或低),其原因是___________ 。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________ (填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的中心原子轨道采用___________ 杂化,阴离子的空间构型为___________ 。
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则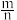 =
=___________ (填数字)。已知:该晶胞边长为bpm,NA代表阿伏伽德罗常数,则该晶体的密度为___________ g/cm3(写出计算式即可)。

(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
 (PAN)等二次污染物。
(PAN)等二次污染物。①PAN中除H外其余三种元素的第一电离能由大到小的顺序为
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为
③相同压强下,HCOOH的沸点比CH3OCH3
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的中心原子轨道采用
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则
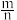 =
=
更新时间:2023-11-21 21:24:47
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】CIGS靶材是一种主要含铜、铟(In)、镓(Ga)、硒(Se)的合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域。回答下列问题:
(1)基态Ga的核外电子排布为[Ar]3d104s24p1,转化为下列激发态时所需能量最少的是___________(填字母)。
(2)硫酸铜分别和氨水、EDTA[(HOOCCH2)2NCH2CH2N(CH2COOH)2]可形成配合物[Cu(NH3)4(H2O)2]SO4、[Cu(EDTA)]SO4。
① 的空间构型为
的空间构型为___________ ,EDTA中碳原子杂化方式为___ 。
②C、N、O、S四种元素中,第一电离能最大的是___ 。
③在[Cu(NH3)4(H2O)₂]SO4化合物中,阳离子呈轴向狭长的八面体结构 (如图),该阳离子中存在的化学键类型____ ,该化合物加热时首先失去的组分是___________ 。
(3)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因___________ 。
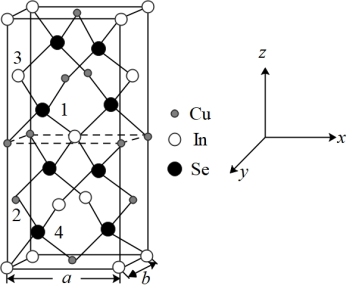
(4)四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=m pm,c=2m pm,晶胞棱边夹角均为90°。设阿伏加德罗常数的值为NA,CuInSe2的相对质量为M,则该晶体密度p=____ g•cm-3 (用含有m、M和NA的代数式表示)。该晶胞中,原子坐标分别为2号Cu原子(0,0.5,0.25),3号In原子(0,0.5,0.75),4号Se原子(0.75,0.75,0.125)。则1号Se原子的坐标为____ ,晶体中与单个In键合的Se有___________ 个。
(1)基态Ga的核外电子排布为[Ar]3d104s24p1,转化为下列激发态时所需能量最少的是___________(填字母)。
A.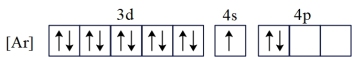 |
B.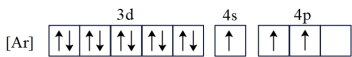 |
C.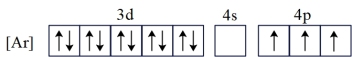 |
D.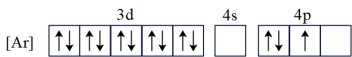 |
①
 的空间构型为
的空间构型为②C、N、O、S四种元素中,第一电离能最大的是
③在[Cu(NH3)4(H2O)₂]SO4化合物中,阳离子呈轴向狭长的八面体结构 (如图),该阳离子中存在的化学键类型

(3)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因
| 有机物 | 甲醇 | 甲硫醇(CH3SH) | 甲硒醇 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。
(1)基态钒原子价电子排布图为____ 。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是___ 。
(3)VCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[V(En)2]2+(En是乙二胺的简写)。乙二胺分子中氮原子的杂化轨道类型为_____ ,乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是_____ 。
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为_____ ;也可以得到偏钒酸钠,其阴离子呈如图所示的无限链状结构,则偏钒酸钠的化学式为_____ 。


(5)钒能形成多种配合物,钒的两种配合物X、Y的化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来)。
则X的配离子为____ ,Y的配体是_____ 。
(6)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。CO作配体时,配位原子是C而不是O,其原因是____ 。过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。已知化合物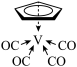 满足18电子规则,其配体“
满足18电子规则,其配体“ ”中的大π键可表示为
”中的大π键可表示为_____ 。
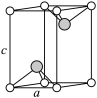
(7)VCl2(熔点1027℃)和VBr2(熔点827℃)均为六方晶胞,结构如图所示。设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为_____ (用含a、c、r+和r-的式子表示)。
(1)基态钒原子价电子排布图为
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是
(3)VCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[V(En)2]2+(En是乙二胺的简写)。乙二胺分子中氮原子的杂化轨道类型为
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为


(5)钒能形成多种配合物,钒的两种配合物X、Y的化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来)。
X | X | Y | Y | |
试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
则X的配离子为
(6)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。CO作配体时,配位原子是C而不是O,其原因是
 满足18电子规则,其配体“
满足18电子规则,其配体“ ”中的大π键可表示为
”中的大π键可表示为(7)VCl2(熔点1027℃)和VBr2(熔点827℃)均为六方晶胞,结构如图所示。设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】砷化镓(GaAs)、碲化镉(CdTe)等太阳能电池适合光电转换,可以直接把光能转化成电能。回答下列问题:
(1)元素As与N同族,预测As的氢化物分子的立体结构为____ ,其基态原子最外层p轨道电子的自旋状态____ (填“相同”或“相反”)。
(2)元素Cd与Zn是同一副族的相邻元素,Cd的价层电子排布为4d105s2,Cd2+的价层电子排布为___ 。
(3)经X射线衍射实验证明在碲酸(H6TeO6)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为____ 。
(4)Te、Se都是第ⅥA族的元素,SeF6与SF6具有相似的结构,则熔沸点SeF6___ SF6(填“>”或“<”或“=");二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用如图表示,已知光的波长与其能量成反比,则图中实现光响应的波长:λ1____ λ2(填“>”或“<”或“="),其原因是____ 。

(5)CdTe的晶胞属立方晶系,晶胞参数如图1所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如原子M的坐标为(0,0,0),则原子N的坐标为____ 。

该晶胞沿其面对角线方向上的投影如图2所示,则代表Te原子的位置是____ (填序号),晶胞中原子6和11之间的距离为____ pm(用含a的代数式表示)。
(1)元素As与N同族,预测As的氢化物分子的立体结构为
(2)元素Cd与Zn是同一副族的相邻元素,Cd的价层电子排布为4d105s2,Cd2+的价层电子排布为
(3)经X射线衍射实验证明在碲酸(H6TeO6)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
(4)Te、Se都是第ⅥA族的元素,SeF6与SF6具有相似的结构,则熔沸点SeF6

(5)CdTe的晶胞属立方晶系,晶胞参数如图1所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如原子M的坐标为(0,0,0),则原子N的坐标为

该晶胞沿其面对角线方向上的投影如图2所示,则代表Te原子的位置是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】某硫与锌元素组成的化合物M不溶于水、易溶于酸,见阳光色变暗。若在该化合物中加入微量的Cu、Mn、Ag做活化剂,经光照后,能发出不同颜色的荧光。回答下列问题:
(1)基态铜原子的价电子排布图为_____ 。第一电离能介于Si、P之间的第三周期元素为_____ (填元素符号)。
(2)SO2中S的杂化类型为_____ ,该分子的空间构型为_____ 。
(3)1mol[Ag(NH3)2]OH中含有σ键的数目为_____ NA,NH3分子在独立存在时H-N-H键角为107°,[Ag(NH3)2]+中H-N-H键角变大的原因:_____ 。
(4)M的晶胞结构如图。
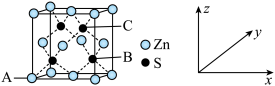
①观察图形推测,该晶体中每个Zn2+周围距离相等且最近的Zn2+数目为_____ 个,M的化学式为_____ 。
②Zn的第三电离能大于Cu的第三电离能的原因是_____ 。
③已知A原子的坐标为(0,0,0),B原子坐标为( ,
, ,
, ),则C原子坐标为
),则C原子坐标为_____ 。
(1)基态铜原子的价电子排布图为
(2)SO2中S的杂化类型为
(3)1mol[Ag(NH3)2]OH中含有σ键的数目为
(4)M的晶胞结构如图。

①观察图形推测,该晶体中每个Zn2+周围距离相等且最近的Zn2+数目为
②Zn的第三电离能大于Cu的第三电离能的原因是
③已知A原子的坐标为(0,0,0),B原子坐标为(
 ,
, ,
, ),则C原子坐标为
),则C原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】铜和钛可呈现多种化合价,回答下列问题。
(1)配位化合物中心原子也存在轨道杂化现象, 中
中 采取sp杂化,
采取sp杂化,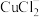 的空间结构为
的空间结构为___________ 。
(2)某种含铜热电材料,晶胞结构如图,Cu位于棱、面上,Sb位于体心、顶点,S位于晶胞内,底部边长为 ,高为
,高为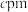 ,该晶体化学式为
,该晶体化学式为___________ ,其中部分原子坐标为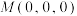 、
、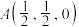 、
、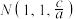 ,Y点的原子坐标为
,Y点的原子坐标为___________ 。
(3)基态Ti原子的价电子轨道表示式为___________ 。
(4)钛基配合物可用于催化环烯烃聚合,其结构如图所示:
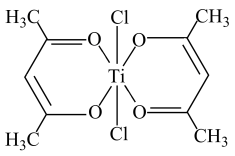
钛的配位数为___________ 。
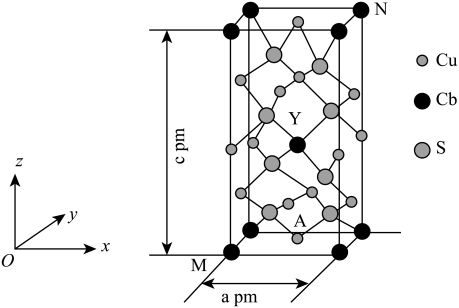
(5)已知 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为___________ 。
(1)配位化合物中心原子也存在轨道杂化现象,
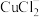 中
中 采取sp杂化,
采取sp杂化,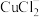 的空间结构为
的空间结构为(2)某种含铜热电材料,晶胞结构如图,Cu位于棱、面上,Sb位于体心、顶点,S位于晶胞内,底部边长为
 ,高为
,高为 ,该晶体化学式为
,该晶体化学式为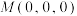 、
、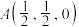 、
、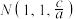 ,Y点的原子坐标为
,Y点的原子坐标为
(3)基态Ti原子的价电子轨道表示式为
(4)钛基配合物可用于催化环烯烃聚合,其结构如图所示:

钛的配位数为
(5)已知
 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】我们的生活离不开材料。我国在新材料领域的研究有了较大的发展,“卡脖子”的技术问题取得了许多方面的突破,新材料的发展也将由原材料、基础化工材料逐步过渡到新型材料、半导体材料、新能量材料、节能材料等中。“天宫”空间站使用的材料中含有Li、Be、B、C、N、O、Al、Fe、Co、Ni、Cu、Zn等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A.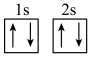 B.
B. 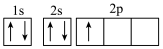
C.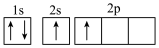 D.
D. 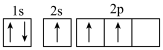
(2)Be、B、C、N、O的第一电离能由大到小的顺序是_______ 。(用元素符号表示)
(3)Cu与Zn相比,第二电离能与第一电离能差值更大的是_______ ,原因是_______ 。
(4)第四周期基态原子中未配对电子数最多的原子的价电子轨道表示式_______ 。
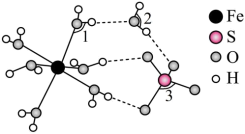
(5)FeSO4·7H2O的结构如下图所示。
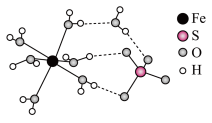
①FeSO4·7H2O中H2O与Fe2+的作用力类型是_______ 。
②H2O中O和SO 中S均为sp3杂化,H2O中
中S均为sp3杂化,H2O中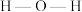 的键角
的键角_______ SO 中的
中的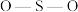 键角(填“>”“<”或“=”)。
键角(填“>”“<”或“=”)。
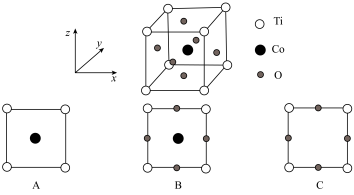
(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为_______ (填标号),设阿伏加德罗常数的值为NA,晶胞参数为anm,则该晶胞的密度为_______ g•cm (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B. 
C.
 D.
D. 
(2)Be、B、C、N、O的第一电离能由大到小的顺序是
(3)Cu与Zn相比,第二电离能与第一电离能差值更大的是
(4)第四周期基态原子中未配对电子数最多的原子的价电子轨道表示式
(5)FeSO4·7H2O的结构如下图所示。

①FeSO4·7H2O中H2O与Fe2+的作用力类型是
②H2O中O和SO
 中S均为sp3杂化,H2O中
中S均为sp3杂化,H2O中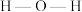 的键角
的键角 中的
中的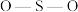 键角(填“>”“<”或“=”)。
键角(填“>”“<”或“=”)。(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为
 (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】第四周期的元素镓(Ga)、锗(Ge).、砷(As)、硒(Se)都在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为______________________ 。
(2)沸点:NH3_______ AsH3(填“>”、“<”或“=”),原因是_____________________ 。
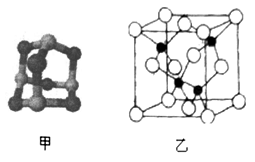
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为___________________ ,As原子采取_____________ 杂化。
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因________________________________________ 。
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为__________________________ ;砷化镓的晶胞结构如图乙所示,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为_____ g(用NA表示阿伏伽德罗常数的值)。
(1)基态锗原子的价电子排布式为
(2)沸点:NH3
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因

(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】2022年诺贝尔化学奖授予在发展点击化学和生物正交化学方面做出贡献的科学家。点击化学的代表反应为 催化的叠氮一炔基Husigen环加成反应,
催化的叠氮一炔基Husigen环加成反应, 、
、 、
、 等均是点击化学中常用的无机试剂。回答下列问题:
等均是点击化学中常用的无机试剂。回答下列问题:
(1)叠氮化物能与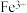 、
、 及
及 等形成配合物,
等形成配合物, 中
中 的配位数为
的配位数为_______ 。
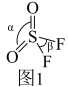
(2) 分子结构如图1所示,键角
分子结构如图1所示,键角 为124°,
为124°, 为96°,
为96°, 的主要原因是
的主要原因是_______ 。
(3) 分子的空间结构如图2所示(图中键长单位为
分子的空间结构如图2所示(图中键长单位为 m)。
m)。
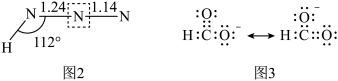
已知:①典型 、
、 和
和 的键长分别为
的键长分别为 m、
m、 m和
m和 m;②甲酸根(
m;②甲酸根( )的两个碳氧键键长相同,处于典型碳氧单键和碳氧双键之间,其结构可以用两个极端电子式的平均杂化体来表示(图3)。画出
)的两个碳氧键键长相同,处于典型碳氧单键和碳氧双键之间,其结构可以用两个极端电子式的平均杂化体来表示(图3)。画出 分子的两个极端电子式
分子的两个极端电子式_______ ;图2“□”中N原子的杂化方式为_______ 。
(4)图4是 的拉维斯结构,
的拉维斯结构, 以金刚石方式堆积,八面体空隙和半数的四面体空隙中填入以四面体方式排列的
以金刚石方式堆积,八面体空隙和半数的四面体空隙中填入以四面体方式排列的 ,距离
,距离 原子最近的
原子最近的 原子有
原子有_______ 个;图5是沿立方格子对角面取得的截面, 原子的半径为
原子的半径为_______ pm。

 催化的叠氮一炔基Husigen环加成反应,
催化的叠氮一炔基Husigen环加成反应, 、
、 、
、 等均是点击化学中常用的无机试剂。回答下列问题:
等均是点击化学中常用的无机试剂。回答下列问题:(1)叠氮化物能与
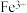 、
、 及
及 等形成配合物,
等形成配合物, 中
中 的配位数为
的配位数为(2)
 分子结构如图1所示,键角
分子结构如图1所示,键角 为124°,
为124°, 为96°,
为96°, 的主要原因是
的主要原因是
(3)
 分子的空间结构如图2所示(图中键长单位为
分子的空间结构如图2所示(图中键长单位为 m)。
m)。
已知:①典型
 、
、 和
和 的键长分别为
的键长分别为 m、
m、 m和
m和 m;②甲酸根(
m;②甲酸根( )的两个碳氧键键长相同,处于典型碳氧单键和碳氧双键之间,其结构可以用两个极端电子式的平均杂化体来表示(图3)。画出
)的两个碳氧键键长相同,处于典型碳氧单键和碳氧双键之间,其结构可以用两个极端电子式的平均杂化体来表示(图3)。画出 分子的两个极端电子式
分子的两个极端电子式(4)图4是
 的拉维斯结构,
的拉维斯结构, 以金刚石方式堆积,八面体空隙和半数的四面体空隙中填入以四面体方式排列的
以金刚石方式堆积,八面体空隙和半数的四面体空隙中填入以四面体方式排列的 ,距离
,距离 原子最近的
原子最近的 原子有
原子有 原子的半径为
原子的半径为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】选取下表中的合适物质的字母代号(A~H)填入相应标题(①-⑧)后的横线中(单选),并按要求填空。
①________ 不是平面分子,其衍生物用作高能燃料。
②________ 存在两种异构体,其中一种异构体的结构为:_______ 。
③________ 具有线型结构,Lewis结构式中每个键的键级为2.0。
④________ 是无色的,平面分子,它的一种等电子体是_______ 。
⑤________ 既有酸性,又有碱性,可作制冷剂。
⑥________ 既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做_______ 剂。
⑦________ 是顺磁性分子。
⑧________ 水溶液会分解生成N2O,反应式为_______ 。
| A | B | C | D | E | F | G | H |
 | NO | N2O3 | N2H4 | NH3 | N2O4 | H2N2O2 | NH2OH |
①
②
③
④
⑤
⑥
⑦
⑧
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】半导体芯片的关键材料是我国优先发展的新材料。经过半个多世纪的发展,硅基材料的半导体器件性能已经接近其物理极限,以碳化硅、氮化镓等为代表的第二代半导体材料成为当今热点。回答下列问题:
(1)基态镓原子的价电子排布式为:_____ ,它位于元素周期表的位置是_____ 。
(2)上述材料所涉及的四种元素中,原子半径最小的是_____ (填元素符号,下同),第一电离能I1最大的是_____ 。
(3)原硅酸根SiO 的空间构型是
的空间构型是_____ ,其中Si的杂化轨道类型为_____ 。
(4)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是_____ (填序号),原因是_____ 。
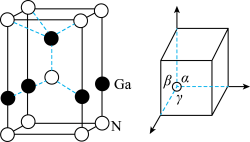
(5)GaN被誉为21世纪引领5G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数:α=β=90°,γ=120°。已知:该晶体的密度为ρg•cm-3,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为______ mol-1(用含a、b、ρ的代数式表示,MGa=70g/mol)。
(1)基态镓原子的价电子排布式为:
(2)上述材料所涉及的四种元素中,原子半径最小的是
(3)原硅酸根SiO
 的空间构型是
的空间构型是(4)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是
(5)GaN被誉为21世纪引领5G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数:α=β=90°,γ=120°。已知:该晶体的密度为ρg•cm-3,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】硼、砷、铁等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A.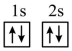 B.
B.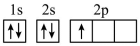
C.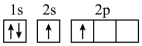 D.
D.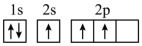
(2)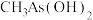 与
与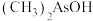 两种含砷有机酸中沸点较高的是
两种含砷有机酸中沸点较高的是_______ (填化学式),原因为_______ 。
(3)LiZnAs晶体的立方晶胞结构如下图1所示,N点原子分数坐标为 ;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体
;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体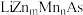 ,其立方晶胞结构如下图2所示。
,其立方晶胞结构如下图2所示。
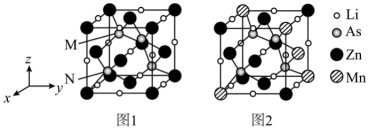
①M点原子分数坐标为_______ 。
②m=_______ 。
③已知 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,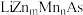 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为 。晶胞中As原子与Mn原子之间的最短距离为
。晶胞中As原子与Mn原子之间的最短距离为_______ nm(列出计算式)。
(4) 的结构如下图所示。
的结构如下图所示。
图示 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是_______ (填序号)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B.
C.
 D.
D.
(2)
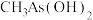 与
与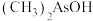 两种含砷有机酸中沸点较高的是
两种含砷有机酸中沸点较高的是(3)LiZnAs晶体的立方晶胞结构如下图1所示,N点原子分数坐标为
 ;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体
;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体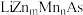 ,其立方晶胞结构如下图2所示。
,其立方晶胞结构如下图2所示。
①M点原子分数坐标为
②m=
③已知
 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,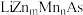 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为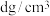 。晶胞中As原子与Mn原子之间的最短距离为
。晶胞中As原子与Mn原子之间的最短距离为(4)
 的结构如下图所示。
的结构如下图所示。
图示
 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】钛(22Ti)铝合金在航空领域应用广泛。回答下列问题:
(1)基态Ti原子的核外电子排布式为[Ar]_______ ,其中s轨道上总共有_________ 个电子。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是____ ,配体是______ 。
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: n CH3CH=CH2
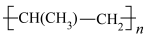 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有______________ ;反应中涉及的元素中电负性最大的是______________ 。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________________ 。
(4)钛与卤素形成的化合物的熔沸点如下表所示,
分析TiCl4、TiBr4 、TiI4的熔点和沸点呈现一定规律的原因是__________ 。
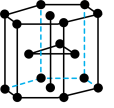
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如上图所示是钛晶体的一种晶胞,晶胞体积为a nm3,则该钛晶体的密度为_____ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。
(1)基态Ti原子的核外电子排布式为[Ar]
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: n CH3CH=CH2

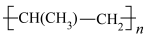 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(4)钛与卤素形成的化合物的熔沸点如下表所示,
| 物质 | 熔点/℃ | 沸点/℃ |
| TiCl4 | -25 | 136.5 |
| TiBr4 | 39 | 230 |
| TiI4 | 150 | 377 |

(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如上图所示是钛晶体的一种晶胞,晶胞体积为a nm3,则该钛晶体的密度为
您最近一年使用:0次



