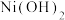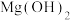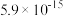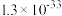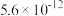题型:解答题-结构与性质
难度:0.4
引用次数:62
题号:19309891
铜和钛可呈现多种化合价,回答下列问题。
(1)配位化合物中心原子也存在轨道杂化现象,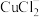 中
中 采取sp杂化,
采取sp杂化,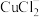 的空间结构为
的空间结构为___________ 。
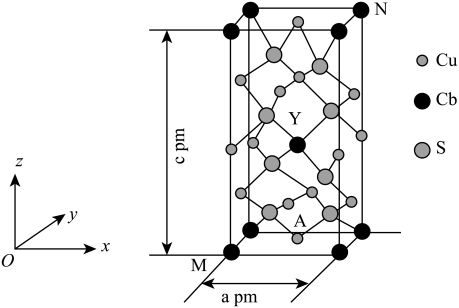
(2)某种含铜热电材料,晶胞结构如图,Cu位于棱、面上,Sb位于体心、顶点,S位于晶胞内,底部边长为 ,高为
,高为 ,该晶体化学式为
,该晶体化学式为___________ ,其中部分原子坐标为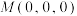 、
、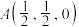 、
、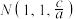 ,Y点的原子坐标为
,Y点的原子坐标为___________ 。
(3)基态Ti原子的价电子轨道表示式为___________ 。
(4)钛基配合物可用于催化环烯烃聚合,其结构如图所示:
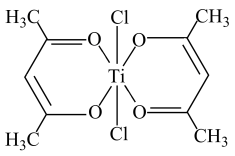
钛的配位数为___________ 。
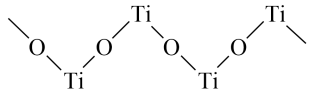
(5)已知 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为___________ 。
(1)配位化合物中心原子也存在轨道杂化现象,
 中
中 采取sp杂化,
采取sp杂化, 的空间结构为
的空间结构为(2)某种含铜热电材料,晶胞结构如图,Cu位于棱、面上,Sb位于体心、顶点,S位于晶胞内,底部边长为
 ,高为
,高为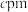 ,该晶体化学式为
,该晶体化学式为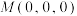 、
、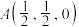 、
、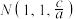 ,Y点的原子坐标为
,Y点的原子坐标为
(3)基态Ti原子的价电子轨道表示式为
(4)钛基配合物可用于催化环烯烃聚合,其结构如图所示:

钛的配位数为
(5)已知
 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为
更新时间:2023/05/18 18:41:13
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____ 。
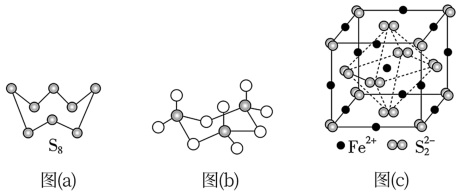
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____ 形,其中共价键的类型有_____ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为_____ 。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为____ g·cm−3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____ nm。1molFeS2晶体中含有阴阳离子总数为____
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 168.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】微颗粒的氧化锌作为一种纳米材料开始在相关领域发挥作用,利用锌焙砂 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题: 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸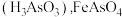 和
和 难溶于水。
难溶于水。
(1)基态 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为______ , 中
中 的化合价为
的化合价为______ 。
(2)“浸出”过程中 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为______ ;增大浸出率可采取的措施是______  写出两条
写出两条 。
。
(3)“除砷”过程中, 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为______ 。
(4)“除重金属”过程中加入 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时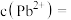
______ 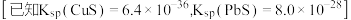 。
。
(5)“沉锌”前锌元素以 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式______ 。
(6)流程中可循环利用的物质有 、
、______ 、______  填化学式
填化学式 。
。
 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:
 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸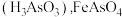 和
和 难溶于水。
难溶于水。(1)基态
 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为 中
中 的化合价为
的化合价为(2)“浸出”过程中
 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为 写出两条
写出两条 。
。(3)“除砷”过程中,
 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)“除重金属”过程中加入
 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时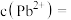
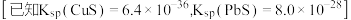 。
。(5)“沉锌”前锌元素以
 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式(6)流程中可循环利用的物质有
 、
、 填化学式
填化学式 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】我国将镓列为战略储备金属,我国的镓储量占世界储量的80%以上。请回答:
(1)基态镓原子最外层的电子排布图为________ ,最高能级的电子云形状为_________ 。
(2)镓可与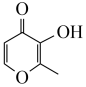 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga(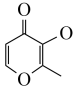 )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是___________ (填名称);每个甲基麦芽酚分子中含有___________ 个σ键。
(3)镓的卤化物熔点如表所示:
①氯化镓中镓的杂化方式与下列微粒的中心原子的杂化方式相同且氯化镓的空间结构也与其微粒相同的是___________ (填序号)。
A. B.
B. C.
C.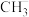 D.
D.
②各物质的熔点从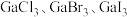 到
到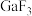 依次升高,原因是
依次升高,原因是___________ 。
(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以___________ 键结合。
(1)基态镓原子最外层的电子排布图为
(2)镓可与
 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga( )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是(3)镓的卤化物熔点如表所示:
| 物质 | 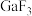 |  | 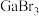 |  |
| 熔点/℃ | 1000 | 78 | 124 | 213 |
A.
 B.
B. C.
C.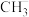 D.
D.
②各物质的熔点从
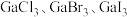 到
到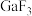 依次升高,原因是
依次升高,原因是(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用___________ 上的特征谱线来鉴定元素。
(2)某同学画出基态碳原子的核外电子排布图: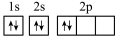 ,该电子排布图违背了
,该电子排布图违背了___________ ;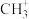 、
、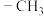 、
、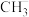 都是重要的有机反应中间体。
都是重要的有机反应中间体。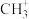 、
、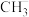 的空间构型分别为
的空间构型分别为___________ 、___________ 。
(3)基态溴原子的价层电子排布式为___________ ,第四周期中,与溴原子未成对电子数相同的金属元素有K、___________ 。(用元素符号列出全部)
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为
磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为___________ ,已知晶胞边长a pm,阿伏加德罗常数为 则磷化硼晶体的密度为
则磷化硼晶体的密度为___________ g/cm3。
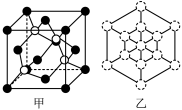
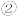 磷化硼晶胞沿着体对角线方向的投影(图乙中
磷化硼晶胞沿着体对角线方向的投影(图乙中 表示P 原子的投影),用
表示P 原子的投影),用 画出B原子的投影位置
画出B原子的投影位置___________ 。
(5)如图丙所示Fe3O4晶体中, 围成正四面体空隙(
围成正四面体空隙( 、3、6、7号氧围成)和正八面体空隙(
、3、6、7号氧围成)和正八面体空隙( 、6、7、8、9、12号氧围成),
、6、7、8、9、12号氧围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为
填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为___________ ,有___________  的正八面体空隙未填充阳离子。
的正八面体空隙未填充阳离子。
(1)现代化学中,常利用
(2)某同学画出基态碳原子的核外电子排布图:
 ,该电子排布图违背了
,该电子排布图违背了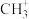 、
、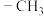 、
、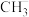 都是重要的有机反应中间体。
都是重要的有机反应中间体。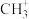 、
、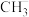 的空间构型分别为
的空间构型分别为(3)基态溴原子的价层电子排布式为
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
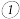 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为
磷化硼晶体晶胞如图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为 则磷化硼晶体的密度为
则磷化硼晶体的密度为
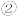 磷化硼晶胞沿着体对角线方向的投影(图乙中
磷化硼晶胞沿着体对角线方向的投影(图乙中 表示P 原子的投影),用
表示P 原子的投影),用 画出B原子的投影位置
画出B原子的投影位置
(5)如图丙所示Fe3O4晶体中,
 围成正四面体空隙(
围成正四面体空隙( 、3、6、7号氧围成)和正八面体空隙(
、3、6、7号氧围成)和正八面体空隙( 、6、7、8、9、12号氧围成),
、6、7、8、9、12号氧围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为
填充在正八面体空隙中,晶体中正四面体空隙数与正八面体空隙数之比为 的正八面体空隙未填充阳离子。
的正八面体空隙未填充阳离子。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】砷及其化合物有着广泛的用途,但也会严重危害环境安全和人体健康。
(1)雌黄(As2S3)和雄黄(As4S4)都是提取砷的主要矿物原料。砷元素有+2、+3、+5等常见价态。
①如图1为As4S4分子的空间结构模型。已知As2S3分子中没有π键,其结构式可表示为_____________ 。
②将含砷废渣(主要成分是As2S3)制成浆料再通入O2氧化,转化为H3AsO4和单质硫,是工业提取砷元素的途径之一,写出As2S3转化为H3AsO4的化学方程式____________ ;该反应需要在加压下进行,原因是____________ 。
(2)As2S3可转化为用于治疗白血病的亚砷酸(H3AsO3)。H3AsO3在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图2所示。
①H3AsO3的电离常数分别为Ka1=10-9.2、K a2=10-12.1、K a3=10-13.4,则b点pH=_______________ 。
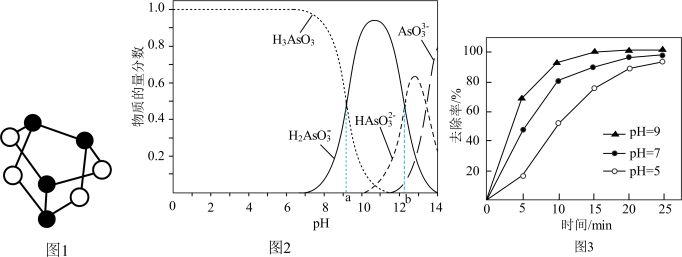
②工业含As(Ⅲ)废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图3所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是____________ 。
(3)水体中As(Ⅲ)的毒性远高于As(V)且As(Ⅴ)更易除去,常用的处理方法是先将废水中的As(Ⅲ)氧化为As(V),再通过一定方法除去As(V)。
①H3AsO3可被H2O2进一步氧化为H3AsO4。H3AsO3的酸性____________ H3AsO4的酸性(填“>”或“<”)。
②在pH=7的水溶液中,以足量的FeCl3为沉淀剂,可将HAsO4-转化为FeAsO4沉淀除去,其离子方程式为____________ 。【已知: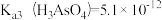 ,
,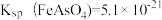 】
】
(4)油画创作通带需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:
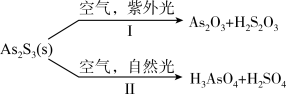
下列说法正确的是____________。

(1)雌黄(As2S3)和雄黄(As4S4)都是提取砷的主要矿物原料。砷元素有+2、+3、+5等常见价态。
①如图1为As4S4分子的空间结构模型。已知As2S3分子中没有π键,其结构式可表示为
②将含砷废渣(主要成分是As2S3)制成浆料再通入O2氧化,转化为H3AsO4和单质硫,是工业提取砷元素的途径之一,写出As2S3转化为H3AsO4的化学方程式
(2)As2S3可转化为用于治疗白血病的亚砷酸(H3AsO3)。H3AsO3在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图2所示。
①H3AsO3的电离常数分别为Ka1=10-9.2、K a2=10-12.1、K a3=10-13.4,则b点pH=
②工业含As(Ⅲ)废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图3所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是
(3)水体中As(Ⅲ)的毒性远高于As(V)且As(Ⅴ)更易除去,常用的处理方法是先将废水中的As(Ⅲ)氧化为As(V),再通过一定方法除去As(V)。
①H3AsO3可被H2O2进一步氧化为H3AsO4。H3AsO3的酸性
②在pH=7的水溶液中,以足量的FeCl3为沉淀剂,可将HAsO4-转化为FeAsO4沉淀除去,其离子方程式为
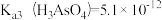 ,
,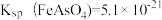 】
】(4)油画创作通带需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:

下列说法正确的是____________。
A.S2O 和SO 和SO 的空间结构都是正四面体形 的空间结构都是正四面体形 |
| B.反应I和Ⅱ中,元素As和S都被氧化 |
| C.反应I和Ⅱ中,氧化1 mol As2S3转移的电子数之比为3:7 |
D.反应I和Ⅱ中,参加反应的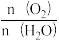 :I<Ⅱ :I<Ⅱ |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
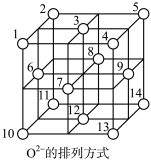
【推荐3】磷、碳、氢、氧等非金属及其化合物用途广泛。回答下列问题:
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为_______ 。(用NA表示阿伏伽德罗常数的值)
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为_______ 。
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为_______ ,产生的阳离子的空间结构为_______ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 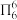 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为_______ ,一定在同一平面上的原子有_______ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,_______ 。
(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。
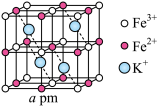
①该化合物的化学式为_______ 。
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g•cm-3(阿伏加德罗常数为NA)
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 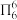 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。

①该化合物的化学式为
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】中医药作为中国优秀传统文化的典范,凝聚着祖先的智慧和经验的结晶。矿物药的成分主要为金属﹑金属氧化物﹑盐等。
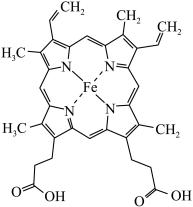
(1)铁华粉常用来治疗血虚萎黄,其成分为醋酸亚铁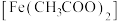 ,其形成的血红素分子结构如图所示。铁位于周期表的
,其形成的血红素分子结构如图所示。铁位于周期表的___________ 区,铁华粉中基态亚铁离子的未成对电子数与其电子总数之比为___________ ,铁华粉中组成元素的电负性由大到小的顺序为___________ (填元素符号),血红素分子中铁(Ⅱ)的配位数为___________ 。
(2)生石灰可用于止血,轻质氧化镁可用于治疗便秘。请比较CaO、MgO的熔点大小,并请解释原因:___________ 。
(3)多原子分子中各原子若在同一平面,且有相互平行的 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成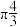 ,则
,则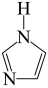 (咪唑)中的“离域
(咪唑)中的“离域 键”可表示为
键”可表示为___________ 。
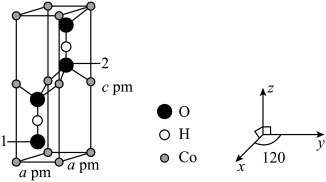
(4)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号 原子的坐标为
原子的坐标为 ,则2号
,则2号 原子的坐标为
原子的坐标为___________ 。设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  (用代数式表示)。
(用代数式表示)。
(1)铁华粉常用来治疗血虚萎黄,其成分为醋酸亚铁
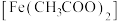 ,其形成的血红素分子结构如图所示。铁位于周期表的
,其形成的血红素分子结构如图所示。铁位于周期表的
(2)生石灰可用于止血,轻质氧化镁可用于治疗便秘。请比较CaO、MgO的熔点大小,并请解释原因:
(3)多原子分子中各原子若在同一平面,且有相互平行的
 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成 ,则
,则 (咪唑)中的“离域
(咪唑)中的“离域 键”可表示为
键”可表示为(4)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号
 原子的坐标为
原子的坐标为 ,则2号
,则2号 原子的坐标为
原子的坐标为 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含 、
、 、
、 、
、 )中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下:
)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下: 、
、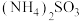 和
和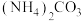 配制。常温下,
配制。常温下, 、
、 、
、 与
与 形成可溶于水的配离子:
形成可溶于水的配离子: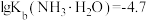 ;
; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。
如下表。
回答下列问题:
(1)“氨浸”时,由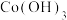 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
(2)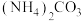 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了
会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了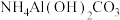 的明锐衍射峰。
的明锐衍射峰。
①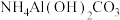 属于
属于_______ (填“晶体”或“非晶体”)。
②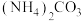 提高了Ni、Co的浸取速率,其原因是
提高了Ni、Co的浸取速率,其原因是_______ 。
(3)①“析晶”过程中通入的酸性气体A为_______ 。
②由 可制备
可制备 晶体,其立方晶胞如图,Al与O最小间距大于Co与O最小间距,x,y为整数,则Co在晶胞中的位置为
晶体,其立方晶胞如图,Al与O最小间距大于Co与O最小间距,x,y为整数,则Co在晶胞中的位置为_______ ;晶体中一个Al周围与其最近的O的个数为_______ 。 溶液中
溶液中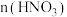 与
与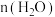 的比值,理论上最高为
的比值,理论上最高为_______ 。
②“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用_______ 和_______ (填化学式)。
 、
、 、
、 、
、 )中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下:
)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下: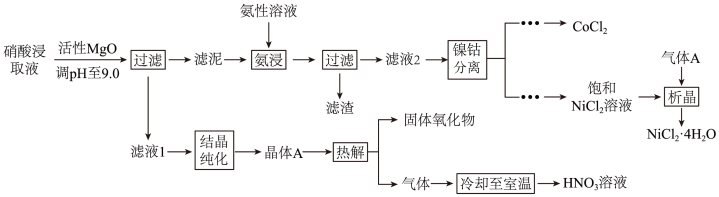
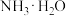 、
、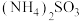 和
和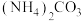 配制。常温下,
配制。常温下, 、
、 、
、 与
与 形成可溶于水的配离子:
形成可溶于水的配离子: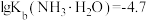 ;
; 易被空气氧化为
易被空气氧化为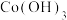 ;部分氢氧化物的
;部分氢氧化物的 如下表。
如下表。氢氧化物 |
|
|
|
|
|
|
|
|
|
|
|
(1)“氨浸”时,由
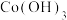 转化为
转化为 的离子方程式为
的离子方程式为(2)
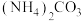 会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了
会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了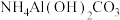 的明锐衍射峰。
的明锐衍射峰。①
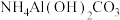 属于
属于②
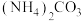 提高了Ni、Co的浸取速率,其原因是
提高了Ni、Co的浸取速率,其原因是(3)①“析晶”过程中通入的酸性气体A为
②由
 可制备
可制备 晶体,其立方晶胞如图,Al与O最小间距大于Co与O最小间距,x,y为整数,则Co在晶胞中的位置为
晶体,其立方晶胞如图,Al与O最小间距大于Co与O最小间距,x,y为整数,则Co在晶胞中的位置为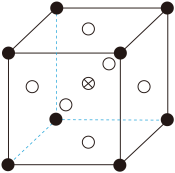
 溶液中
溶液中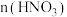 与
与 的比值,理论上最高为
的比值,理论上最高为②“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为________ ,第一电离能最小的元素是________ (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________ (填化学式),呈现如此递变规律的原因是___________________ 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为________ 。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为________________________________________________ g·cm-3(保留两位有效数字)。( =1.732)
=1.732)
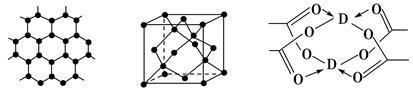
图一 图二 图三
(4)D元素形成的单质,其晶体的堆积模型为________ ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是________ 。请写出上述过程的离子方程式:_________________________________________ 。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为
 =1.732)
=1.732)
图一 图二 图三
(4)D元素形成的单质,其晶体的堆积模型为
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是
您最近一年使用:0次