原子结构与元素周期表存在着内在联系,根据已学知识,请你回答下列问题:
(1)指出31号元素镓Ga)在元素周期表中的位置:_______ 。
(2)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为_______ 。
(3)写出3p轨道上有2个未成对电子的元素的符号:_______ 。
(4)日常生活中广泛使用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为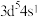 ,该元素的符号是
,该元素的符号是_______ 。
(5)P和S是同一周期的两种元素,P的第一电离能比S大,原因是_______ 。
(1)指出31号元素镓Ga)在元素周期表中的位置:
(2)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为
(3)写出3p轨道上有2个未成对电子的元素的符号:
(4)日常生活中广泛使用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为
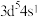 ,该元素的符号是
,该元素的符号是(5)P和S是同一周期的两种元素,P的第一电离能比S大,原因是
更新时间:2024-01-01 11:13:56
|
相似题推荐
【推荐1】铁(Fe)钴(Co)镍(Ni)合金是一种典型的软磁材料,具有优异的磁导率和饱和磁感应强度,可用于电感器、传感器和电磁设备等领域。
(1)中国古代就对磁性材料有研究,四大发明之一的司南是由天然磁石制成的,其主要成分是___________ (选填编号)。
a.Fe b.FeO c. d.
d.
(2)铁的原子结构示意图为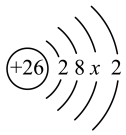 。由此可知,铁是第
。由此可知,铁是第___________ 周期元素,铁原子核外3d轨道上共填充了___________ 个电子。
(3)钴(Co)元素基态原子的电子排布式为___________ ,处于元素周期表的___________ 区。
(4)基态镍(Ni)原子的价电子轨道表示式为___________ 。
(5)磁性材料原子中的未配对电子对其磁性起主要作用,含 磁性材料的磁性比含
磁性材料的磁性比含 的更强,试从结构角度分析原因
的更强,试从结构角度分析原因___________ 。
(6)与Fe、Co、Ni同周期的铜、锌两种元素的第一电离能( ),第二电离能(
),第二电离能( )数据如下表所示:
)数据如下表所示:
请解释铜的 小于锌,
小于锌, 却大于锌的主要原因是
却大于锌的主要原因是___________ 。
(1)中国古代就对磁性材料有研究,四大发明之一的司南是由天然磁石制成的,其主要成分是
a.Fe b.FeO c.
 d.
d.
(2)铁的原子结构示意图为
 。由此可知,铁是第
。由此可知,铁是第(3)钴(Co)元素基态原子的电子排布式为
(4)基态镍(Ni)原子的价电子轨道表示式为
(5)磁性材料原子中的未配对电子对其磁性起主要作用,含
 磁性材料的磁性比含
磁性材料的磁性比含 的更强,试从结构角度分析原因
的更强,试从结构角度分析原因(6)与Fe、Co、Ni同周期的铜、锌两种元素的第一电离能(
 ),第二电离能(
),第二电离能( )数据如下表所示:
)数据如下表所示:电离能/(kJ·mol ) ) |  |  |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
 小于锌,
小于锌, 却大于锌的主要原因是
却大于锌的主要原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】SOCl2(氯化亚砜)是一种重要的化工原料,是常用的氯化剂,也是制造电池的重要原料。
(1)SOCl2是一种液态化合物,沸点为78.4℃,在水中会剧烈水解。在水解得到的溶液中加入AgNO3溶液可得到白色沉淀,水解产生的气体能使品红溶液褪色。
①SOCl2分子的中心原子杂化方式为___________ 。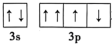 不能表示基态硫原子的价电子轨道表示式,因为违背了
不能表示基态硫原子的价电子轨道表示式,因为违背了___________ 。
②SOCl2的水解方程式为___________ 。
③AlCl3·6H2O加热时得不到AlCl3,但在加入:SOCl2并加热时可得到无水AlCl3,其原因是___________ 。
(2)SOCl2可用于制造心脏起搏器的微型电池。将等物质的量的LiCl、AlCl3溶解在SOCl2溶液中形成电解质溶液,以石墨和锂为电极材料,电池总反应为4Li+2SOCl2=4LiCl+SO2+S,硫和二氧化硫溶解在过量的氯化亚砜电解液中。该电池放电时,Li+移向___________ 极(填“正”或“负”),正极反应式为___________ 。该电池为可充电电池,充电时阴极反应式为___________ 。
(1)SOCl2是一种液态化合物,沸点为78.4℃,在水中会剧烈水解。在水解得到的溶液中加入AgNO3溶液可得到白色沉淀,水解产生的气体能使品红溶液褪色。
①SOCl2分子的中心原子杂化方式为
 不能表示基态硫原子的价电子轨道表示式,因为违背了
不能表示基态硫原子的价电子轨道表示式,因为违背了②SOCl2的水解方程式为
③AlCl3·6H2O加热时得不到AlCl3,但在加入:SOCl2并加热时可得到无水AlCl3,其原因是
(2)SOCl2可用于制造心脏起搏器的微型电池。将等物质的量的LiCl、AlCl3溶解在SOCl2溶液中形成电解质溶液,以石墨和锂为电极材料,电池总反应为4Li+2SOCl2=4LiCl+SO2+S,硫和二氧化硫溶解在过量的氯化亚砜电解液中。该电池放电时,Li+移向
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】铜的化合物种类繁多,应用广泛。请回答:
(1)Cu在周期表中的_______ 区,当焰色试验时Cu的一个3d轨道电子会跃迁至4p轨道,写出该激发态Cu核外的电子排布式_______ 。
(2)[Cu(NH3)4]SO4·H2O是一种农业杀虫剂。
①下列相关说法正确的是_______ 。
A.该化合物中NH3的中心原子的杂化轨道类型为sp3
B.该化合物中存在的化学键有离子键、共价键、配位键和氢键
C.组成该化合物的元素N、O、S中,第一电离能最大的是N
D.根据VSEPR模型预测的 的空间结构是正四面体形
的空间结构是正四面体形
②比较键角∠H-N-H的大小:NH3_______ [Cu(NH3)]2+(填“>”或“<”),理由是_______ 。
(3)某磷青铜晶体的晶胞结构如图所示,则该晶体中与磷原子距离最近的铜原子共有_______ 个,若晶体的密度为 g/cm3,阿伏加德罗常数的值为NA,则晶胞的边长a=
g/cm3,阿伏加德罗常数的值为NA,则晶胞的边长a=_______ nm。
(1)Cu在周期表中的
(2)[Cu(NH3)4]SO4·H2O是一种农业杀虫剂。
①下列相关说法正确的是
A.该化合物中NH3的中心原子的杂化轨道类型为sp3
B.该化合物中存在的化学键有离子键、共价键、配位键和氢键
C.组成该化合物的元素N、O、S中,第一电离能最大的是N
D.根据VSEPR模型预测的
 的空间结构是正四面体形
的空间结构是正四面体形②比较键角∠H-N-H的大小:NH3
(3)某磷青铜晶体的晶胞结构如图所示,则该晶体中与磷原子距离最近的铜原子共有
 g/cm3,阿伏加德罗常数的值为NA,则晶胞的边长a=
g/cm3,阿伏加德罗常数的值为NA,则晶胞的边长a=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硬铝(含少量铜、镁、锰和硅)有良好的机械性能,是制造飞机的理想材料。
(1)写出硅原子最外层电子排布式__________ ;短周期元素A与硅元素同主族,能与氧元素组成化合物AO2,写出AO2的电子式:__________ 。
(2)上述硬铝中所含的主族元素的原子半径由大到小的顺序为:__________ 。
(3)请阐述硬铝是制造飞机的理想材料的原因有:__________ 、__________ 。
(4)工业上可用镁真空炼铷,方程式为2RbCl+Mg MgCl2+2Rb(g),对于此反应能够进行正确的解释是
MgCl2+2Rb(g),对于此反应能够进行正确的解释是 __________ 。
a.Rb比Mg金属性强
b.MgCl2的热稳定性比RbCl 弱
c.高温下Mg2+得电子能力比Rb+弱
d.Rb的沸点比Mg低,当把Rb(g)抽走时,平衡向正反应方向移动
(1)写出硅原子最外层电子排布式
(2)上述硬铝中所含的主族元素的原子半径由大到小的顺序为:
(3)请阐述硬铝是制造飞机的理想材料的原因有:
(4)工业上可用镁真空炼铷,方程式为2RbCl+Mg
 MgCl2+2Rb(g),对于此反应能够进行正确的解释是
MgCl2+2Rb(g),对于此反应能够进行正确的解释是 a.Rb比Mg金属性强
b.MgCl2的热稳定性比RbCl 弱
c.高温下Mg2+得电子能力比Rb+弱
d.Rb的沸点比Mg低,当把Rb(g)抽走时,平衡向正反应方向移动
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】完成下列问题
(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇的结构简式为 。请回答下列问题:
。请回答下列问题:
①基态镍原子的价电子排布式为_______ 。
② ,烯丙醇分子中碳原子的杂化类型为
,烯丙醇分子中碳原子的杂化类型为_______ 。
③某种含Cu2+的化合物可催化烯丙醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在烯丙醇分子中σ键和π键的个数比为_______ 。
(2) 具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则
具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则 中的配位数为
中的配位数为_______ ,配离子的空间构型为_______ 。
(3)铜是重要的过渡元素,能形成多种配合物,如Cu2+与乙二胺可形成如图所示配离子。
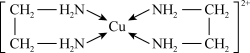
①Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是_______ (填字母序号)。
a.配位键 b.极性键 c.离子键 d.非极性键
②乙二胺和三甲胺 均属于胺。但乙二胺比三甲胺的沸点高很多,原因是
均属于胺。但乙二胺比三甲胺的沸点高很多,原因是_______ 。
(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇的结构简式为
 。请回答下列问题:
。请回答下列问题:①基态镍原子的价电子排布式为
②
 ,烯丙醇分子中碳原子的杂化类型为
,烯丙醇分子中碳原子的杂化类型为③某种含Cu2+的化合物可催化烯丙醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在烯丙醇分子中σ键和π键的个数比为
(2)
 具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则
具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则 中的配位数为
中的配位数为(3)铜是重要的过渡元素,能形成多种配合物,如Cu2+与乙二胺可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是
a.配位键 b.极性键 c.离子键 d.非极性键
②乙二胺和三甲胺
 均属于胺。但乙二胺比三甲胺的沸点高很多,原因是
均属于胺。但乙二胺比三甲胺的沸点高很多,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】哈尔滨工业大学的李惠等人和加州大学洛杉矶分校的黄昱、段镶锋合作合成了具备超轻、高力学强度和超级隔热三大特点的氮化硼(hBNAGs)以及碳化硅( -SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
-SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
(1)硅原子的价电子排布图为___________ 。B、N、O、Al的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(2)硼元素深受配位化学家的喜爱,其原因在于B容易与配体形成配位键,如BF 。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O
。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O H+ + [B(OH)4]−。
H+ + [B(OH)4]−。
① 从原子结构分析B容易与配体形成配位键的原因___________ 。
② 下列有关硼酸及其相关化合物的说法正确的是___________ (填标号)。
A.硼酸的电离过程中有配位键形成
B.硼酸为三元酸
C.Na[B(OH)4]的水溶液呈碱性
D.硼酸和[B(OH)4]−中的键角相同
(3)氨硼烷(NH3BH3)具有良好的储氢能力。已知B、N、H三种元素的电负性如下:
① 下列有关氨硼烷(NH3BH3)的说法中错误的是___________ (填标号)。
A.H元素为+1价
B.氨硼烷中有配位键
C.N和B原子均为sp3杂化
D.氨硼烷在一定条件下能与水反应产生氢气
② 氨硼烷的电子式为___________ ,氨硼烷中H−N−H的键角___________ (填“>”“<”或“=”)H−B−H的键角。
 -SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:
-SiCAGs)陶瓷气凝胶材料,这种坚固的材料系统非常适用于当作极端条件下的超热绝缘体使用,主要用于航天器领域。回答下列问题:(1)硅原子的价电子排布图为
(2)硼元素深受配位化学家的喜爱,其原因在于B容易与配体形成配位键,如BF
 。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O
。硼酸[B(OH)3]在水中电离产生H+过程为:B(OH)3 + H2O H+ + [B(OH)4]−。
H+ + [B(OH)4]−。① 从原子结构分析B容易与配体形成配位键的原因
② 下列有关硼酸及其相关化合物的说法正确的是
A.硼酸的电离过程中有配位键形成
B.硼酸为三元酸
C.Na[B(OH)4]的水溶液呈碱性
D.硼酸和[B(OH)4]−中的键角相同
(3)氨硼烷(NH3BH3)具有良好的储氢能力。已知B、N、H三种元素的电负性如下:
| 元素符号 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
① 下列有关氨硼烷(NH3BH3)的说法中错误的是
A.H元素为+1价
B.氨硼烷中有配位键
C.N和B原子均为sp3杂化
D.氨硼烷在一定条件下能与水反应产生氢气
② 氨硼烷的电子式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知Z基态原子的M层与K层电子数相等,则Z所在周期中第一电离能最大的主族元素是________ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】一种由烯烃合成环氧烷烃的流程如下:
(1)氨的沸点为-33.5℃,氨易液化的原因是_______ 。
(2)钠熔化时破坏的作用力为_______ ;C分子中 键、π键数目之比为
键、π键数目之比为_______ 。
(3)比较熔点:A_______ B(填“高于”或“低于”),判断依据是_______ 。
(4)A和D互为_______ (填“同分异构体”“同素异形体”或“同系物”),A→B的反应类型是_______ 。
(5)E的分子式为_______ ,其所含元素中第一电离能由大到小的顺序为_______ 。

(1)氨的沸点为-33.5℃,氨易液化的原因是
(2)钠熔化时破坏的作用力为
 键、π键数目之比为
键、π键数目之比为(3)比较熔点:A
(4)A和D互为
(5)E的分子式为
您最近一年使用:0次



