下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。试回答下列问题:
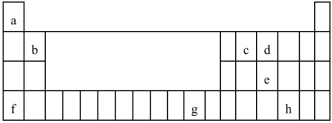
(1)基态f原子中,其占据的最高能层的符号是___________ 。
(2)元素a、c、d以原子个数比1∶1∶1形成的分子的电子式为___________ 。
(3)元素h的基态原子的价电子排布式为___________ 。
(4)元素g的基态g+核外电子的空间运动状态有___________ 种。
(5)某些不同族的元素因电负性相近,其性质也有一定的相似性。如元素b的最高价氧化物对素应的水化物和f的最高价氧化物对应的水化物能相互反应,其离子方程式是___________ 。

(1)基态f原子中,其占据的最高能层的符号是
(2)元素a、c、d以原子个数比1∶1∶1形成的分子的电子式为
(3)元素h的基态原子的价电子排布式为
(4)元素g的基态g+核外电子的空间运动状态有
(5)某些不同族的元素因电负性相近,其性质也有一定的相似性。如元素b的最高价氧化物对素应的水化物和f的最高价氧化物对应的水化物能相互反应,其离子方程式是
更新时间:2024-02-04 13:30:46
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】(一)Na、Cu、O、Si、S、Cl是常见的六种元素.
(1)Na位于元素周期表第__ 周期第__ 族;S的基态原子核外有__ 个未成对电子;
Si的基态原子核外电子排布式为__ .
(2)用“>”或“<”填空:
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取。写出该反应的离子方程式,并标出电子转移的方向和数目___
(二).某元素的原子序数为33,请回答:
(1)该元素原子核外有_______ 个电子层,______ 个能级,______ 个原子轨道。
(2)它的最外层电子排布式为____________ ,它的电子排布式为________ ,轨道表示式为_______________ 。
(1)Na位于元素周期表第
Si的基态原子核外电子排布式为
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2- | NaCl | H2SO4 |
(二).某元素的原子序数为33,请回答:
(1)该元素原子核外有
(2)它的最外层电子排布式为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为__ 个,能量最高的电子占据的能级符号为___ 。
(2)磷的一种同素异形体—白磷(P4)的立体构型为__ ,推测其在CS2中的溶解度__ (填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:__ 。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:___ 。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为__ ,已知晶体的密度为ρg·cm-3,阿伏加 德罗常数为NA,则晶胞边长为__ cm(用含ρ、NA的式子表示)。

(1)钛元素基态原子未成对电子数为
(2)磷的一种同素异形体—白磷(P4)的立体构型为
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题
(1)基态硫原子电子占据的最高能层符号为______ ,核外有______ 种能量不同的电子,硫原子核外电子有______ 种空间运动状态。
(2)与S同主族,位于第四周期的元素的符号是______ ,其价电子排布式为______
(3)已知有下列转化:
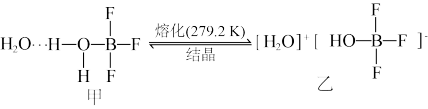
 的VSEPR模型为
的VSEPR模型为______ 。化合物乙中微粒间不存在的化学键有______ (填序号)。
A.离子键 B.共价键 C. 键 D.
键 D. 键 E.氢键
键 E.氢键
(4)相同条件下 与
与 分子在水中的溶解度较大的是
分子在水中的溶解度较大的是______ (写分子式),理由是______ 。 中的
中的 键角
键角______ (填“>”“<”或“=”) 中的
中的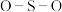 键角。
键角。
(5)已知 是直线形分子,且有对称性,则
是直线形分子,且有对称性,则 分子的结构式为
分子的结构式为______ ,其中 键与
键与 键的个数比为
键的个数比为______ 。
(1)基态硫原子电子占据的最高能层符号为
(2)与S同主族,位于第四周期的元素的符号是
(3)已知有下列转化:
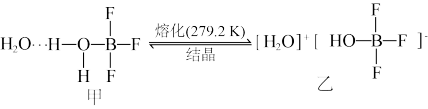
 的VSEPR模型为
的VSEPR模型为A.离子键 B.共价键 C.
 键 D.
键 D. 键 E.氢键
键 E.氢键(4)相同条件下
 与
与 分子在水中的溶解度较大的是
分子在水中的溶解度较大的是 中的
中的 键角
键角 中的
中的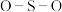 键角。
键角。(5)已知
 是直线形分子,且有对称性,则
是直线形分子,且有对称性,则 分子的结构式为
分子的结构式为 键与
键与 键的个数比为
键的个数比为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】I.纳米氧化亚铜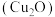 粒径在
粒径在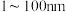 之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
(1)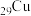 在元素周期表中的位置是第四周期
在元素周期表中的位置是第四周期___________ 族;
(2)基态铜原子的价电子排布式为___________。
(3)在普通玻璃中加入纳米 可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到
可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到___________ 。
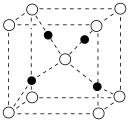
(4) 属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
II. 溶于浓氨水中形成无色的
溶于浓氨水中形成无色的 ,该无色溶液接触空气会很快变成深蓝色。
,该无色溶液接触空气会很快变成深蓝色。
(5) 中
中 的N原子提供
的N原子提供___________ ,与中心离子形成___________ 。
A.空轨道、离子键 B.孤电子对、离子键
C.空轨道、配位键 D.孤电子对、配位键
(6)已知 分子中
分子中 键角为107°,则
键角为107°,则 中
中 键角___________。
键角___________。
(7)无色溶液在空气中变色的原因可表示如下,完成并配平该离子方程式________ (化学计量数若为1可不写)。
III.纳米 的制备方法有多种,常见的有还原法、电解法等。
的制备方法有多种,常见的有还原法、电解法等。
(8)还原法以葡萄糖作为主要原料。能用葡萄糖制备 是因为其分子中含有
是因为其分子中含有___________ (填官能团名称),制备时除了葡萄糖溶液与硫酸铜溶液外,还需要___________ (填试剂名称)。
(9)电解法制备 的装置如图所示,电解过程中阳极依次发生反应:
的装置如图所示,电解过程中阳极依次发生反应:
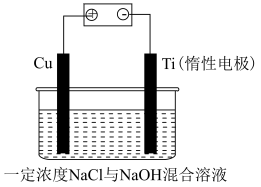
①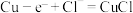
②
③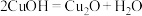
阴极的电极反应式为___________ ;该法制备 的总反应可以表示为:
的总反应可以表示为:___________ 。
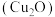 粒径在
粒径在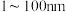 之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。(1)
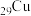 在元素周期表中的位置是第四周期
在元素周期表中的位置是第四周期(2)基态铜原子的价电子排布式为___________。
A. | B.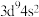 | C. | D. |
(3)在普通玻璃中加入纳米
 可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到
可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到(4)
 属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
A. | B. | C. | D. |
II.
 溶于浓氨水中形成无色的
溶于浓氨水中形成无色的 ,该无色溶液接触空气会很快变成深蓝色。
,该无色溶液接触空气会很快变成深蓝色。(5)
 中
中 的N原子提供
的N原子提供A.空轨道、离子键 B.孤电子对、离子键
C.空轨道、配位键 D.孤电子对、配位键
(6)已知
 分子中
分子中 键角为107°,则
键角为107°,则 中
中 键角___________。
键角___________。| A.大于107° | B.小于107° | C.等于107° | D.等于107° |
(7)无色溶液在空气中变色的原因可表示如下,完成并配平该离子方程式

III.纳米
 的制备方法有多种,常见的有还原法、电解法等。
的制备方法有多种,常见的有还原法、电解法等。(8)还原法以葡萄糖作为主要原料。能用葡萄糖制备
 是因为其分子中含有
是因为其分子中含有(9)电解法制备
 的装置如图所示,电解过程中阳极依次发生反应:
的装置如图所示,电解过程中阳极依次发生反应:
①
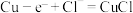
②

③
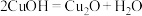
阴极的电极反应式为
 的总反应可以表示为:
的总反应可以表示为:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】废弃化学品循环再利用对节约资源和保护环境有重要意义。钴盐在新能源、催化、印染等领域应用广泛。利用电解工业产生的钴、镍废渣(含Fe、Cu等)制备CoCl2·6H2O,流程如下图所示:
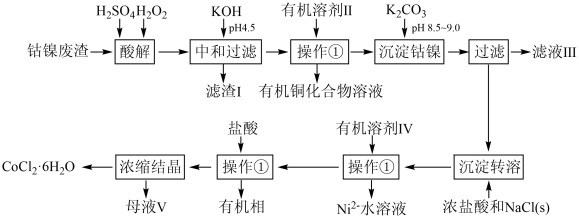
已知:通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全;室温下相关物质的Ksp见下表。
回答下列问题:
(1)基态Co原子的电子排布式为___________ 。
(2)滤渣Ⅰ的主要成分为Fe(OH)3,H2O2氧化Fe2+的离子方程式为___________ 。
(3)操作①是___________ ;滤液III对应溶质的主要成分是___________ (填化学式)。
(4)K2CO3与钴、镍离子反应的产物是氢氧化物沉淀,室温下,在pH8.5~9.0范围内Co2+___________ (填“能”或“不能”)沉淀完全,Co(OH)2易被氧化Co(OH)3,Co(OH)3可氧化浓盐酸,其化学方程式为___________ 。
(5)浓缩结晶后的母液V可返回___________ 工序循环利用。
(6)利用硫化物分离钴镍离子,向浓度同为0.1mol·L-1的Ni2+和Co2+混合溶液中逐滴加入(NH4)2S溶液(忽略溶液体积变化),首先生成硫化物沉淀的离子___________ ;当第二种离子生成硫化物沉淀时,第一种离子的浓度为___________ mol·L-1。

已知:通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全;室温下相关物质的Ksp见下表。
| 物质 | Co(OH)2 | NiS | CoS |
| Ksp | 1×10-14.2 | 1×10-18.5 | 1×10-20.4 |
回答下列问题:
(1)基态Co原子的电子排布式为
(2)滤渣Ⅰ的主要成分为Fe(OH)3,H2O2氧化Fe2+的离子方程式为
(3)操作①是
(4)K2CO3与钴、镍离子反应的产物是氢氧化物沉淀,室温下,在pH8.5~9.0范围内Co2+
(5)浓缩结晶后的母液V可返回
(6)利用硫化物分离钴镍离子,向浓度同为0.1mol·L-1的Ni2+和Co2+混合溶液中逐滴加入(NH4)2S溶液(忽略溶液体积变化),首先生成硫化物沉淀的离子
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构_______ 。
(2)基态Zn的价层电子排布式_______ ,金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(3)NH3的中心原子的杂化方式为_______ ,NH3中H-N-H键角_______ PH3中H-P-H键角(填“大于”、“小于”或“等于”)。
(4)立方ZnS晶体结构如下图所示,其晶胞边长为a pm,密度为_______ g/cm3,A位S2-离子与B位置Zn2+离子之间的距离为_______ pm(列式表示)。
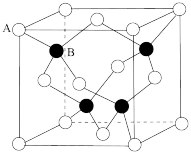
(1)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构
(2)基态Zn的价层电子排布式
(3)NH3的中心原子的杂化方式为
(4)立方ZnS晶体结构如下图所示,其晶胞边长为a pm,密度为

您最近半年使用:0次



