回答下列问题:
(1)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构_______ 。
(2)基态Zn的价层电子排布式_______ ,金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(3)NH3的中心原子的杂化方式为_______ ,NH3中H-N-H键角_______ PH3中H-P-H键角(填“大于”、“小于”或“等于”)。
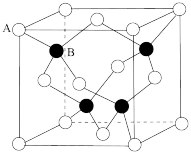
(4)立方ZnS晶体结构如下图所示,其晶胞边长为a pm,密度为_______ g/cm3,A位S2-离子与B位置Zn2+离子之间的距离为_______ pm(列式表示)。
(1)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构
(2)基态Zn的价层电子排布式
(3)NH3的中心原子的杂化方式为
(4)立方ZnS晶体结构如下图所示,其晶胞边长为a pm,密度为

更新时间:2023-01-14 12:17:09
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数;R和T在同一族;N的外围电子总数为6,均为未成对电子。根据以上信息,回答下列问题:
(1)T的元素符号为___________ ,在周期表中位于__________ 族,N的价电子排布式为___________ 。
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式:_________________________ 。
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为_____________ 。

(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为__________ ,配位数为__________ 。N与甲基丙烯酸根的配合物为:
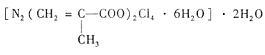 该化合物中存在的化学键类型有
该化合物中存在的化学键类型有__________ 。甲基丙烯酸分子中C原子的杂化方式有_____________ 。
(1)T的元素符号为
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式:
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为

(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为
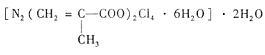 该化合物中存在的化学键类型有
该化合物中存在的化学键类型有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铜、锌及其化合物用途广泛。回答下列问题:
(1)Zn2+的价层电子轨道表示式为_______ 。
(2)元素第二电离能(I2):Zn_______ Cu(填“>”“<”或“=”)。
(3)卤化锌的熔点如表所示:
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因_______ 。
②ZnF2的熔点远高于其它三种卤化锌,其原因为_______ 。
(4)邻氨基吡啶( )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。

①邻氨基吡啶的铜配合物中,C原子杂化类型为_______ 。
②1mol 中σ键的数目为
中σ键的数目为_______ 。
(5)铜的晶胞为面心立方(如图所示),已知晶胞参数为a,则该晶胞的空间利用率为_______ 。(圆周率为π)。

(1)Zn2+的价层电子轨道表示式为
(2)元素第二电离能(I2):Zn
(3)卤化锌的熔点如表所示:
| ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
| 熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因
②ZnF2的熔点远高于其它三种卤化锌,其原因为
(4)邻氨基吡啶(
 )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
①邻氨基吡啶的铜配合物中,C原子杂化类型为
②1mol
 中σ键的数目为
中σ键的数目为(5)铜的晶胞为面心立方(如图所示),已知晶胞参数为a,则该晶胞的空间利用率为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】元素周期表中第四周期的某些过渡元素(如V、Zn、Co等)在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①基态钒原子的价层电子排布式为___________ 。
②V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为___________ 。

(2)Co(NH3)5Cl3是钴的一种配合物,中心离子的配位数为6,向100 mL0.2 mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74 g白色沉淀。
①N的第一电离能___________ O的第一电离能。 (填“大于”“小于”“等于”)
②则该配合物中配离子的化学式为___________ 。
(3)ZnF2是生成良好的光学基质材料KZnF3的原料,ZnF2、KZnF3两种晶体的晶胞结构分别如图所示:

①已知:ZnF2的熔点为872 ℃,ZnCl2的熔点为275 ℃,ZnBr2的熔点为394 ℃,ZnBr2的熔点高于ZnCl2的原因为___________ 。
②KZnF3晶体(晶胞顶点为K+)中,与Zn2+最近且等距离的F-数为___________ 。
③若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为___________ g·cm-3(用含a、c、NA的代数式表示)。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①基态钒原子的价层电子排布式为
②V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为

(2)Co(NH3)5Cl3是钴的一种配合物,中心离子的配位数为6,向100 mL0.2 mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74 g白色沉淀。
①N的第一电离能
②则该配合物中配离子的化学式为
(3)ZnF2是生成良好的光学基质材料KZnF3的原料,ZnF2、KZnF3两种晶体的晶胞结构分别如图所示:

①已知:ZnF2的熔点为872 ℃,ZnCl2的熔点为275 ℃,ZnBr2的熔点为394 ℃,ZnBr2的熔点高于ZnCl2的原因为
②KZnF3晶体(晶胞顶点为K+)中,与Zn2+最近且等距离的F-数为
③若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】开发新型储氢材料是氢能利用的重要研究方向。
(1) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
①基态原子Ti有_______ 种能量不同的电子,基态 的未成对电子有
的未成对电子有_______ 个。
② 由
由 和
和 构成,
构成, 的立体构型是
的立体构型是_______ 。
③Li、B、H元素的电负性由大到小排列顺序为_______ 。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径
_______ (填“ ”、“
”、“ ”或:“
”或:“ ”)
”) 。
。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
该储氢材料的化学式为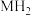 ,其晶胞结构如图所示。已知该晶体的密度
,其晶胞结构如图所示。已知该晶体的密度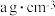 ,则该晶胞的体积为
,则该晶胞的体积为_______  [用a、
[用a、 表示(
表示( 为阿伏加德罗常数的值)]。
为阿伏加德罗常数的值)]。
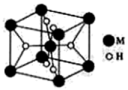
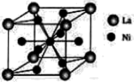
(3)氨硼烷与镧镍合金( )都是优良的储氢材料。
)都是优良的储氢材料。
①镧镍合金的晶胞结构示意图如下图所示(只有1个原子位于晶胞内部),则
_______ 。
②氦硼烷(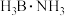 )在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则在下列各项中,立方氮化硼晶体不可用作
)在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则在下列各项中,立方氮化硼晶体不可用作_______ (填字母)。
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头
(1)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①基态原子Ti有
 的未成对电子有
的未成对电子有②
 由
由 和
和 构成,
构成, 的立体构型是
的立体构型是③Li、B、H元素的电负性由大到小排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径

 ”、“
”、“ ”或:“
”或:“ ”)
”) 。
。②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
 |  |  |  | 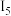 | |
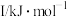 | 738 | 1451 | 7733 | 10540 | 13630 |
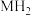 ,其晶胞结构如图所示。已知该晶体的密度
,其晶胞结构如图所示。已知该晶体的密度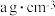 ,则该晶胞的体积为
,则该晶胞的体积为 [用a、
[用a、 表示(
表示( 为阿伏加德罗常数的值)]。
为阿伏加德罗常数的值)]。
(3)氨硼烷与镧镍合金(
 )都是优良的储氢材料。
)都是优良的储氢材料。①镧镍合金的晶胞结构示意图如下图所示(只有1个原子位于晶胞内部),则


②氦硼烷(
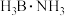 )在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则在下列各项中,立方氮化硼晶体不可用作
)在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则在下列各项中,立方氮化硼晶体不可用作a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铜矿( CuFeS2)是炼铜的最主要矿物。火法冶炼黄钢矿的过程中,其中一步反应是:2Cu2O+Cu2S 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+价电子的电子排布图为___________ ,Cu2O与Cu2S比较,熔点较高的是___________ ,原因为______________________ 。
(2)SO2与SO3的键角相比,键角更小的是___________ 。某种硫的氧化物冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构片段如图1所示。此固态物质中S原子的杂化轨道类型是___________ ;该物质的化学式为___________ 。

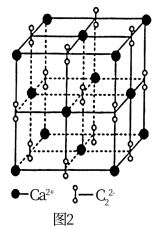
(3)离子化合物CaC2的晶体结构如图2所示。写出该物质的电子式___________ 。从钙离子看该晶体属于___________ 堆积,一个晶胞含有的π键平均有___________ 个。
(4)根据图3可知,与每个C60分子距离最近且相等的C60分子有___________ 个,其距离为___________ cm(列出计算式即可)。
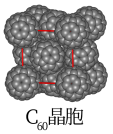
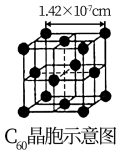
图3
 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。(1)Cu+价电子的电子排布图为
(2)SO2与SO3的键角相比,键角更小的是

(3)离子化合物CaC2的晶体结构如图2所示。写出该物质的电子式

(4)根据图3可知,与每个C60分子距离最近且相等的C60分子有


图3
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】已知A、B、C、D和E 5种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是___________________________ ;
(2)B和C的分子式分别是__________ 和__________ ;C分子的立体结构呈_______ 形,该分子属于__________ 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是________ ,该反应的化学方程式是______________________________________________ 。
(4)若将1 mol E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E的分子式是_____________ 。
(1)组成A分子的原子的核外电子排布式是
(2)B和C的分子式分别是
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是
(4)若将1 mol E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E的分子式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】第四周期中的18种元素具有重要的用途,请回答下列问题。
(1)若向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+,写出与SCN—互为等电子体的非极性分子的化学式___________ (任写一种)。
(2)钛被称为继铁。铝之后的“第三金属”,也叫“未来金属”。基态Ti原子的电子占据了___________ 个原子轨道。
(3)基态Fe原子有___________ 个未成对电子。
(4)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________ 个铜原子。
(5)与H2O互为等电子体的一种阳离子为___________ (填化学式);H2O与CH3CH2OH 可以任意比例互溶,除因为它们都是极性分子外,还因为___________ 。
(1)若向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+,写出与SCN—互为等电子体的非极性分子的化学式
(2)钛被称为继铁。铝之后的“第三金属”,也叫“未来金属”。基态Ti原子的电子占据了
(3)基态Fe原子有
(4)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为
(5)与H2O互为等电子体的一种阳离子为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】我国已成为氟最大产销国。由于其产品具有高附加值,其氟化工也被称之为“黄金产业”。
I.从氟硅酸(H2SiF6)制备氟化钙的流程如图:

(1)该工艺流程中可以循环使用的物质是_______ 。
(2)聚四氟乙烯反应釜中发生反应的化学方程式为_______ 。
II.氟化钙与浓硫酸反应可以制取HF,电子级HF是半导体材料的重要原材料。其中电子级HF的制取工艺流程如图:

(3)精制HF过程中,用高锰酸钾溶液(氧化剂)进行化学预处理,将AsF3氧化,氧化得到的物质AsF5与HF沸点相差较大,可以在后续精馏过程中除去。其化学处理的离子方程式为_______ 。
(4)氢氟酸是弱酸, ,Ka=6.3×10-3,当其浓度大于5.0mol/L时,溶液的酸性变强,试从结构的角度分析其可能的原因是
,Ka=6.3×10-3,当其浓度大于5.0mol/L时,溶液的酸性变强,试从结构的角度分析其可能的原因是_______ 。
(5)氟化钙的晶胞如图所示,则钙离子的配位数为_______ ,若晶胞参数为acm,则该晶体的密度为_______ g·cm-3(设CaF2的摩尔质量为Mg/mol)。
I.从氟硅酸(H2SiF6)制备氟化钙的流程如图:

(1)该工艺流程中可以循环使用的物质是
(2)聚四氟乙烯反应釜中发生反应的化学方程式为
II.氟化钙与浓硫酸反应可以制取HF,电子级HF是半导体材料的重要原材料。其中电子级HF的制取工艺流程如图:

(3)精制HF过程中,用高锰酸钾溶液(氧化剂)进行化学预处理,将AsF3氧化,氧化得到的物质AsF5与HF沸点相差较大,可以在后续精馏过程中除去。其化学处理的离子方程式为
(4)氢氟酸是弱酸,
 ,Ka=6.3×10-3,当其浓度大于5.0mol/L时,溶液的酸性变强,试从结构的角度分析其可能的原因是
,Ka=6.3×10-3,当其浓度大于5.0mol/L时,溶液的酸性变强,试从结构的角度分析其可能的原因是(5)氟化钙的晶胞如图所示,则钙离子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】选考【化学——选修3:物质结构与性质】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等。回答下列问题:
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于____ (填“晶体”或“非晶体”)。
(2)基态铜原子的核外电子排布式为____ ;在CuSO4溶液中滴入过量氨水,形成配合物的颜色为____ 。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为________ ;卤素(SCN)2对应的酸有两种,理论推测硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是____ 。
(4)金属锌晶体的堆积方式为____ 。在ZnS晶胞中(结构如图1所示),S2-的配位数为____ 。

(5)铜有两种氧化物CuO、Cu2O,高温时易转化为Cu2O的原因为____ (请从原子结构的角度解释)。
(6)铜与金形成的金属互化物结构如图2所示,其晶胞边长为apm,该金属互化物的密度为____ g/cm3。(用含a、NA的代数式表示)
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于
(2)基态铜原子的核外电子排布式为
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为
(4)金属锌晶体的堆积方式为

(5)铜有两种氧化物CuO、Cu2O,高温时易转化为Cu2O的原因为
(6)铜与金形成的金属互化物结构如图2所示,其晶胞边长为apm,该金属互化物的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为______ 。N、O、S三种元素的第一电离能由大到小的顺序为________ (填元素符号)。
②Cu(NH3)4SO4中所含的化学键有_________ 。
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根据等电子体原理,CO分子的结构式为_________ 。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图1所示),a位置上Cl原子的杂化轨道类型为_______ 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为_________ 。

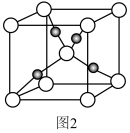
(4)Cu2O晶胞结构如图2所示,该晶胞的边长为a cm,则Cu2O的密度为____ g·cm-3(用NA表示阿伏加德罗常数的数值)。
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为
②Cu(NH3)4SO4中所含的化学键有
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根据等电子体原理,CO分子的结构式为
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图1所示),a位置上Cl原子的杂化轨道类型为


(4)Cu2O晶胞结构如图2所示,该晶胞的边长为a cm,则Cu2O的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态16N中,其s能电子云形状是_____ 形的,其p能级轨道上存在______ 个自旋方向相同的电子;CN-中共价键的类型有______ 。
(2)碱性肥料氰氮化钙(CaCN2)的组成元素第一电离能最小的是_______ (填名称)。
(3)化合物(CH3)3N能溶于水,其原因是_______________ ,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为__________________ .。
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A的结构如图1所示,则S原子的杂化轨道类型是______ ,阴离子A的化学式为______ 。
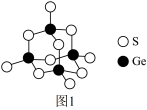

(5)立方氮化硼的晶胞如图2所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为______ ;若晶胞边长为acm,则立方氮化硼的密度是______ g·cm-3(只要求列算式,阿伏伽德罗常数用NA表示)。
(1)在基态16N中,其s能电子云形状是
(2)碱性肥料氰氮化钙(CaCN2)的组成元素第一电离能最小的是
(3)化合物(CH3)3N能溶于水,其原因是
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A的结构如图1所示,则S原子的杂化轨道类型是


(5)立方氮化硼的晶胞如图2所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】磷元素常用于光电子应用及光催化剂材料。回答下列问题:
(1)白磷(P4)在氯气中燃烧生成PCl3和PCl5,产生大量白色烟雾。
①形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态原子的价层电子轨道表示式为____ 。
②一种理论认为PCl5是共价化合物,其分子的空间结构为___ 。但研究表明,PCl5加压下于148℃液化能发生与水类似的自耦电离,形成一种能导电的熔体,该熔体中阳离子的电子式为____ ;N和P都有+5价,PCl5能形成离子型晶体,但NCl5不存在,从原子结构的角度分析其原因是___ 。
(2)黑磷的正交晶系晶体结构如图A所示,结构中只有-一种等效的三配位P,所有P原子的成键环境一样,晶胞参数a=0.3310nm,b=0.4370nm,c=1.0480nm,α=β=r=90°,编号为I的P原子的晶胞内坐标为(0.500,0.090,0.598)。黑磷烯的结构如图B所示,是与石墨烯结构相似的二维的单层黑磷,其中P的配位数为3。
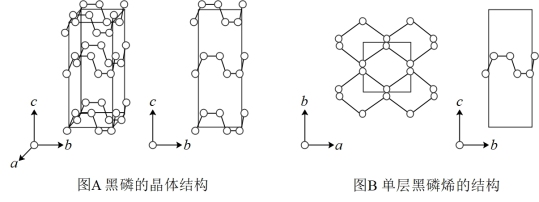
①黑磷中P原子杂化类型是___ 。黑磷中不存在____ (填标号)。
A.共价键 B.σ键 C.π键 D.范德华力
②图A中编号为II的P原子的坐标为___ ,黑磷的晶胞中含有____ 个P原子,以NA为阿伏加德罗常数的值,则黑磷晶体的密度ρ=___ g·cm-3.(列出计算式)
(1)白磷(P4)在氯气中燃烧生成PCl3和PCl5,产生大量白色烟雾。
①形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态原子的价层电子轨道表示式为
②一种理论认为PCl5是共价化合物,其分子的空间结构为
(2)黑磷的正交晶系晶体结构如图A所示,结构中只有-一种等效的三配位P,所有P原子的成键环境一样,晶胞参数a=0.3310nm,b=0.4370nm,c=1.0480nm,α=β=r=90°,编号为I的P原子的晶胞内坐标为(0.500,0.090,0.598)。黑磷烯的结构如图B所示,是与石墨烯结构相似的二维的单层黑磷,其中P的配位数为3。

①黑磷中P原子杂化类型是
A.共价键 B.σ键 C.π键 D.范德华力
②图A中编号为II的P原子的坐标为
您最近一年使用:0次



