下列说法正确的是
A.恒温恒压条件下,通入稀有气体,可以提高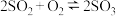 的反应速率 的反应速率 |
| B.使用催化剂,能降低反应的活化能,增大反应物的平衡转化率 |
C.某反应的 , , ,则低温条件下可自发进行 ,则低温条件下可自发进行 |
D.C(石墨,s)=C(金刚石,s);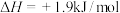 ,则金刚石比石墨稳定 ,则金刚石比石墨稳定 |
更新时间:2024-02-16 08:19:14
|
相似题推荐
【推荐1】下列实验方案不能 达到实验目的的是
| 选项 | 实验方案 | 实验目的 |
| A | 向两份KMnO4酸性溶液中分别通入足量乙烯及足量苯 | 验证苯分子中不存在碳碳双键 |
| B | 向FeCl3和KSCN的混合溶液中加入固体KCl | 验证生成物浓度改变对化学平衡的影响 |
| C | 向饱和溴水中通入SO2气体 | 验证SO2具有还原性 |
| D | 相同温度下,用pH计测定等物质的量浓度的CH3COONa溶液和NaClO溶液的pH | 比较CH3COOH和HClO的酸性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】利用CO2—CH4超干法重整制合成气(CO+H2),主要反应如下。
反应Ⅰ:CH4(g)+CO2(g)⇌2CO(g)+2H2(g);ΔH1=+247 kJ·mol-1。
反应Ⅱ: CH4(g)+3CO2(g)⇌4CO(g)+2H2O(g);ΔH2=+330 kJ·mol-1。
反应Ⅲ: CO(g)+H2O(g)⇌CO2(g)+H2(g);ΔH3=-41 kJ·mol-1。
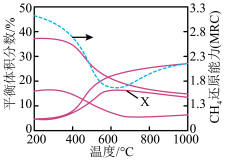
恒压条件下,n始(CO2)∶n始(CH4)=3.3时, 若仅考虑上述反应,平衡时CO2、CH4、CO、H2的体积分数和CH4的还原能力随温度的变化如图所示。已知:工业上将干重整反应中CH4的还原能力(MRC)定义为一个CH4分子消耗的CO2分子的数量。数量越大,还原能力越强。下列说法正确的是
反应Ⅰ:CH4(g)+CO2(g)⇌2CO(g)+2H2(g);ΔH1=+247 kJ·mol-1。
反应Ⅱ: CH4(g)+3CO2(g)⇌4CO(g)+2H2O(g);ΔH2=+330 kJ·mol-1。
反应Ⅲ: CO(g)+H2O(g)⇌CO2(g)+H2(g);ΔH3=-41 kJ·mol-1。
恒压条件下,n始(CO2)∶n始(CH4)=3.3时, 若仅考虑上述反应,平衡时CO2、CH4、CO、H2的体积分数和CH4的还原能力随温度的变化如图所示。已知:工业上将干重整反应中CH4的还原能力(MRC)定义为一个CH4分子消耗的CO2分子的数量。数量越大,还原能力越强。下列说法正确的是

A.反应Ⅱ的平衡常数为K=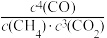 |
| B.图中曲线X表示平衡时H2的体积分数随温度的变化 |
| C.温度在600~1 000 ℃间,升高温度对反应Ⅰ的影响程度大于反应Ⅱ |
| D.其他条件不变,增大压强或选择合适的催化剂均能提高CO的平衡产率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】反应 可用于纯硅的制备。下列有关该反应的说法正确的是
可用于纯硅的制备。下列有关该反应的说法正确的是
 可用于纯硅的制备。下列有关该反应的说法正确的是
可用于纯硅的制备。下列有关该反应的说法正确的是A.该反应 、 、 |
B.该反应的平衡常数 |
C.高温下反应每生成 需消耗 需消耗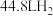 |
D.用E表示键能,该反应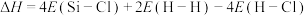 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法或表述正确的是
①常温时 的KOH溶液与
的KOH溶液与 的醋酸等体积混合,所得溶液
的醋酸等体积混合,所得溶液
②二氧化硅是酸性氧化物,但它能与某种酸反应
③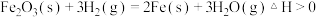 ,
,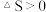 任何条件下都不能自发进行
任何条件下都不能自发进行
④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应: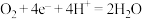
⑥ 的燃烧热为
的燃烧热为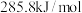 ,则表示
,则表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为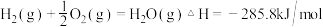 。
。

①常温时
 的KOH溶液与
的KOH溶液与 的醋酸等体积混合,所得溶液
的醋酸等体积混合,所得溶液
②二氧化硅是酸性氧化物,但它能与某种酸反应
③
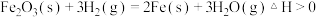 ,
,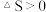 任何条件下都不能自发进行
任何条件下都不能自发进行 ④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应:
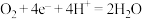
⑥
 的燃烧热为
的燃烧热为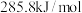 ,则表示
,则表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为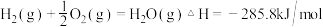 。
。| A.①④ | B.①② | C.④⑥ | D.③⑤ |
您最近一年使用:0次

 反应开始时,反应物按物质的量之比1∶1投料,在温度分别为340K、350K下反应,测得乙酸甲酯转化率(
反应开始时,反应物按物质的量之比1∶1投料,在温度分别为340K、350K下反应,测得乙酸甲酯转化率( )随时间(t)的变化关系如图所示。下列说法错误的是
)随时间(t)的变化关系如图所示。下列说法错误的是

 最大的点是C
最大的点是C

