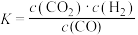利用CO2—CH4超干法重整制合成气(CO+H2),主要反应如下。
反应Ⅰ:CH4(g)+CO2(g)⇌2CO(g)+2H2(g);ΔH1=+247 kJ·mol-1。
反应Ⅱ: CH4(g)+3CO2(g)⇌4CO(g)+2H2O(g);ΔH2=+330 kJ·mol-1。
反应Ⅲ: CO(g)+H2O(g)⇌CO2(g)+H2(g);ΔH3=-41 kJ·mol-1。
恒压条件下,n始(CO2)∶n始(CH4)=3.3时, 若仅考虑上述反应,平衡时CO2、CH4、CO、H2的体积分数和CH4的还原能力随温度的变化如图所示。已知:工业上将干重整反应中CH4的还原能力(MRC)定义为一个CH4分子消耗的CO2分子的数量。数量越大,还原能力越强。下列说法正确的是
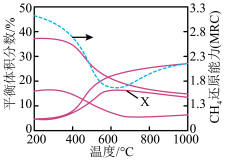
反应Ⅰ:CH4(g)+CO2(g)⇌2CO(g)+2H2(g);ΔH1=+247 kJ·mol-1。
反应Ⅱ: CH4(g)+3CO2(g)⇌4CO(g)+2H2O(g);ΔH2=+330 kJ·mol-1。
反应Ⅲ: CO(g)+H2O(g)⇌CO2(g)+H2(g);ΔH3=-41 kJ·mol-1。
恒压条件下,n始(CO2)∶n始(CH4)=3.3时, 若仅考虑上述反应,平衡时CO2、CH4、CO、H2的体积分数和CH4的还原能力随温度的变化如图所示。已知:工业上将干重整反应中CH4的还原能力(MRC)定义为一个CH4分子消耗的CO2分子的数量。数量越大,还原能力越强。下列说法正确的是

A.反应Ⅱ的平衡常数为K=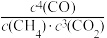 |
| B.图中曲线X表示平衡时H2的体积分数随温度的变化 |
| C.温度在600~1 000 ℃间,升高温度对反应Ⅰ的影响程度大于反应Ⅱ |
| D.其他条件不变,增大压强或选择合适的催化剂均能提高CO的平衡产率 |
更新时间:2023-02-11 13:40:22
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】在一定条件下,将2molNO和1molO2通入恒容密闭容器中进行反应,容器中发生两个反应2NO(g)+O2(g) 2NO2(g)△H<0和2NO2(g)
2NO2(g)△H<0和2NO2(g) N2O4(g)△H<0。在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如图所示。下列说法错误的是
N2O4(g)△H<0。在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如图所示。下列说法错误的是

 2NO2(g)△H<0和2NO2(g)
2NO2(g)△H<0和2NO2(g) N2O4(g)△H<0。在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如图所示。下列说法错误的是
N2O4(g)△H<0。在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如图所示。下列说法错误的是
| A.曲线c代表NO2的物质的量与温度的关系 |
B.2NO+O2 2NO2的平衡常数:x点>y点 2NO2的平衡常数:x点>y点 |
C.y点时2NO+O2 2NO2的反应速率:v正<v逆 2NO2的反应速率:v正<v逆 |
| D.400~1200℃时,随着温度升高,N2O4的体积分数不断减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列有关反应原理的说法正确的是
| A.放热反应的反应速率总是大于吸热反应的反应速率 |
| B.化学反应速率越快可逆反应正向进行的程度越大 |
| C.活化分子的平均能量称为活化能,任何化学反应都有活化能 |
| D.应用盖斯定律可计算某些难以直接测量的反应的焓变 |
您最近一年使用:0次
【推荐1】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)  2CO(g) △H>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g) △H>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
 2CO(g) △H>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g) △H>0,分别在一定温度下达到化学平衡状态。下列说法正确的是 | 容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(CO2) | n(C) | n(CO) | n(CO) | ||
| I | 977 | 0.28 | 0.56 | 01 | 0.4 |
| Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
| Ⅲ | 1250 | 0 | 0 | 0.56 | y |
| A.977K,该反应的化学平衡常数值为 1 |
| B.达到平衡时,向容器I中增加C的量 平衡向右移动 |
| C.达到平衡时,容器Ⅱ中CO2的转化率比容器I中的大 |
| D.达到平衡时,容器Ⅲ中的CO 的转化率大于28.6% |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】根据实验目的设计方案并进行实验,观察到相关现象,其中设计 和结论均 合理的是
实验目的 | 实验方案设计 | 现象 | 结论 | |
| A | 探究 与 与 的氧化性强弱 的氧化性强弱 | 向 溶液中加入过量 溶液中加入过量 溶液充分反应,再滴加淀粉溶液 溶液充分反应,再滴加淀粉溶液 | 溶液变蓝色 | 氧化性: |
| B | 比较 与 与 结合 结合 的能力 的能力 | 常温,测定 溶液的 溶液的 |  | 结合 能力: 能力: |
| C | 探究温度对化学平衡的影响 | 将 的 的 溶液加热后置于冷水中,观察现象 溶液加热后置于冷水中,观察现象 | 加热后溶液为黄绿色,冷水中变为蓝绿色 | 说明降低温度,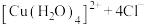  向正反应方向移动 向正反应方向移动 |
| D | 比较 与 与 的 的 | 向含有浓度均为 的 的 溶液中,逐滴滴加 溶液中,逐滴滴加 溶液 溶液 | 先生成白色 沉淀 沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应①: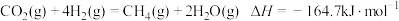
反应②:
反应③:
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是
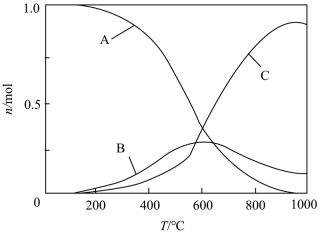
反应①:
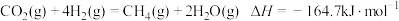
反应②:

反应③:

向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是

A.反应①的平衡常数可表示为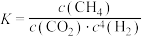 |
B.图中曲线C表示 的物质的量随温度的变化 的物质的量随温度的变化 |
| C.提高CO2转化为CH4的转化率,需要研发在高温区高效的催化剂 |
D. 的 的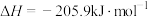 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】T℃时,向某恒容密闭容器中充入气体P和Q,使P(g)与Q(g)发生反应生成R(g)。反应过程中P、Q、R的物质的量随时间的变化如图1所示;温度分别为T1和T2时,Q的体积分数与时间的关系如图2所示;仅改变某一条件,反应过程中P、Q、R的物质的量随时间变化如图3所示。下列说法错误的是
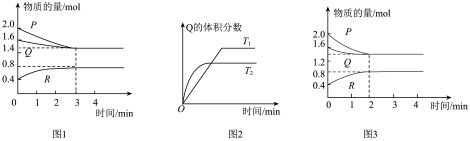

| A.由图1可知,该反应的平衡常数K≈16.7 |
| B.由图2可知,该反应为吸热反应 |
| C.由图3可知,改变的某一条件可能是加入适宜的催化剂 |
| D.由图1和图3可知,反应达到平衡后,P的转化率均为30% |
您最近一年使用:0次


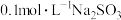 溶液加热到40℃,用传感器监测溶液pH变化
溶液加热到40℃,用传感器监测溶液pH变化 水解平衡正向移动
水解平衡正向移动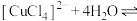
 溶液
溶液


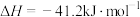

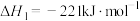

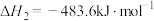


 的燃烧热为
的燃烧热为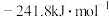
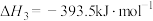
 平衡常数表达式为
平衡常数表达式为