人们日常生产生活与化学有着紧密的联系。
(1)现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答:
①常温下, 溶液加水稀释,下列数值一定变小的是
溶液加水稀释,下列数值一定变小的是___________ (填字母)。
A.c(H+) B. C.
C.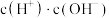 D.
D.
②取10mL乙溶液,加入少量无水CH3COONa固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的值将
的值将___________ (填“增大”“减小”或“无法确定”)。
③相同条件下,取等体积的甲、乙两溶液,分别与0.1mol/LNaOH溶液反应,消耗NaOH溶液的体积(甲)___________ (乙)(填“>”“<”或“=”)。
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示:
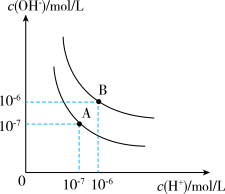
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为___________ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
①CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________ 。
②同浓度的CH3COO-、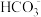 、
、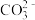 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为___________ 。
③将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:___________ 。
④将SO2通入该氨水中,当c(OH-)降至 时,溶液中的
时,溶液中的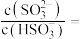
___________ 。
⑤下列微粒在溶液中不能大量共存的是___________ 。
A. 、
、 B.ClO-、
B.ClO-、 C.
C. 、
、 D.HClO、
D.HClO、
(1)现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答:
①常温下,
 溶液加水稀释,下列数值一定变小的是
溶液加水稀释,下列数值一定变小的是A.c(H+) B.
 C.
C.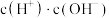 D.
D.
②取10mL乙溶液,加入少量无水CH3COONa固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
 的值将
的值将③相同条件下,取等体积的甲、乙两溶液,分别与0.1mol/LNaOH溶液反应,消耗NaOH溶液的体积(甲)
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示:

25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
| 弱电解质 | 电离常数(Ka) | |
| NH3·H2O | Kb=1.8×10-5 | |
| HClO | Kₐ=4.7×10-8 | |
| H2CO3 | Ka1=4.2×10-7 | Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.54×10-2 | Ka2=1.02×10-7 |
| CH3COOH | Kₐ=1.7×10-5 | |
②同浓度的CH3COO-、
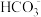 、
、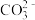 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为③将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:
④将SO2通入该氨水中,当c(OH-)降至
 时,溶液中的
时,溶液中的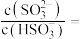
⑤下列微粒在溶液中不能大量共存的是
A.
 、
、 B.ClO-、
B.ClO-、 C.
C. 、
、 D.HClO、
D.HClO、
更新时间:2024-02-22 20:31:30
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】室温下,将CH3COOH溶液和NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
(1)写出CH3COOH和NaOH该反应的离子方程式:___________ ;
(2)实验①反应后的溶液pH=9的原因是___________ (用离子方程式表示)。
(3)实验①和实验②中水的电离程度较大的是___________ ,实验②反应后的溶液中c(CH3COO-)___________ c(Na+)(填“>”“<”或“=”)。
(4)x___________ 0.2(填“>”“<”或“=”),该实验选择的指示剂为___________ 。
| 实验编号 | 起始浓度/(mol·L-1) | 反应后 溶液的pH | |
| c(CH3COOH) | c(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
(2)实验①反应后的溶液pH=9的原因是
(3)实验①和实验②中水的电离程度较大的是
(4)x
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】现有下列物质:①生石灰②NaHSO4固体③氯气④单质铁⑤CO2⑥熔融MgCl2⑦稀盐酸⑧FeCl3溶液⑨Ba(OH)2固体 固体。请填空:
固体。请填空:
(1)上述状态下可导电的物质是______ (填标号,下同),属于电解质的是______ 。
(2)⑨溶于水时的电离方程式为______ ,②溶于水时的电离方程式为______ 。
(3)③与④反应的的化学方程式为______ ,①与⑦反应的离子方程式______ ,由FeCl3溶液制备Fe(OH) 3胶体的离子方程式______ 。
(4)向Ba(OH) 2溶液中滴加NaHSO4溶液,使 恰好沉淀完全,反应的离子方程式为
恰好沉淀完全,反应的离子方程式为______ ; 恰好沉淀完全后,若继续滴加NaHSO4溶液,反应的离子方程式为
恰好沉淀完全后,若继续滴加NaHSO4溶液,反应的离子方程式为______ 。
 固体。请填空:
固体。请填空:(1)上述状态下可导电的物质是
(2)⑨溶于水时的电离方程式为
(3)③与④反应的的化学方程式为
(4)向Ba(OH) 2溶液中滴加NaHSO4溶液,使
 恰好沉淀完全,反应的离子方程式为
恰好沉淀完全,反应的离子方程式为 恰好沉淀完全后,若继续滴加NaHSO4溶液,反应的离子方程式为
恰好沉淀完全后,若继续滴加NaHSO4溶液,反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是一种___________ 色的气体;氯气与水反应的化学方程式为___________ ;氯水中滴加少量紫色石蕊试液的现象是___________ 。
(2)氯气和石灰乳反应可以制备漂白粉,漂白粉的有效成分是___________ ;次氯酸盐与空气中的二氧化碳和水蒸气反应可生成次氯酸,从而发挥漂白和消毒作用,用化学方程式表示漂白粉的漂白和消毒原理___________ 。
(3)二氧化氯(ClO2)是目前国际上公认的新一代的高效、广谱、安全的杀菌、保鲜剂。一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为___________ ;ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO ),需将其转化为Cl-除去。下列试剂中,可将ClO
),需将其转化为Cl-除去。下列试剂中,可将ClO 转化为Cl-的是
转化为Cl-的是___________ (填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为___________ ;工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产100kg该溶液需消耗氯气的质量为___________ kg(保留整数)。
(1)氯气是一种
(2)氯气和石灰乳反应可以制备漂白粉,漂白粉的有效成分是
(3)二氧化氯(ClO2)是目前国际上公认的新一代的高效、广谱、安全的杀菌、保鲜剂。一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为
 ),需将其转化为Cl-除去。下列试剂中,可将ClO
),需将其转化为Cl-除去。下列试剂中,可将ClO 转化为Cl-的是
转化为Cl-的是a.FeSO4 b.O3 c.KMnO4 d.SO2
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,

回答下列问题:
(1)a、b、c三点溶液的pH大小顺序___________ (用a、b、c回答,下同)
(2)a、b、c三点,CH3COOH的电离程度___________ 。
(3)a、b、c三点溶液用1 mol·L-1 NaOH溶液中和,消耗NaOH溶液的体积___________ 。

回答下列问题:
(1)a、b、c三点溶液的pH大小顺序
(2)a、b、c三点,CH3COOH的电离程度
(3)a、b、c三点溶液用1 mol·L-1 NaOH溶液中和,消耗NaOH溶液的体积
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】不同温度下,水溶液中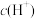 与
与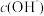 的关系如图所示。回答下列问题:
的关系如图所示。回答下列问题:
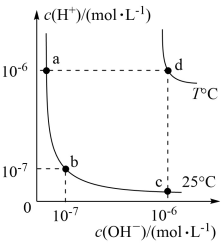
(1)向a点对应的醋酸溶液中滴加等物质的量浓度的NaOH溶液至b点,则两溶液的体积_________ (填“相等”或“不相等”)。
(2)d点对应的食盐水pH=__________ ,呈__________ 性(填“酸”、“中”或“碱”)。
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m_______ n(填“大于、等于、小于”)。
(4)常温下,将pH=12的NaOH溶液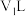 与pH=1的
与pH=1的 溶液
溶液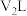 混合,若所得混合溶液的pH=11,则
混合,若所得混合溶液的pH=11,则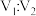 为
为____________ 。
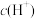 与
与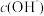 的关系如图所示。回答下列问题:
的关系如图所示。回答下列问题:
(1)向a点对应的醋酸溶液中滴加等物质的量浓度的NaOH溶液至b点,则两溶液的体积
(2)d点对应的食盐水pH=
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m
(4)常温下,将pH=12的NaOH溶液
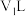 与pH=1的
与pH=1的 溶液
溶液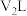 混合,若所得混合溶液的pH=11,则
混合,若所得混合溶液的pH=11,则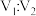 为
为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+)______  填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
(2)如图是0.1mol/L电解质溶液的pH随温度变化的图像:

①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是______ (填写字母);
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______ mol/L
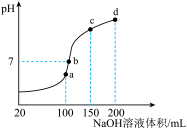
(3)室温时,向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是______ ;在b点,溶液中各离子浓度由大到小的排列顺序是 ______
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)当溶液pH=5时,某溶液中的Al3+______  填“能”或“不能”
填“能”或“不能” 完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+)
 填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。 (2)如图是0.1mol/L电解质溶液的pH随温度变化的图像:

①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=
(3)室温时,向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)当溶液pH=5时,某溶液中的Al3+
 填“能”或“不能”
填“能”或“不能” 完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”“变小”或“不变”)。
(1)
___________ 。
(2)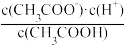
___________ 。
(3)
___________ 。
(4)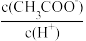
___________ 。
(1)

(2)
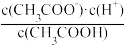
(3)

(4)
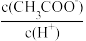
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因CO 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO 第一步水解的离子方程式:
第一步水解的离子方程式:_________________________________________________________________ 。
已知25 ℃时,CO 第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO )∶c(CO
)∶c(CO )=20∶1时,溶液的pH=
)=20∶1时,溶液的pH=________ 。
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式:_____________________________________________________________ 。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1 CH3COONa溶液,则两份溶液中c(NO )、c(NO
)、c(NO ) 和c(CH3COO-)由大到小的顺序为
) 和c(CH3COO-)由大到小的顺序为____________________ ,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________ 。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因CO
 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO 第一步水解的离子方程式:
第一步水解的离子方程式:已知25 ℃时,CO
 第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO )∶c(CO
)∶c(CO )=20∶1时,溶液的pH=
)=20∶1时,溶液的pH=②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式:
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1 CH3COONa溶液,则两份溶液中c(NO
 )、c(NO
)、c(NO ) 和c(CH3COO-)由大到小的顺序为
) 和c(CH3COO-)由大到小的顺序为A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某学习小组设计研究醋酸的性质。
(1)研究稀释过程导电能力变化。
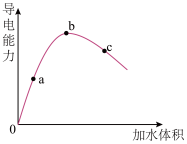
冰醋酸稀释过程,溶液导电能力变化如图所示,则a、b、c三点对应溶液中,醋酸电离程度由大到小的顺序是________ (填字母)。用湿润的pH 试纸测定a点pH,结果_______ (填“偏大”、“偏小”或“准确”)。
(2)研究稀释过程pH变化。
25℃时,用pH计测定不同浓度醋酸溶液的pH,结果如下:
根据表中数据,稀释醋酸溶液,电离平衡________ (填“正”或“逆”)向移动;结合表中数据得出判断理由是__________ 。
(3)对比强、弱酸的性质。
构建模型可帮助理解问题。盐酸和醋酸的“冰山”理解模型如下图,回答问题:
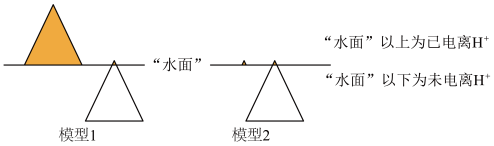
①模型1表示的是____________ (填序号)。
A.等浓度的盐酸和醋酸 B.等pH的盐酸和醋酸溶液
②等体积,pH均为1的盐酸和醋酸溶液,中和NaOH的能力比较:盐酸_______ 醋酸(填“>”、“<”或“=”)。
③模型2表示的两种溶液中分别加水,醋酸溶液中n(H+)_______ ,c(H+)_______ (填“增大”、“减小”或“不变”)
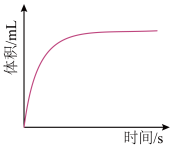
④过量镁粉分别与2mL 2mol/L盐酸、2mL 2mol/L醋酸溶液反应,测得镁粉与盐酸反应生成气体体积随时间变化如图,在图中画出镁粉与醋酸溶液反应的图像_______ 。
(1)研究稀释过程导电能力变化。

冰醋酸稀释过程,溶液导电能力变化如图所示,则a、b、c三点对应溶液中,醋酸电离程度由大到小的顺序是
(2)研究稀释过程pH变化。
25℃时,用pH计测定不同浓度醋酸溶液的pH,结果如下:
醋酸浓度(mol/L) | 0.0010 | 0.01000 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(3)对比强、弱酸的性质。
构建模型可帮助理解问题。盐酸和醋酸的“冰山”理解模型如下图,回答问题:

①模型1表示的是
A.等浓度的盐酸和醋酸 B.等pH的盐酸和醋酸溶液
②等体积,pH均为1的盐酸和醋酸溶液,中和NaOH的能力比较:盐酸
③模型2表示的两种溶液中分别加水,醋酸溶液中n(H+)
④过量镁粉分别与2mL 2mol/L盐酸、2mL 2mol/L醋酸溶液反应,测得镁粉与盐酸反应生成气体体积随时间变化如图,在图中画出镁粉与醋酸溶液反应的图像

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】计算以下数值(以下均为25℃时)。
(1)某浓度的NH3·H2O溶液中,由水电离的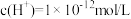 ,该溶液的pH=
,该溶液的pH=______ 。
(2)将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,混合后所得溶液的pH=10,则H2SO4溶液与NaOH溶液的体积比为______ 。
(3)CH3COOH与CH3COONa的混合溶液,若测得pH =6,则溶液中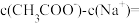
______  (填精确值)。
(填精确值)。
(4)将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为______ (用含代数a、b等表示)。
(5)pH=5的H2SO4溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中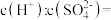
______ 。
(6)盐碱地因含较多的Na2CO3,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式______ 。
(1)某浓度的NH3·H2O溶液中,由水电离的
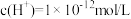 ,该溶液的pH=
,该溶液的pH=(2)将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,混合后所得溶液的pH=10,则H2SO4溶液与NaOH溶液的体积比为
(3)CH3COOH与CH3COONa的混合溶液,若测得pH =6,则溶液中
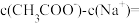
 (填精确值)。
(填精确值)。(4)将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为
(5)pH=5的H2SO4溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中
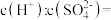
(6)盐碱地因含较多的Na2CO3,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】以含砷氧化铜矿[含CuO、 及重金属盐等]为原料,用氨浸法制取饲料级硫酸铜。
及重金属盐等]为原料,用氨浸法制取饲料级硫酸铜。
(1)氨浸:常温下,将一定比例的氨水和 溶液混合,配制成浸取液,可将矿物中的CuO转化为
溶液混合,配制成浸取液,可将矿物中的CuO转化为 溶液,此时砷元素以
溶液,此时砷元素以 形式进入溶液。
形式进入溶液。
已知25℃时,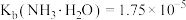 ,
,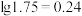 。
。
①为提高铜的浸出率,不仅要求浸取液中总氨(氨铵之和)适当过量,而且要求控制其pH约为9.24,此时浸取液中氨铵比 约为
约为_______ (填字母)。
A.1∶2 B.2∶3 C.1∶1 D.2∶1
②氨浸时溶液温度不宜过高,其原因是_______ 。
(2)除杂:在浸出液中先加入 溶液去除重金属离子,然后调节溶液呈弱酸性,再依次用
溶液去除重金属离子,然后调节溶液呈弱酸性,再依次用 溶液和
溶液和 溶液去除含砷微粒,除砷主要经过“吸附→反应→沉淀”的过程。
溶液去除含砷微粒,除砷主要经过“吸附→反应→沉淀”的过程。
①加入 溶液,同时鼓入空气,可加快吸附过程的发生。请简述产生吸附作用的原理:
溶液,同时鼓入空气,可加快吸附过程的发生。请简述产生吸附作用的原理:_______ 。
②加入 溶液,可将溶液中少量残留的
溶液,可将溶液中少量残留的 氧化为
氧化为 ,并进一步转化为难溶铁盐,脱离浸出液。写出
,并进一步转化为难溶铁盐,脱离浸出液。写出 发生氧化反应的离子方程式:
发生氧化反应的离子方程式:_______ 。
(3)蒸氨、酸溶:除杂后的溶液主要成分为 ,经蒸氨操作得到
,经蒸氨操作得到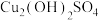 固体。过滤后将其加入硫酸溶解。蒸氨后过滤得到大量废液,为实现资源的充分利用,请结合上述工艺流程提出一条使用建议:
固体。过滤后将其加入硫酸溶解。蒸氨后过滤得到大量废液,为实现资源的充分利用,请结合上述工艺流程提出一条使用建议:_______ 。
(4)结晶、烘干:酸溶后的溶液结晶、过滤、洗涤,得到产品 。实验测得烘干过程中剩余固体的质量与起始样品的质量的比值随温度变化的曲线如图所示。
。实验测得烘干过程中剩余固体的质量与起始样品的质量的比值随温度变化的曲线如图所示。

为确保产品为饲料级 ,烘干温度应不超过
,烘干温度应不超过_______ (写出计算过程)
 及重金属盐等]为原料,用氨浸法制取饲料级硫酸铜。
及重金属盐等]为原料,用氨浸法制取饲料级硫酸铜。(1)氨浸:常温下,将一定比例的氨水和
 溶液混合,配制成浸取液,可将矿物中的CuO转化为
溶液混合,配制成浸取液,可将矿物中的CuO转化为 溶液,此时砷元素以
溶液,此时砷元素以 形式进入溶液。
形式进入溶液。已知25℃时,
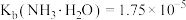 ,
,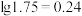 。
。①为提高铜的浸出率,不仅要求浸取液中总氨(氨铵之和)适当过量,而且要求控制其pH约为9.24,此时浸取液中氨铵比
 约为
约为A.1∶2 B.2∶3 C.1∶1 D.2∶1
②氨浸时溶液温度不宜过高,其原因是
(2)除杂:在浸出液中先加入
 溶液去除重金属离子,然后调节溶液呈弱酸性,再依次用
溶液去除重金属离子,然后调节溶液呈弱酸性,再依次用 溶液和
溶液和 溶液去除含砷微粒,除砷主要经过“吸附→反应→沉淀”的过程。
溶液去除含砷微粒,除砷主要经过“吸附→反应→沉淀”的过程。①加入
 溶液,同时鼓入空气,可加快吸附过程的发生。请简述产生吸附作用的原理:
溶液,同时鼓入空气,可加快吸附过程的发生。请简述产生吸附作用的原理:②加入
 溶液,可将溶液中少量残留的
溶液,可将溶液中少量残留的 氧化为
氧化为 ,并进一步转化为难溶铁盐,脱离浸出液。写出
,并进一步转化为难溶铁盐,脱离浸出液。写出 发生氧化反应的离子方程式:
发生氧化反应的离子方程式:(3)蒸氨、酸溶:除杂后的溶液主要成分为
 ,经蒸氨操作得到
,经蒸氨操作得到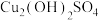 固体。过滤后将其加入硫酸溶解。蒸氨后过滤得到大量废液,为实现资源的充分利用,请结合上述工艺流程提出一条使用建议:
固体。过滤后将其加入硫酸溶解。蒸氨后过滤得到大量废液,为实现资源的充分利用,请结合上述工艺流程提出一条使用建议:(4)结晶、烘干:酸溶后的溶液结晶、过滤、洗涤,得到产品
 。实验测得烘干过程中剩余固体的质量与起始样品的质量的比值随温度变化的曲线如图所示。
。实验测得烘干过程中剩余固体的质量与起始样品的质量的比值随温度变化的曲线如图所示。
为确保产品为饲料级
 ,烘干温度应不超过
,烘干温度应不超过
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】电离度可表示电解质的相对强弱,电离度 (已电离的电解质/原有电解质)×100%。已知25 ℃时几种物质(微粒)的电离度(溶液浓度均为0.1
(已电离的电解质/原有电解质)×100%。已知25 ℃时几种物质(微粒)的电离度(溶液浓度均为0.1 )如表所示:
)如表所示:
(1)25℃ 时,上述几种溶液中 从大到小的顺序是
从大到小的顺序是___________ (填序号)。
(2)25℃ 时,0.1 硫酸溶液中
硫酸溶液中 的电离度小于相同温度下0.l
的电离度小于相同温度下0.l  硫酸氢钠溶液中
硫酸氢钠溶液中 的电离度,其原因是
的电离度,其原因是_________________ 。
(3)醋酸的电离平衡常数 的表达式是
的表达式是____________ ,则物质的量浓度为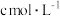 的醋酸的电离平衡常数
的醋酸的电离平衡常数 与电离度α的关系为
与电离度α的关系为
_____________ (用含 的代数式表示)。
的代数式表示)。
(4)25℃时,纯水密度约为1g/mL。纯水的电离度约为_____________
 (已电离的电解质/原有电解质)×100%。已知25 ℃时几种物质(微粒)的电离度(溶液浓度均为0.1
(已电离的电解质/原有电解质)×100%。已知25 ℃时几种物质(微粒)的电离度(溶液浓度均为0.1 )如表所示:
)如表所示:| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步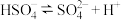 | 10% |
| B | 硫酸氢钠溶液: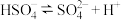 | 29% |
| C | 醋酸: | 1.33% |
| D | 盐酸: | 100% |
(1)25℃ 时,上述几种溶液中
 从大到小的顺序是
从大到小的顺序是(2)25℃ 时,0.1
 硫酸溶液中
硫酸溶液中 的电离度小于相同温度下0.l
的电离度小于相同温度下0.l  硫酸氢钠溶液中
硫酸氢钠溶液中 的电离度,其原因是
的电离度,其原因是(3)醋酸的电离平衡常数
 的表达式是
的表达式是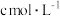 的醋酸的电离平衡常数
的醋酸的电离平衡常数 与电离度α的关系为
与电离度α的关系为
 的代数式表示)。
的代数式表示)。(4)25℃时,纯水密度约为1g/mL。纯水的电离度约为
您最近一年使用:0次



