NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+)______  填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
(2)如图是0.1mol/L电解质溶液的pH随温度变化的图像:

①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是______ (填写字母);
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______ mol/L
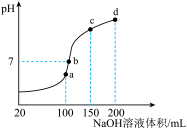
(3)室温时,向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是______ ;在b点,溶液中各离子浓度由大到小的排列顺序是 ______
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)当溶液pH=5时,某溶液中的Al3+______  填“能”或“不能”
填“能”或“不能” 完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+)
 填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。 (2)如图是0.1mol/L电解质溶液的pH随温度变化的图像:

①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=
(3)室温时,向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)当溶液pH=5时,某溶液中的Al3+
 填“能”或“不能”
填“能”或“不能” 完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
更新时间:2020-01-23 13:05:05
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】现有① 氨水 ②
氨水 ②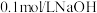 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 盐酸
盐酸
(1) 由大到小的顺序是
由大到小的顺序是______ (填序号)。
(2)②和③等体积混合后,溶液显______ 性(填“酸”“碱”或“中”),理由是______ (用离子方程式表示)。
(3)①和③等体积混合后,溶液显中性,则
______  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是______ 。
 氨水 ②
氨水 ②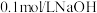 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 盐酸
盐酸(1)
 由大到小的顺序是
由大到小的顺序是(2)②和③等体积混合后,溶液显
(3)①和③等体积混合后,溶液显中性,则

 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。

(1)a、b、c三点溶液的pH从大到小顺序为________ 。
(2)a、b、c三点溶液用 溶液中和,消耗
溶液中和,消耗 溶液的体积大小关系为
溶液的体积大小关系为________ 。
(3)用蒸馏水稀释c点的醋酸,则下列各式表示的数值随水量的增加而增大的是_________(填字母)。
(4)已知 的电离平衡常数
的电离平衡常数 ,
, 中
中 约为
约为___________  。
。
(5)体积为 ,
, 的醋酸溶液与
的醋酸溶液与 ,
, 的一元酸
的一元酸 分别加水稀释至
分别加水稀释至 ,稀释过程
,稀释过程 变化如图,若将相同表面积的
变化如图,若将相同表面积的 分别加入等浓度的醋酸和
分别加入等浓度的醋酸和 溶液中,初始反应速率为
溶液中,初始反应速率为
___________ (填“<”“>”或“=”) 。
。


(1)a、b、c三点溶液的pH从大到小顺序为
(2)a、b、c三点溶液用
 溶液中和,消耗
溶液中和,消耗 溶液的体积大小关系为
溶液的体积大小关系为(3)用蒸馏水稀释c点的醋酸,则下列各式表示的数值随水量的增加而增大的是_________(填字母)。
A. | B.电离度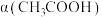 |
C. | D. |
 的电离平衡常数
的电离平衡常数 ,
, 中
中 约为
约为 。
。(5)体积为
 ,
, 的醋酸溶液与
的醋酸溶液与 ,
, 的一元酸
的一元酸 分别加水稀释至
分别加水稀释至 ,稀释过程
,稀释过程 变化如图,若将相同表面积的
变化如图,若将相同表面积的 分别加入等浓度的醋酸和
分别加入等浓度的醋酸和 溶液中,初始反应速率为
溶液中,初始反应速率为
 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】人们日常生产生活与化学有着紧密的联系。
(1)现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答:
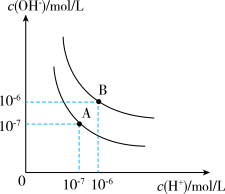
①常温下, 溶液加水稀释,下列数值一定变小的是
溶液加水稀释,下列数值一定变小的是___________ (填字母)。
A.c(H+) B. C.
C.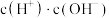 D.
D.
②取10mL乙溶液,加入少量无水CH3COONa固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的值将
的值将___________ (填“增大”“减小”或“无法确定”)。
③相同条件下,取等体积的甲、乙两溶液,分别与0.1mol/LNaOH溶液反应,消耗NaOH溶液的体积(甲)___________ (乙)(填“>”“<”或“=”)。
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示:
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为___________ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
①CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________ 。
②同浓度的CH3COO-、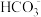 、
、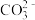 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为___________ 。
③将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:___________ 。
④将SO2通入该氨水中,当c(OH-)降至 时,溶液中的
时,溶液中的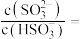
___________ 。
⑤下列微粒在溶液中不能大量共存的是___________ 。
A. 、
、 B.ClO-、
B.ClO-、 C.
C. 、
、 D.HClO、
D.HClO、
(1)现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答:
①常温下,
 溶液加水稀释,下列数值一定变小的是
溶液加水稀释,下列数值一定变小的是A.c(H+) B.
 C.
C.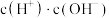 D.
D.
②取10mL乙溶液,加入少量无水CH3COONa固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
 的值将
的值将③相同条件下,取等体积的甲、乙两溶液,分别与0.1mol/LNaOH溶液反应,消耗NaOH溶液的体积(甲)
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示:

25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
| 弱电解质 | 电离常数(Ka) | |
| NH3·H2O | Kb=1.8×10-5 | |
| HClO | Kₐ=4.7×10-8 | |
| H2CO3 | Ka1=4.2×10-7 | Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.54×10-2 | Ka2=1.02×10-7 |
| CH3COOH | Kₐ=1.7×10-5 | |
②同浓度的CH3COO-、
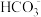 、
、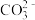 、ClO-结合H+的能力由强到弱的顺序为
、ClO-结合H+的能力由强到弱的顺序为③将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:
④将SO2通入该氨水中,当c(OH-)降至
 时,溶液中的
时,溶液中的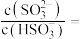
⑤下列微粒在溶液中不能大量共存的是
A.
 、
、 B.ClO-、
B.ClO-、 C.
C. 、
、 D.HClO、
D.HClO、
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】在室温下,下列五种溶液:①0.1mol·L-1NH4Cl溶液②0.1mol·L-1CH3COONH4溶液③0.1mol·L-1NH4HSO4溶液④0.1mol·L-1NH3·H2O和0.1mol·L-1NH4Cl混合液⑤0.1mol·L-1氨水
请根据要求填写下列空白:
(1)溶液①呈______ (填“酸”、“碱”或“中”)性,其原因是________________ (用离子方程式表示)。
(2)溶液②③中c(NH )的大小关系是②
)的大小关系是②___ (填“>”、“<”或“=”)③。
(3)在溶液④中________ (离子)的浓度为0.1mol/L;NH3·H2O和________ (离子)的浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________ (填“>”、“<”或“=”,下同)NH 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-)________ c(NH )。
)。
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:______________________________ 。
②若溶液M由10mL2mol·L-1NaHA溶液与10mL2mol·L-1NaOH溶液混合而得,则溶液M的pH________ (填“>”、“<”或“=”)7。
请根据要求填写下列空白:
(1)溶液①呈
(2)溶液②③中c(NH
 )的大小关系是②
)的大小关系是②(3)在溶液④中
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度
 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-) )。
)。(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:
②若溶液M由10mL2mol·L-1NaHA溶液与10mL2mol·L-1NaOH溶液混合而得,则溶液M的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】单宁酸 -硫酸体系中,低品位软锰矿(
-硫酸体系中,低品位软锰矿( 质量分数为29%)中的Mn(Ⅳ)可被还原为
质量分数为29%)中的Mn(Ⅳ)可被还原为 而浸出。其浸出过程如图所示。
而浸出。其浸出过程如图所示。 完全水解,生成的没食子酸和葡萄糖物质的量之比为
完全水解,生成的没食子酸和葡萄糖物质的量之比为___________ 。
(2)写出葡萄糖还原 生成
生成 的离子反应方程式:
的离子反应方程式:________________ 。
(3)浸出前后软锰矿与浸取渣的X-射线衍射图如图所示,衍射峰的强度能一定程度反映晶体的质量分数等信息。指出图中 对应衍射峰强度变化的原因:
对应衍射峰强度变化的原因:____________ 。
准确称取 软锰矿试样,加入一定量硫酸和单宁酸,水浴加热并充分搅拌,一段时间后过滤.将滤液冷却后加水定容至2L,量取20.00mL溶液于锥形瓶中,向锥形瓶中加入足量磷酸作稳定剂,再加入2mL高氯酸,边加边摇动,使
软锰矿试样,加入一定量硫酸和单宁酸,水浴加热并充分搅拌,一段时间后过滤.将滤液冷却后加水定容至2L,量取20.00mL溶液于锥形瓶中,向锥形瓶中加入足量磷酸作稳定剂,再加入2mL高氯酸,边加边摇动,使 完全氧化为Mn(Ⅲ),加热溶液至无气体产生。冷却后用浓度为
完全氧化为Mn(Ⅲ),加热溶液至无气体产生。冷却后用浓度为 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。
。
①实验室现配 溶液的浓度与计算值存在误差,为提高测量结果的精确度,滴定前需要对现配
溶液的浓度与计算值存在误差,为提高测量结果的精确度,滴定前需要对现配 溶液进行的补充实验是
溶液进行的补充实验是_________ 。
② 完全氧化后加热溶液的目的是
完全氧化后加热溶液的目的是____________ 。
③计算该条件下软锰矿中锰元素的浸出率
____________ 。[ 。写出计算过程]
。写出计算过程]
(5)90℃下,控制单宁酸用量和反应时间相同,测得 对锰元素浸出率的影响如图所示。
对锰元素浸出率的影响如图所示。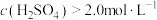 时,锰元素浸出率降低的可能原因是
时,锰元素浸出率降低的可能原因是___________ 。
 -硫酸体系中,低品位软锰矿(
-硫酸体系中,低品位软锰矿( 质量分数为29%)中的Mn(Ⅳ)可被还原为
质量分数为29%)中的Mn(Ⅳ)可被还原为 而浸出。其浸出过程如图所示。
而浸出。其浸出过程如图所示。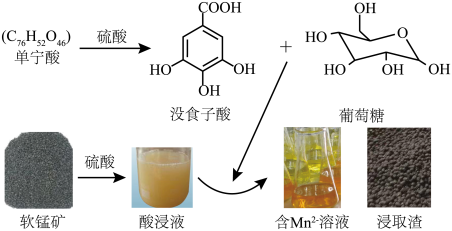
 完全水解,生成的没食子酸和葡萄糖物质的量之比为
完全水解,生成的没食子酸和葡萄糖物质的量之比为(2)写出葡萄糖还原
 生成
生成 的离子反应方程式:
的离子反应方程式:(3)浸出前后软锰矿与浸取渣的X-射线衍射图如图所示,衍射峰的强度能一定程度反映晶体的质量分数等信息。指出图中
 对应衍射峰强度变化的原因:
对应衍射峰强度变化的原因: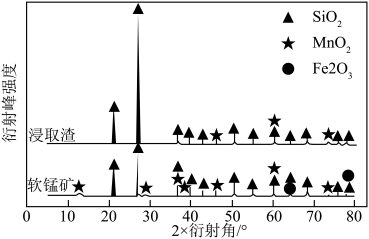
准确称取
 软锰矿试样,加入一定量硫酸和单宁酸,水浴加热并充分搅拌,一段时间后过滤.将滤液冷却后加水定容至2L,量取20.00mL溶液于锥形瓶中,向锥形瓶中加入足量磷酸作稳定剂,再加入2mL高氯酸,边加边摇动,使
软锰矿试样,加入一定量硫酸和单宁酸,水浴加热并充分搅拌,一段时间后过滤.将滤液冷却后加水定容至2L,量取20.00mL溶液于锥形瓶中,向锥形瓶中加入足量磷酸作稳定剂,再加入2mL高氯酸,边加边摇动,使 完全氧化为Mn(Ⅲ),加热溶液至无气体产生。冷却后用浓度为
完全氧化为Mn(Ⅲ),加热溶液至无气体产生。冷却后用浓度为 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。
。①实验室现配
 溶液的浓度与计算值存在误差,为提高测量结果的精确度,滴定前需要对现配
溶液的浓度与计算值存在误差,为提高测量结果的精确度,滴定前需要对现配 溶液进行的补充实验是
溶液进行的补充实验是②
 完全氧化后加热溶液的目的是
完全氧化后加热溶液的目的是③计算该条件下软锰矿中锰元素的浸出率

 。写出计算过程]
。写出计算过程](5)90℃下,控制单宁酸用量和反应时间相同,测得
 对锰元素浸出率的影响如图所示。
对锰元素浸出率的影响如图所示。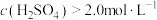 时,锰元素浸出率降低的可能原因是
时,锰元素浸出率降低的可能原因是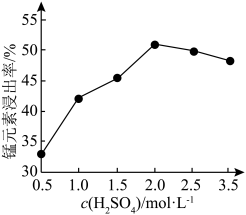
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】10℃时,常压下加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为__________________________________________ 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度____________ (填“大于”或“小于”)NaHCO3。
(2)丙同学认为甲、乙的判断都不充分。丙认为:只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙同学判断正确。试剂X是______________ 。
A. Ba(OH)2溶液 B. BaCl2溶液 C. NaOH溶液 D. 澄清的石灰水
(3)将加热后的溶液冷却到10℃,若溶液的pH_______ (填“高于”、“低于”或“等于”)8.3,则甲同学判断正确。
(4)查阅资料,发现NaHCO3的分解温度为150℃,丙断言_______ (填“甲”或“乙”)判断是错误的,理由是_________________________________________________________________ 。
(5)将amol/L的Na2CO3溶液与bmol/L的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断不正确 的是_________ 。
A. c(Na+)+ c(H+)>c(CO32-)+c(HCO3-)+c(OH-)
B.c(Na+)>c(CO32-)+ c(HCO3-)+c(H2CO3)
C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a<b
D.若c(CO32-)+2c(OH-)=2c(H+)+ c(HCO3-)+ 3c(H2CO3),则可确定a=b
(6)已知25℃时,Ksp [CaCO3]=2.8×10﹣9,Ksp [MgCO3]=6.8×10﹣6。该温度下向物质的量浓度均为0.02mol·L﹣1的MgCl2和CaCl2混合溶液中逐滴加入Na2CO3溶液,当CaCO3和MgCO3两种沉淀共存时,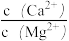 =
=_______________ (保留2位有效数字)。
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为
(2)丙同学认为甲、乙的判断都不充分。丙认为:只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙同学判断正确。试剂X是
A. Ba(OH)2溶液 B. BaCl2溶液 C. NaOH溶液 D. 澄清的石灰水
(3)将加热后的溶液冷却到10℃,若溶液的pH
(4)查阅资料,发现NaHCO3的分解温度为150℃,丙断言
(5)将amol/L的Na2CO3溶液与bmol/L的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断
A. c(Na+)+ c(H+)>c(CO32-)+c(HCO3-)+c(OH-)
B.c(Na+)>c(CO32-)+ c(HCO3-)+c(H2CO3)
C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a<b
D.若c(CO32-)+2c(OH-)=2c(H+)+ c(HCO3-)+ 3c(H2CO3),则可确定a=b
(6)已知25℃时,Ksp [CaCO3]=2.8×10﹣9,Ksp [MgCO3]=6.8×10﹣6。该温度下向物质的量浓度均为0.02mol·L﹣1的MgCl2和CaCl2混合溶液中逐滴加入Na2CO3溶液,当CaCO3和MgCO3两种沉淀共存时,
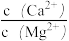 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】现有常温下甲、乙、丙三种溶液,甲为0.1mol•L-1的NaOH溶液,乙为0.1mol•L-1的HCl溶液,丙为0.1mol•L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的c(H+)=______ ,pH=______ 。
(2)丙溶液中存在的两个电离平衡为______ (用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol•L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是______ (填序号)。
①n(H+) ②c(H+) ③ ④c(OH-)
④c(OH-)
(4)乙、丙两种溶液中水电离程度大小顺序为______ 。
(5)将等体积的甲、丙溶液混合,充分反应后,得到的溶液中离子浓度由大到小为______ ;溶液中电荷守恒______ (用粒子浓度形式表示)。
(1)甲溶液的c(H+)=
(2)丙溶液中存在的两个电离平衡为
(3)常温下,用水稀释0.1mol•L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是
①n(H+) ②c(H+) ③
 ④c(OH-)
④c(OH-)(4)乙、丙两种溶液中水电离程度大小顺序为
(5)将等体积的甲、丙溶液混合,充分反应后,得到的溶液中离子浓度由大到小为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。如表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH。
(1)X的化学式分别为_____ 。
(2)W在溶液中的电离方程式为____ 。
(3)25℃时,Z溶液的pH>7的原因是____ (用离子方程式表示)。
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为____ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为____ 。
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(1)X的化学式分别为
(2)W在溶液中的电离方程式为
(3)25℃时,Z溶液的pH>7的原因是
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(1)常温下,0.10 mol·L-1 NH4Cl溶液pH___________ 7(填“>”、“<”或“=”),溶液中各离子浓度由大到小的顺序___________ 。
(2)在Na2CO3溶液中滴入酚酞,溶液变红的原因___________ (写出相关的离子方程式),加热溶液颜色___________
(3)25℃时,0.05mol/LH2SO4溶液的pH=___________ ;0.05mol/LBa(OH)2溶液c(H+)=___________
(2)在Na2CO3溶液中滴入酚酞,溶液变红的原因
(3)25℃时,0.05mol/LH2SO4溶液的pH=
您最近一年使用:0次



