现有常温下甲、乙、丙三种溶液,甲为0.1mol•L-1的NaOH溶液,乙为0.1mol•L-1的HCl溶液,丙为0.1mol•L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的c(H+)=______ ,pH=______ 。
(2)丙溶液中存在的两个电离平衡为______ (用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol•L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是______ (填序号)。
①n(H+) ②c(H+) ③ ④c(OH-)
④c(OH-)
(4)乙、丙两种溶液中水电离程度大小顺序为______ 。
(5)将等体积的甲、丙溶液混合,充分反应后,得到的溶液中离子浓度由大到小为______ ;溶液中电荷守恒______ (用粒子浓度形式表示)。
(1)甲溶液的c(H+)=
(2)丙溶液中存在的两个电离平衡为
(3)常温下,用水稀释0.1mol•L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是
①n(H+) ②c(H+) ③
 ④c(OH-)
④c(OH-)(4)乙、丙两种溶液中水电离程度大小顺序为
(5)将等体积的甲、丙溶液混合,充分反应后,得到的溶液中离子浓度由大到小为
更新时间:2024-04-10 15:31:26
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】完成下列小题
(1)下列叙述不正确的是_____。
(2)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50kJ•mol-1;
CO(g)+2H2(g)=CH3OH(g) ΔH=-91kJ•mol-1,则1molCO断键吸收的能量为_____。
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。

①25℃时水的电离平衡曲线应为_____ (填“A或“B”),请说明理由:_____ 。
②95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱混合后溶液呈中性,则a与b之间应满足的关系是_____ 。
(4)如图是某温度下,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c( )增大过程中,溶液中c(Ba2+)和c(
)增大过程中,溶液中c(Ba2+)和c( )的变化曲线。根据图中的数据分析、计算。
)的变化曲线。根据图中的数据分析、计算。
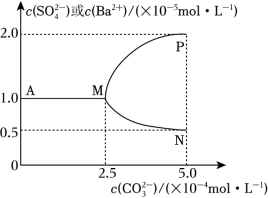
①该温度下,BaSO4的Ksp=_____ 。
②当c( )大于
)大于_____ mol•L-1时开始有BaCO3沉淀生成;BaCO3的Ksp=_____ 。
(5)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH<0
①书写该反应的平衡常数表达式K=_____
②反应达到平衡后,为提高反应速率的同时提高NO2的转化率,可采取的措施有_____ 。
A.改用高效催化剂B.升高温度C.缩小容器的体积D.增加CH4的浓度
③在体积一定的容器中进行上述反应并达到平衡,保持其它条件不变,通入一定量的CH4,下列说法正确的是_____ 。(双选)
A.正反应速率先增大后减小B.混合气体的平均密度增大
C.化学平衡常数增大D.达到新平衡时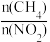 增大
增大
(6)食醋的有效成分主要为醋酸(用HAc表示)。25℃时,HAc的,Ka=1.75×10-5=10-4.76.
某小组研究25℃下HAc电离平衡的影响因素。
提出假设:稀释HAc溶液或改变AC浓度,HAc电离平衡会发生移动。
设计方案并完成实验:用浓度均为0.1mol•L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液:测定pH,记录数据。
①配制:250mL0.1000mol•L-1的HAc溶液,需要的定量仪器是_____ 。
②根据表中信息,补充数据:a=_____ ,b=_____ 。
③由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡_____ (填“正”或“逆”)向移动;结合表中数据,给出判断理由:_____ 。
④查阅资料获悉:一定条件下,按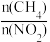 配制的溶液中,[H+]的值等于HAc的Ka.对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异:推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。
配制的溶液中,[H+]的值等于HAc的Ka.对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异:推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。
i、用移液管取20.00mLHAc溶液于锥形瓶中,加入2滴酚酞溶液,用0.1000mol•L-1NaOH溶液滴定至终点,判断滴定至终点的现象是_____ 。
ii、若测定结果偏低,可能原因是_____ (双选)。
A.滴定管用蒸馅水洗净后未用氢氧化钠润洗
B.盛装待测液的锥形瓶水洗后未烘干
C.滴定过程中振荡锥形瓶时不慎有少量液体溅出
D.滴定前滴定管内无气泡,滴定后滴定管内出现气泡
(7)在日常生活和工农业生产中常用到盐的水解反应。
①实验室在保存FeCl3溶液时,常在溶液中加入_____ ,以抑制其水解;把AlCl3溶液蒸干并充分灼烧,最后得到的固体是_____ 。
②热的纯碱溶液去油污能力增强,请结合离子方程式和平衡移动原理进行解释_____ 。
(1)下列叙述不正确的是_____。
| A.植物燃料燃烧时放出的能量来源于太阳能 |
| B.Na与H2O的反应是熵增的放热反应,该反应能自发进行 |
| C.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
| D.1molH2燃烧放出的热量为H2的燃烧热 |
CO(g)+2H2(g)=CH3OH(g) ΔH=-91kJ•mol-1,则1molCO断键吸收的能量为_____。
| C=O | H-H | H-O | |
| 键能/(kJ•mol-1) | 803 | 436 | 463 |
| A.1075kJ | B.1157kJ | C.735kJ | D.817kJ |

①25℃时水的电离平衡曲线应为
②95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱混合后溶液呈中性,则a与b之间应满足的关系是
(4)如图是某温度下,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(
 )增大过程中,溶液中c(Ba2+)和c(
)增大过程中,溶液中c(Ba2+)和c( )的变化曲线。根据图中的数据分析、计算。
)的变化曲线。根据图中的数据分析、计算。
①该温度下,BaSO4的Ksp=
②当c(
 )大于
)大于(5)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g) ΔH<0
①书写该反应的平衡常数表达式K=
②反应达到平衡后,为提高反应速率的同时提高NO2的转化率,可采取的措施有
A.改用高效催化剂B.升高温度C.缩小容器的体积D.增加CH4的浓度
③在体积一定的容器中进行上述反应并达到平衡,保持其它条件不变,通入一定量的CH4,下列说法正确的是
A.正反应速率先增大后减小B.混合气体的平均密度增大
C.化学平衡常数增大D.达到新平衡时
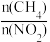 增大
增大(6)食醋的有效成分主要为醋酸(用HAc表示)。25℃时,HAc的,Ka=1.75×10-5=10-4.76.
某小组研究25℃下HAc电离平衡的影响因素。
提出假设:稀释HAc溶液或改变AC浓度,HAc电离平衡会发生移动。
设计方案并完成实验:用浓度均为0.1mol•L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液:测定pH,记录数据。
| 序号 | V(HAc)/Ml | V(NaAc)/mL | V(H2O)/mL | n(NaAc):n(HAc) | pH |
| Ⅰ | 40.00 | 0 | 2.86 | ||
| Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
| … | |||||
| Ⅶ | 4.00 | a | b | 3:4 | 4.53 |
| Ⅷ | 4.00 | 4.00 | 32.00 | 1:1 | 4.65 |
②根据表中信息,补充数据:a=
③由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡
④查阅资料获悉:一定条件下,按
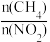 配制的溶液中,[H+]的值等于HAc的Ka.对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异:推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。
配制的溶液中,[H+]的值等于HAc的Ka.对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异:推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。i、用移液管取20.00mLHAc溶液于锥形瓶中,加入2滴酚酞溶液,用0.1000mol•L-1NaOH溶液滴定至终点,判断滴定至终点的现象是
ii、若测定结果偏低,可能原因是
A.滴定管用蒸馅水洗净后未用氢氧化钠润洗
B.盛装待测液的锥形瓶水洗后未烘干
C.滴定过程中振荡锥形瓶时不慎有少量液体溅出
D.滴定前滴定管内无气泡,滴定后滴定管内出现气泡
(7)在日常生活和工农业生产中常用到盐的水解反应。
①实验室在保存FeCl3溶液时,常在溶液中加入
②热的纯碱溶液去油污能力增强,请结合离子方程式和平衡移动原理进行解释
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】根据要求,回答下列问题:
(1)甲醇是一种绿色燃料,甲醇( ,液态)的燃烧热
,液态)的燃烧热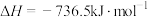 ,则表示甲醇燃烧热的热化学方程式为
,则表示甲醇燃烧热的热化学方程式为___________ 。
(2)工业生产中常用FeS除去工业废水中的 ,则
,则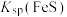
___________ 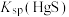 (填“>”或“<”),该反应的离子方程式为
(填“>”或“<”),该反应的离子方程式为___________ 。
(3)工业合成气一般是指CO和 的混合气体,是一种化工原料气,合成气的来源范围很广,如利用二氧化碳与甲烷催化重整可制得合成气:
的混合气体,是一种化工原料气,合成气的来源范围很广,如利用二氧化碳与甲烷催化重整可制得合成气:
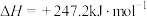 ,则该反应在
,则该反应在___________ (填“低温”“高温”或“任意温度”)下易自发进行。
(4)41℃时,水的离子积常数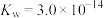 ,该温度时,测得某浓度的稀硫酸中
,该温度时,测得某浓度的稀硫酸中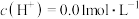 ,则该稀硫酸的pH=
,则该稀硫酸的pH=___________ ,由水电离出的
___________  。
。
(1)甲醇是一种绿色燃料,甲醇(
 ,液态)的燃烧热
,液态)的燃烧热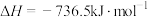 ,则表示甲醇燃烧热的热化学方程式为
,则表示甲醇燃烧热的热化学方程式为(2)工业生产中常用FeS除去工业废水中的
 ,则
,则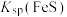
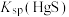 (填“>”或“<”),该反应的离子方程式为
(填“>”或“<”),该反应的离子方程式为(3)工业合成气一般是指CO和
 的混合气体,是一种化工原料气,合成气的来源范围很广,如利用二氧化碳与甲烷催化重整可制得合成气:
的混合气体,是一种化工原料气,合成气的来源范围很广,如利用二氧化碳与甲烷催化重整可制得合成气:
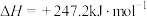 ,则该反应在
,则该反应在(4)41℃时,水的离子积常数
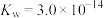 ,该温度时,测得某浓度的稀硫酸中
,该温度时,测得某浓度的稀硫酸中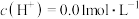 ,则该稀硫酸的pH=
,则该稀硫酸的pH=
 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)下列物质:①Cu;②SO2;③冰醋酸;④NaHCO3;⑤Cu(OH)2;⑥H2SO4溶液;⑦NaCl,属于非电解质的是____ (填序号),属于强电解质的是___ (填序号)。
(2)写出NaHCO3水解的离子方程式:____ 。
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于____ 。
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为____ ,溶液中由水电离出的c(OH-)=____ 。
(5)方铅矿(PbS)遇CuSO4溶液生成铜蓝(CuS)的离子方程式:____ 。
(1)下列物质:①Cu;②SO2;③冰醋酸;④NaHCO3;⑤Cu(OH)2;⑥H2SO4溶液;⑦NaCl,属于非电解质的是
(2)写出NaHCO3水解的离子方程式:
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为
(5)方铅矿(PbS)遇CuSO4溶液生成铜蓝(CuS)的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10mL0.1mol·L-1醋酸溶液测得其pH=3。0.1mol·L-1氨水(NH3·H2O溶液)的pH=___ 。用pH试纸测定该氨水pH的操作方法为_____ 。氨水(NH3·H2O溶液)电离平衡常数表达式Kb=____ ,25℃时,氨水电离平衡常数约为_____ 。
(2)25℃时,现向10mL0.1mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中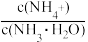
___ (填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL0.1mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。
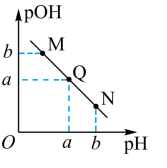
图中M、Q、N三点所示溶液呈中性的点是____ (填字母,下同)。图中M、Q、N三点所示溶液中水的电离程度最大的点是____ 。
(1)25 ℃时,取10mL0.1mol·L-1醋酸溶液测得其pH=3。0.1mol·L-1氨水(NH3·H2O溶液)的pH=
(2)25℃时,现向10mL0.1mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中
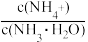
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL0.1mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
表2
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是_____ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___ (填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____ (选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为_____ 。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为_____ 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol•L﹣1,则溶液中CO32-物质的量浓度最少应为_____ 。
表1
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10﹣5 |
| HNO2 | 4.6×10﹣4 |
| HCN | 5×10﹣10 |
| HClO | 3×10﹣8 |
| NH3•H2O | 1.8×10﹣5 |
表2
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10﹣10 |
| BaCO3 | 2.6×10﹣9 |
| CaSO4 | 7×10﹣5 |
| CaCO3 | 5×10﹣9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol•L﹣1,则溶液中CO32-物质的量浓度最少应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】磷元素能形成多种含氧酸。回答下列问题:
(1)次磷酸(H3PO2)是一元弱酸,其在水溶液中的电离方程式为__ 。
(2)亚磷酸(H3PO3)是二元弱酸。已知25℃时,Ka1=1×10-2,Ka2=2.6×10-7.
①Na2HPO3属于__ (填“酸式盐”或“正盐”);NaH2PO3溶液显__ (填“酸性”“碱性”或“中性”)。
②已知25℃时,CH3COOH的Ka=1.75×10-5,则CH3COOH溶液和Na2HPO3溶液反应的化学方程式为__ 。
(3)测定亚磷酸溶液的浓度。
取25.00mL亚磷酸溶液放入锥形瓶中,用0.10mol·L-1酸性高锰酸钾溶液进行滴定,反应的离子方程式为__ 。
(1)次磷酸(H3PO2)是一元弱酸,其在水溶液中的电离方程式为
(2)亚磷酸(H3PO3)是二元弱酸。已知25℃时,Ka1=1×10-2,Ka2=2.6×10-7.
①Na2HPO3属于
②已知25℃时,CH3COOH的Ka=1.75×10-5,则CH3COOH溶液和Na2HPO3溶液反应的化学方程式为
(3)测定亚磷酸溶液的浓度。
取25.00mL亚磷酸溶液放入锥形瓶中,用0.10mol·L-1酸性高锰酸钾溶液进行滴定,反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】常温下,浓度均为0.2 的A、B、C、D四种溶液,分别是
的A、B、C、D四种溶液,分别是 溶液、
溶液、 溶液、
溶液、 溶液和HClO溶液中的一种,它们的pH由大到小的顺序是A>B>C>D[已知常温下[
溶液和HClO溶液中的一种,它们的pH由大到小的顺序是A>B>C>D[已知常温下[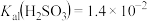 ,
,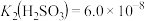 ,
, ,
,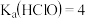
 ,
,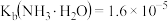 ,
, ]。回答下列问题:
]。回答下列问题:
(1)A溶液的溶质为_______ (填化学式),其电离平衡常数表达式为_______ 。
(2)常温下,将上述B和C两种溶液等体积混合(忽略溶液混合后的体积变化):
①写出B和C发生反应的离子方程式:_______ 。
②充分反应后,所得溶液中微粒有_______ 种,其中
_______ 。
(3)常温下,将上述C和D溶液分别加水稀释:
①若要达到相同的pH,C溶液所加水的体积_______ (填“大于”、“小于”或“等于”)D溶液所水的体积。
②若D溶液加水稀释至原溶液体积的200倍,此时D溶液的pH=_______ 。
(4)常温下,将上述A和D两种溶液等体积混合,溶液混合后各离子浓度由大到小的关系为_______ 。
 的A、B、C、D四种溶液,分别是
的A、B、C、D四种溶液,分别是 溶液、
溶液、 溶液、
溶液、 溶液和HClO溶液中的一种,它们的pH由大到小的顺序是A>B>C>D[已知常温下[
溶液和HClO溶液中的一种,它们的pH由大到小的顺序是A>B>C>D[已知常温下[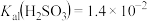 ,
,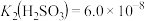 ,
, ,
,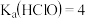
 ,
,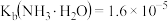 ,
, ]。回答下列问题:
]。回答下列问题:(1)A溶液的溶质为
(2)常温下,将上述B和C两种溶液等体积混合(忽略溶液混合后的体积变化):
①写出B和C发生反应的离子方程式:
②充分反应后,所得溶液中微粒有

(3)常温下,将上述C和D溶液分别加水稀释:
①若要达到相同的pH,C溶液所加水的体积
②若D溶液加水稀释至原溶液体积的200倍,此时D溶液的pH=
(4)常温下,将上述A和D两种溶液等体积混合,溶液混合后各离子浓度由大到小的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】请回答下列问题:
(1)25℃时,
___________ ;
(2)已知25℃时,HCN的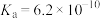 ,则NaCN溶液显
,则NaCN溶液显___________ (填“酸性”、“中性”或“碱性”),用离子反应方程式 分析其原因是___________ 。
(3)25℃时,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为___________ 。
(4)已知25℃时, 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
___________ ,溶液中各离子物质的量浓度由大到小的顺序为___________ 。
(1)25℃时,

(2)已知25℃时,HCN的
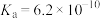 ,则NaCN溶液显
,则NaCN溶液显(3)25℃时,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(4)已知25℃时,
 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示。
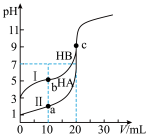
(1)HB溶液中水电离出的c(H+)=_________ mol·L-1,HB的电离平衡常数Ka≈___________ 。
(2)HA是_________ 酸(填“强”或“弱”),室温下将pH=1和pH=4的HA溶液等体积混合,所得溶液的pH=___________ 。(lg2=0.3)
(3)与曲线I上的c点对应的溶液中各种微粒(H2O分子除外)浓度由大到小的顺序为_________ ;b点对应的溶液中c(HB)_________ c(B-)(填“>”“<”或“=”)。
(4)已知常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_________ 。
②若在此溶液中能检测到H2C分子,则此溶液中c(C2-)_________ c(H2C)(填“>”“<”或“=”)。

(1)HB溶液中水电离出的c(H+)=
(2)HA是
(3)与曲线I上的c点对应的溶液中各种微粒(H2O分子除外)浓度由大到小的顺序为
(4)已知常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为
②若在此溶液中能检测到H2C分子,则此溶液中c(C2-)
您最近一年使用:0次



