硫代硫酸钠(Na2S2O3)是硫酸钠中一个氧原子被硫原子取代的产物。硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g⋅mol−1)易溶于水,难溶于乙醇,在酸性环境中易分解。
Ⅰ.制备a2S2O3·5H2O
方法一:亚硫酸钠法。反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌后,加到上述Na2SO3溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。
(1) 中心硫原子的杂化方式为
中心硫原子的杂化方式为___________ 。
(2)使用煮沸过的蒸馏水配制Na2SO3溶液的目的是___________ 。
方法二:硫化碱法。装置如图所示。
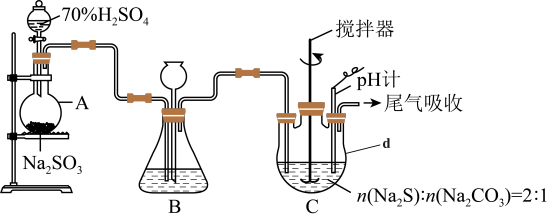
(3)①仪器d的名称为___________ 。
②装置A中发生反应的化学方程式为___________ 。
③装置C中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2.该反应的化学方程式为___________ 。
④实验过程中,为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是_________ 。
Ⅱ.Na2S2O3的应用
(4)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.0000g样品溶于水,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7固体于碘量瓶中,加入20mL蒸馏水溶解,再加入10mL2mol⋅L−1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL某溶液作指示剂,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2 =2I−+
=2I−+ )
)
①步骤3中向碘量瓶中加入的指示剂是___________ 。
②由计算可得Na2S2O3·5H2O的纯度为___________ 。
Ⅰ.制备a2S2O3·5H2O
方法一:亚硫酸钠法。反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3固体于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌后,加到上述Na2SO3溶液中。水浴加热,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶析出Na2S2O3·5H2O晶体。
(1)
 中心硫原子的杂化方式为
中心硫原子的杂化方式为(2)使用煮沸过的蒸馏水配制Na2SO3溶液的目的是
方法二:硫化碱法。装置如图所示。

(3)①仪器d的名称为
②装置A中发生反应的化学方程式为
③装置C中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2.该反应的化学方程式为
④实验过程中,为了保证Na2S2O3·5H2O的产量,实验中通入的SO2不能过量,原因是
Ⅱ.Na2S2O3的应用
(4)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.0000g样品溶于水,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7固体于碘量瓶中,加入20mL蒸馏水溶解,再加入10mL2mol⋅L−1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL某溶液作指示剂,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2
 =2I−+
=2I−+ )
)①步骤3中向碘量瓶中加入的指示剂是
②由计算可得Na2S2O3·5H2O的纯度为
更新时间:2024-02-24 20:59:58
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
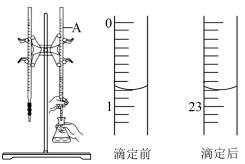
(1)仪器A的名称是___________ ;
(2)盐酸的体积读数:滴定后读数为___________ mL;
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是___________  (保留四位有效数字);
(保留四位有效数字);
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
最佳的操作步骤的顺序是___________ 、___________ C___________ A___________ 。(用字母序号填写);
(5)判断到达滴定终点的实验现象是___________ 。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①装标准液的滴定管,滴定前管尖端有气泡,滴定后气泡消失,对测定结果的影响___________ ;
②标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________ 。

(1)仪器A的名称是
(2)盐酸的体积读数:滴定后读数为
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是
 (保留四位有效数字);
(保留四位有效数字);| 实验编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的体积读数(mL) | 滴定后盐酸的体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
最佳的操作步骤的顺序是
(5)判断到达滴定终点的实验现象是
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①装标准液的滴定管,滴定前管尖端有气泡,滴定后气泡消失,对测定结果的影响
②标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室中有一未知浓度的稀盐酸,其某学生在实验室中进行测定盐酸浓度的实验。请完成下列填空:
(1)配制250mL0.1000mol•L-1标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、__ 、__ 。
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用__ (填仪器名称)盛装配制的标准NaOH溶液进行滴定。重复上述滴定操作3次,记录数据如下:
(3)滴定时,应该左手控制滴定管,右手控制锥形瓶,眼睛__ 。
(4)①判断达到滴定终点的方法是__ 。
②根据上述数据,可计算出该盐酸的浓度约为__ mol•L-1。
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有__ (填字母)。
(1)配制250mL0.1000mol•L-1标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 20.00 | 0.39 | 20.39 |
| 第二次 | 20.00 | 4.90 | 24.90 |
| 第三次 | 20.00 | 1.00 | 24.00 |
(4)①判断达到滴定终点的方法是
②根据上述数据,可计算出该盐酸的浓度约为
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有
| A.酸式滴定管使用前,水洗后未用待测盐酸润洗 |
| B.锥形瓶水洗后未干燥 |
| C.滴定终点读数时俯视读数 |
| D.碱式滴定管尖嘴部分有气泡滴定后消失 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】焦亚硫酸钠( )在医药、橡胶、印染、食品等方面应用广泛,回答下列问题:
)在医药、橡胶、印染、食品等方面应用广泛,回答下列问题:
(1)写出 中硫元素的价态
中硫元素的价态_________ 。
(2)利用烟道气中的 生产
生产 的工艺为:
的工艺为:
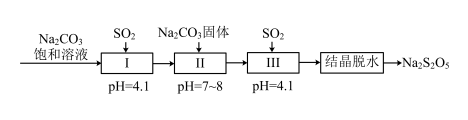
①pH=4.1时,Ⅰ中为__________ 溶液(写化学式)。
②工艺中加入 固体,并再次充入
固体,并再次充入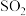 的目的是
的目的是________________________ 。
(3) 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取50.00mL葡萄酒样品,用淀粉作指示剂,用0.01000mol·L‑1的碘标准液滴定至终点,消耗碘标准液10.00mL,则滴定实验中葡萄酒样品装在
残留量时,取50.00mL葡萄酒样品,用淀粉作指示剂,用0.01000mol·L‑1的碘标准液滴定至终点,消耗碘标准液10.00mL,则滴定实验中葡萄酒样品装在__________ ,从反应类型角度分析,该反应中体现了 具有
具有__________ 。滴定终点的依据_______________________ 。
 )在医药、橡胶、印染、食品等方面应用广泛,回答下列问题:
)在医药、橡胶、印染、食品等方面应用广泛,回答下列问题:(1)写出
 中硫元素的价态
中硫元素的价态(2)利用烟道气中的
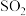 生产
生产 的工艺为:
的工艺为:
①pH=4.1时,Ⅰ中为
②工艺中加入
 固体,并再次充入
固体,并再次充入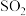 的目的是
的目的是(3)
 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取50.00mL葡萄酒样品,用淀粉作指示剂,用0.01000mol·L‑1的碘标准液滴定至终点,消耗碘标准液10.00mL,则滴定实验中葡萄酒样品装在
残留量时,取50.00mL葡萄酒样品,用淀粉作指示剂,用0.01000mol·L‑1的碘标准液滴定至终点,消耗碘标准液10.00mL,则滴定实验中葡萄酒样品装在 具有
具有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。回答下列问题:
(1)基态Ti原子的核外电子排布式为___________ 。
(2)钛与卤素形成的化合物TiX4熔点如下表:
解释TiX4熔点差异的原因___________ 。
(3) TiCl4能与甲胺(CH3NH2)形成稳定的配合物[TiCl4(CH3NH2)2]。
①甲胺中N原子的杂化方式为___________ 。
②CH3NH2中H-N-H键角比[TiCl4(CH3NH2)2]中H-N-H键角小,从结构角度解释原因___________ 。
(4)TiO2的化学性质非常稳定,广泛用于涂料、橡胶和造纸等工业。
①向TiCl4中加入大量的水,可制得TiO2∙xH2O,该反应的化学方程式为___________ ,所得TiO2∙xH2O经焙烧得到TiO2。
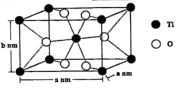
②金红石型TiO2的晶胞为长方体,晶胞参数如图所示。TiO2的摩尔质量为80 g∙mol-1,阿伏加德罗常数为NA,该晶体的密度为___________ g∙cm-3。
(5)Ti(SO4)2是有机合成中常见的催化剂。测定Ti(SO4)2溶液物质的量浓度的方法为:
ⅰ.取5mL待测液于烧杯中,加入足量铝粉,充分反应;
ⅱ.将所得混合物过滤、洗涤,将滤液和洗涤液合并,转移到锥形瓶中,加水稀释到25mL;
ⅲ.向锥形瓶中滴加2滴KSCN溶液;
ⅳ.用cmol/LFe2(SO4)3溶液滴定,滴定终点时消耗Fe2(SO4)3溶液VmL。
已知: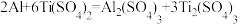
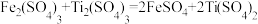
①滴定终点时的现象为___________ 。
②待测液中Ti(SO4)2的浓度为___________  。
。
(1)基态Ti原子的核外电子排布式为
(2)钛与卤素形成的化合物TiX4熔点如下表:
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24 | 38.3 | 153 |
(3) TiCl4能与甲胺(CH3NH2)形成稳定的配合物[TiCl4(CH3NH2)2]。
①甲胺中N原子的杂化方式为
②CH3NH2中H-N-H键角比[TiCl4(CH3NH2)2]中H-N-H键角小,从结构角度解释原因
(4)TiO2的化学性质非常稳定,广泛用于涂料、橡胶和造纸等工业。
①向TiCl4中加入大量的水,可制得TiO2∙xH2O,该反应的化学方程式为
②金红石型TiO2的晶胞为长方体,晶胞参数如图所示。TiO2的摩尔质量为80 g∙mol-1,阿伏加德罗常数为NA,该晶体的密度为

(5)Ti(SO4)2是有机合成中常见的催化剂。测定Ti(SO4)2溶液物质的量浓度的方法为:
ⅰ.取5mL待测液于烧杯中,加入足量铝粉,充分反应;
ⅱ.将所得混合物过滤、洗涤,将滤液和洗涤液合并,转移到锥形瓶中,加水稀释到25mL;
ⅲ.向锥形瓶中滴加2滴KSCN溶液;
ⅳ.用cmol/LFe2(SO4)3溶液滴定,滴定终点时消耗Fe2(SO4)3溶液VmL。
已知:
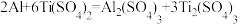
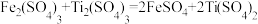
①滴定终点时的现象为
②待测液中Ti(SO4)2的浓度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】Na3Zr2Si2PO12是一种具有交叉隧道三维结构的快离子导体功能材料。回答下列问题:
(1)40Zr位于周期表的第5周期IVB族,基态40Zr的价电子排布式为___________ ;第四周期元素中,基态原子核外成单电子数与基态40Zr相同且第一电离能最大的是___________ 。
(2)NH3、PH3和AsH3的沸点由高到低的顺序是___________ 。
(3)N(CH3)3和P(CH3)3是重要的化工原料。N(CH3)3中N原子的杂化方式为___________ ;键角C—N—C大于C—P—C的原因是___________ 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。Na3OCl属立方晶系(正方体形),晶胞参数为a pm。晶胞沿y轴和沿z轴投影的各原子的分布图和原子分数坐标分别如图1、图2所示。据此推断该晶胞中Na原子的数目为___________ 。设NA为阿伏加德罗常数的值,则Na3OC1晶体的密度为___________ g·cm-3(用代数式表示)。
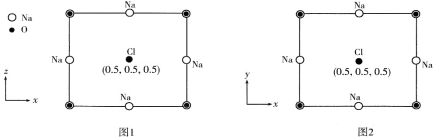
(1)40Zr位于周期表的第5周期IVB族,基态40Zr的价电子排布式为
(2)NH3、PH3和AsH3的沸点由高到低的顺序是
(3)N(CH3)3和P(CH3)3是重要的化工原料。N(CH3)3中N原子的杂化方式为
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。Na3OCl属立方晶系(正方体形),晶胞参数为a pm。晶胞沿y轴和沿z轴投影的各原子的分布图和原子分数坐标分别如图1、图2所示。据此推断该晶胞中Na原子的数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】a~h为元素周期表中前四周期相应元素。
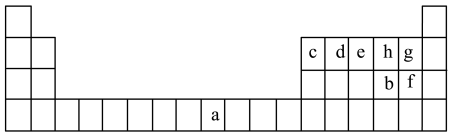
回答下列问题:
(1)元素a基态原子的价电子排布式为______ ;
(2)元素d与b形成的稳定化合物的电子式为______ ,该化合物属于______ 分子(填“极性”或“非极性”);
(3)化合物cg3分子的空间结构为______ ,其中心原子的杂化方式为______ ;键角cg3______ eg3(填“>”“=”或“<”);a~h元素组成的含氧酸根离子中,空间结构与cg3相同的一种是______ (填离子符号);
(4)无水FeCl3共价性较强,在气态时以二聚体形式存在:
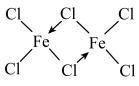
Fe3+的强酸盐水解会得到黄色的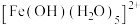 及其二聚体
及其二聚体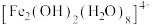 ,请画出该二聚体的结构示意图
,请画出该二聚体的结构示意图______ 。

回答下列问题:
(1)元素a基态原子的价电子排布式为
(2)元素d与b形成的稳定化合物的电子式为
(3)化合物cg3分子的空间结构为
(4)无水FeCl3共价性较强,在气态时以二聚体形式存在:

Fe3+的强酸盐水解会得到黄色的
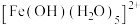 及其二聚体
及其二聚体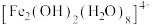 ,请画出该二聚体的结构示意图
,请画出该二聚体的结构示意图
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】铁粉具有平肝镇心解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组设计的利用 ,制备还原铁粉的流程如图:
,制备还原铁粉的流程如图:
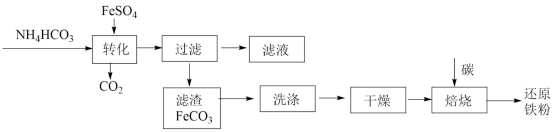
实验室中可用 (用废铁屑和稀硫酸反应制得)和
(用废铁屑和稀硫酸反应制得)和 在如图装置模拟上述流程中的“转化”环节。
在如图装置模拟上述流程中的“转化”环节。
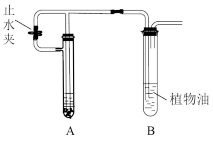
(1)植物油的作用是_______ 。
(2)实验过程中,欲将生成的 溶液和
溶液和 溶液混合,操作方法是
溶液混合,操作方法是_______ ,混合后反应生成 的离子方程式为
的离子方程式为_______ 。
(3)检验久置的FeSO4溶液是否变质的方法是_______ 。
(4)干燥的主要目的是脱去游离水,该过程中会有少量 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为_______ ,取干燥后的 样品11.33g,与木炭混合后焙烧,最终得到还原铁粉5.6g,样品中杂质
样品11.33g,与木炭混合后焙烧,最终得到还原铁粉5.6g,样品中杂质 的质量为
的质量为_______ g。在高温条件下,过量的木炭与 反应,写出此反应的化学方程式:
反应,写出此反应的化学方程式:_______ 。
 ,制备还原铁粉的流程如图:
,制备还原铁粉的流程如图:
实验室中可用
 (用废铁屑和稀硫酸反应制得)和
(用废铁屑和稀硫酸反应制得)和 在如图装置模拟上述流程中的“转化”环节。
在如图装置模拟上述流程中的“转化”环节。
(1)植物油的作用是
(2)实验过程中,欲将生成的
 溶液和
溶液和 溶液混合,操作方法是
溶液混合,操作方法是 的离子方程式为
的离子方程式为(3)检验久置的FeSO4溶液是否变质的方法是
(4)干燥的主要目的是脱去游离水,该过程中会有少量
 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为 样品11.33g,与木炭混合后焙烧,最终得到还原铁粉5.6g,样品中杂质
样品11.33g,与木炭混合后焙烧,最终得到还原铁粉5.6g,样品中杂质 的质量为
的质量为 反应,写出此反应的化学方程式:
反应,写出此反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
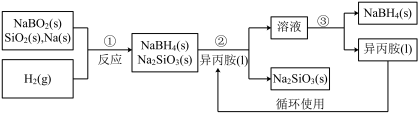
已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______ ;第②步分离采用的方法是______ ;第③步分离NaBH4并回收溶剂,采用的方法是_____ ;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________ ;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__ ;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
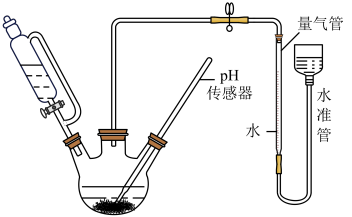
①实验中使用恒压滴液漏斗的原因为_________ ;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____ ( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________ (填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______ mL·min-1。

已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
| pH | 8 | 10 | 12 | 1 4 |
| 温度/℃ | 25 | 25 | 25 | 25 |
| 时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。

①实验中使用恒压滴液漏斗的原因为
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】实验室里除了用二氧化锰和浓盐酸加热制取氯气,也可以利用反应:2KMnO4+16HCl(浓)=2KCl+2MnC12+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,部分装置如图所示:
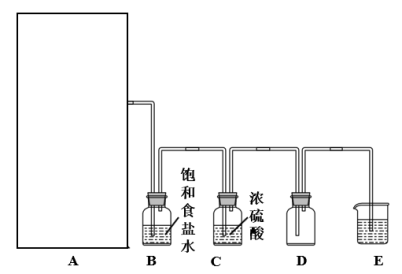
(1)若以KMnO4和浓盐酸为原料制取氯气,请根据反应原理从图中选择合适的制气装置___ (填代号)。
a.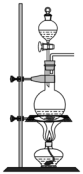 b.
b.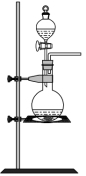 c.
c.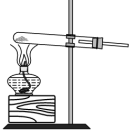
(2)装置B的作用___ 。
(3)E中的试剂选最好的是___ 。
A.NaOH溶液 B.NaCl溶液 C.Na2CO3溶液 D.水

(1)若以KMnO4和浓盐酸为原料制取氯气,请根据反应原理从图中选择合适的制气装置
a.
 b.
b. c.
c.
(2)装置B的作用
(3)E中的试剂选最好的是
A.NaOH溶液 B.NaCl溶液 C.Na2CO3溶液 D.水
您最近一年使用:0次



