某小组为探究 溶解于
溶解于 溶液的反应机理,提出下列两种观点:
溶液的反应机理,提出下列两种观点:
观点一: 的水解导致
的水解导致 溶液呈酸性,
溶液呈酸性, 与
与 反应,从而促进了
反应,从而促进了 的沉淀溶解平衡
的沉淀溶解平衡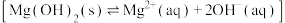 ]向溶解方向移动。
]向溶解方向移动。
观点二: 直接结合了
直接结合了 电离产生
电离产生 ,从而使得
,从而使得 的沉淀溶解平衡向溶解方向移动。
的沉淀溶解平衡向溶解方向移动。
资料:① 溶液呈中性;②
溶液呈中性;② 对该反应几乎无影响。
对该反应几乎无影响。
实验过程:各取 固体
固体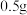 ,分别加入选取的实验试剂中。
,分别加入选取的实验试剂中。
(1)经检验,实验2中刺激性气味气体为 ,其具体方案为
,其具体方案为___________ 。
(2)甲同学对比实验1、2,认为实验2固体能溶解的原因是 溶液中
溶液中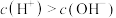 ,能与
,能与 反应。用化学用语解释
反应。用化学用语解释 溶液显酸性的原因
溶液显酸性的原因___________ 。
(3)乙同学通过实验3证明甲同学的说法不合理。
①X是___________ (填写溶质的化学式)。
②由实验3获取的证据为___________ 。
(4)为进一步探究实验2固体能溶解的原因,进行实验4.
乙依据上述实验,可以得出 能与
能与 直接反应。丙同学认为该方案不严谨,需要补充的实验方案是
直接反应。丙同学认为该方案不严谨,需要补充的实验方案是___________ 。
(5)由以上实验可以得出的结论是___________ 。
(6)为进一步分析 溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
分析上述实验数据从平衡移动的角度解释上述现象___________ 。
 溶解于
溶解于 溶液的反应机理,提出下列两种观点:
溶液的反应机理,提出下列两种观点:观点一:
 的水解导致
的水解导致 溶液呈酸性,
溶液呈酸性, 与
与 反应,从而促进了
反应,从而促进了 的沉淀溶解平衡
的沉淀溶解平衡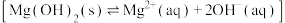 ]向溶解方向移动。
]向溶解方向移动。观点二:
 直接结合了
直接结合了 电离产生
电离产生 ,从而使得
,从而使得 的沉淀溶解平衡向溶解方向移动。
的沉淀溶解平衡向溶解方向移动。资料:①
 溶液呈中性;②
溶液呈中性;② 对该反应几乎无影响。
对该反应几乎无影响。实验过程:各取
 固体
固体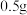 ,分别加入选取的实验试剂中。
,分别加入选取的实验试剂中。| 实验 | 实验试剂 | 实验现象 |
| 1 |  蒸馏水 蒸馏水 | 白色固体不溶解 |
| 2 | 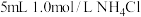 溶液 溶液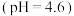 | 在微热下,产生刺激性气味气体且白色固体溶解 |
 ,其具体方案为
,其具体方案为(2)甲同学对比实验1、2,认为实验2固体能溶解的原因是
 溶液中
溶液中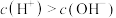 ,能与
,能与 反应。用化学用语解释
反应。用化学用语解释 溶液显酸性的原因
溶液显酸性的原因(3)乙同学通过实验3证明甲同学的说法不合理。
| 实验 | 实验试剂 | 实验现象 |
| 3 | 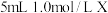 溶液 溶液 |
②由实验3获取的证据为
(4)为进一步探究实验2固体能溶解的原因,进行实验4.
| 实验 | 实验试剂 | 实验现象 |
| 4 | 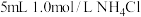 乙醇溶液 乙醇溶液 | 在微热下,白色固体溶解 |
 能与
能与 直接反应。丙同学认为该方案不严谨,需要补充的实验方案是
直接反应。丙同学认为该方案不严谨,需要补充的实验方案是(5)由以上实验可以得出的结论是
(6)为进一步分析
 溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验:
溶液浓度对沉淀溶解的实验效果,丁同学设计如下实验: 溶液的浓度 溶液的浓度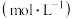 | 现象 |
| 0.05 | 白色浑浊, 后仍有部分不溶解 后仍有部分不溶解 |
| 0.07 | 少量白色浑浊, 左右完全溶解 左右完全溶解 |
| 0.10 | 振荡 后完全溶解 后完全溶解 |
| 0.15 | 振荡 后完全溶解 后完全溶解 |
| 0.20 | 振荡后迅速溶解 |
| 0.30 | 振荡后迅速溶解 |
更新时间:2024-02-25 17:29:47
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】铁盐和亚铁盐用途广泛。
I.氯化铁可用于金属蚀刻,污水处理。
(1)配制FeCl3溶液时,将FeCl3晶体溶于较浓的盐酸中,再稀释至所需浓度,原因是______ 。
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
下列说法正确的是___________ (填标号)。
A.上述实验能判断出温度对氯化铁水解平衡的影响
B.表格中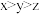
C.上述实验能得出:增大FeCl3溶液的浓度,水解平衡正向移动,水解程度增大
II.硫酸亚铁铵晶体[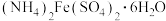 ]俗称摩尔盐,是一种重要的分析试剂,空气中不易被氧化,易溶于水,不溶于乙醇。
]俗称摩尔盐,是一种重要的分析试剂,空气中不易被氧化,易溶于水,不溶于乙醇。
(3)实验室制备摩尔盐:向 溶液中加入
溶液中加入 溶液,调节溶液pH为1~2,在
溶液,调节溶液pH为1~2,在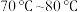 水浴加热,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果溶液pH太高或用玻璃棒搅拌,均可能导致溶液变黄,其原因是
水浴加热,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果溶液pH太高或用玻璃棒搅拌,均可能导致溶液变黄,其原因是___________ ,选用乙醇洗涤晶体的目的是___________ 。
(4)滴定法测定摩尔盐质量分数:称取摩尔盐产品3.920g溶于稀硫酸中,转入100mL容量瓶定容。每次用移液管取25.00mL溶液放入锥形瓶,用 的
的 溶液滴定(还原产物为
溶液滴定(还原产物为 ,杂质不与
,杂质不与 反应),三次平均消耗
反应),三次平均消耗 的
的 溶液。
溶液。
①滴定终点锥形瓶中溶液的颜色变化是___________ 。
②酸性高锰酸钾溶液与 反应的离子方程式是
反应的离子方程式是___________ 。
③产品中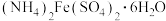 (摩尔质量为
(摩尔质量为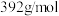 )的质量分数为
)的质量分数为_______ (保留2位小数)。
④实验过程中的下列操作,可能导致测定结果偏高的是___________ (填标号)。
A.取用的晶体不够干燥B.容量瓶定容时仰视刻度线
C.滴定管未用待盛溶液润洗D.滴定完成后,滴定管尖嘴处留有气泡
I.氯化铁可用于金属蚀刻,污水处理。
(1)配制FeCl3溶液时,将FeCl3晶体溶于较浓的盐酸中,再稀释至所需浓度,原因是
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
| 实验 | 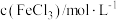 |  | 温度/℃ | pH |
| 1 | 0.1 | 5 | 25 | x |
| 2 | 0.1 | 5 | 35 | y |
| 3 | 0.2 | 5 | 25 | z |
A.上述实验能判断出温度对氯化铁水解平衡的影响
B.表格中
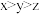
C.上述实验能得出:增大FeCl3溶液的浓度,水解平衡正向移动,水解程度增大
II.硫酸亚铁铵晶体[
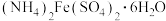 ]俗称摩尔盐,是一种重要的分析试剂,空气中不易被氧化,易溶于水,不溶于乙醇。
]俗称摩尔盐,是一种重要的分析试剂,空气中不易被氧化,易溶于水,不溶于乙醇。(3)实验室制备摩尔盐:向
 溶液中加入
溶液中加入 溶液,调节溶液pH为1~2,在
溶液,调节溶液pH为1~2,在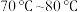 水浴加热,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果溶液pH太高或用玻璃棒搅拌,均可能导致溶液变黄,其原因是
水浴加热,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果溶液pH太高或用玻璃棒搅拌,均可能导致溶液变黄,其原因是(4)滴定法测定摩尔盐质量分数:称取摩尔盐产品3.920g溶于稀硫酸中,转入100mL容量瓶定容。每次用移液管取25.00mL溶液放入锥形瓶,用
 的
的 溶液滴定(还原产物为
溶液滴定(还原产物为 ,杂质不与
,杂质不与 反应),三次平均消耗
反应),三次平均消耗 的
的 溶液。
溶液。①滴定终点锥形瓶中溶液的颜色变化是
②酸性高锰酸钾溶液与
 反应的离子方程式是
反应的离子方程式是③产品中
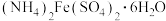 (摩尔质量为
(摩尔质量为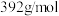 )的质量分数为
)的质量分数为④实验过程中的下列操作,可能导致测定结果偏高的是
A.取用的晶体不够干燥B.容量瓶定容时仰视刻度线
C.滴定管未用待盛溶液润洗D.滴定完成后,滴定管尖嘴处留有气泡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】水溶液是中学化学的重点研究对象。水是极弱的电解质,也是最重要的溶剂。
(1)常温下某电解质溶解在水中后,溶液中的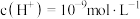 ,则该电解质可能是
,则该电解质可能是_____ (填序号)。
A. B.
B. C.
C. D.
D. E.
E.
(2)实验室配制的 溶液,常常出现浑浊,可采取在配制时加入少量
溶液,常常出现浑浊,可采取在配制时加入少量_____ (填化学式)防止浑浊。
(3)泡沫灭火器中盛放的灭火剂包括 溶液(约
溶液(约 )、
)、 溶液(约
溶液(约 )及起泡剂,使用时发生反应的离子方程式是
)及起泡剂,使用时发生反应的离子方程式是________ 。
(4)用惰性电极电解下列电解质溶液,只生成氢气和氧气的是______ (填序号)。
① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦
(5)室温下,如果将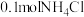 和
和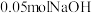 全部溶于水,形成混合溶液(假设无损失),
全部溶于水,形成混合溶液(假设无损失),_____ 和_____ 两种粒子的物质的量之和比 多
多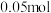 。
。
(1)常温下某电解质溶解在水中后,溶液中的
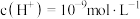 ,则该电解质可能是
,则该电解质可能是A.
 B.
B. C.
C. D.
D. E.
E.
(2)实验室配制的
 溶液,常常出现浑浊,可采取在配制时加入少量
溶液,常常出现浑浊,可采取在配制时加入少量(3)泡沫灭火器中盛放的灭火剂包括
 溶液(约
溶液(约 )、
)、 溶液(约
溶液(约 )及起泡剂,使用时发生反应的离子方程式是
)及起泡剂,使用时发生反应的离子方程式是(4)用惰性电极电解下列电解质溶液,只生成氢气和氧气的是
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦
(5)室温下,如果将
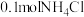 和
和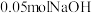 全部溶于水,形成混合溶液(假设无损失),
全部溶于水,形成混合溶液(假设无损失), 多
多 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
甲同学认为,该溶液的pH升高的原因是 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为 +H2O
+H2O H2CO3+OH-。
H2CO3+OH-。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_______ (填“甲”或“乙”)判断正确。试剂X是_______ 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10 ℃,若溶液的pH___________ (填“高于”“低于”或“等于”)8.3,则___________ (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言_______ (填“甲”或“乙”)判断是错误的,理由是___________ 。
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为 +H2O
+H2O H2CO3+OH-。
H2CO3+OH-。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10 ℃,若溶液的pH
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。回答下列问题:
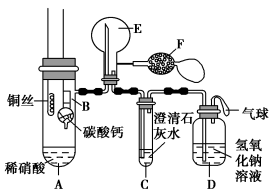
(1)实验中,先将装置B下移,使碳酸钙与稀硝酸接触,装置C中产生白色沉淀时,立刻将装置B上提。
①进行此操作的目的是___________ 。
②装置C中产生的白色沉淀的化学式为___________ 。
③装置D的作用是___________ 。
④装置C中产生白色沉淀后,立刻将装置B上提的原因是___________ 。
(2)将装置A中铜丝放入稀硝酸中,给装置A微微加热,装置A中产生无色气体。
①写出发生反应的化学方程式:___________ 。
②用装置F向装置E中鼓入空气后出现红棕色,其原因是___________ 。
(3)一段时间后,装置C中白色沉淀溶解,请用化学方程式解释其原因:___________ 、___________ 。

(1)实验中,先将装置B下移,使碳酸钙与稀硝酸接触,装置C中产生白色沉淀时,立刻将装置B上提。
①进行此操作的目的是
②装置C中产生的白色沉淀的化学式为
③装置D的作用是
④装置C中产生白色沉淀后,立刻将装置B上提的原因是
(2)将装置A中铜丝放入稀硝酸中,给装置A微微加热,装置A中产生无色气体。
①写出发生反应的化学方程式:
②用装置F向装置E中鼓入空气后出现红棕色,其原因是
(3)一段时间后,装置C中白色沉淀溶解,请用化学方程式解释其原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净干燥的CO2。

甲装置中盛放稀盐酸仪器的名称是____ ,乙装置中盛放的溶液是____ 。
(2)按照如图装置进行实验(夹持装置略)。

①先组装仪器,然后____ ,再用注射器1抽取100mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开K1、K2,向右推动注射器1的活塞,可观察到的现象是____ 。
③实验过程中,需缓慢推入CO2,其目的是____ ,为达到相同目的,还可进行的操作是____ 。反应的化学方程式为____ 。
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为80mL,则相同条件下反应消耗CO2的体积是____ 。
(1)用如图装置制备纯净干燥的CO2。

甲装置中盛放稀盐酸仪器的名称是
(2)按照如图装置进行实验(夹持装置略)。

①先组装仪器,然后
②打开K1、K2,向右推动注射器1的活塞,可观察到的现象是
③实验过程中,需缓慢推入CO2,其目的是
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为80mL,则相同条件下反应消耗CO2的体积是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】某课外活动小组欲利用CuO与氨反应,研究氨的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
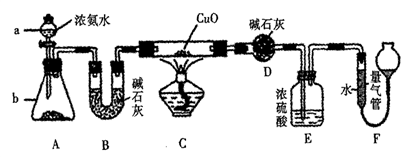
(1)仪器a的名称为_________ 。
(2)实验室中,利用装置A,还可制取的无色气体是_________ (填字母)。
A.Cl2 B.04 C.C02 D.N02
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管内有无色无味的气体生成,上述现象证明氨气具有________ 性,写出相应的化学方程式 __________ 。
(4)D装置的作用是__________ 。
(5)E装置中浓硫酸的作用是__________ 。
(6)读取气体体积前,应对装置F进行的操作是__________ 。

(1)仪器a的名称为
(2)实验室中,利用装置A,还可制取的无色气体是
A.Cl2 B.04 C.C02 D.N02
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管内有无色无味的气体生成,上述现象证明氨气具有
(4)D装置的作用是
(5)E装置中浓硫酸的作用是
(6)读取气体体积前,应对装置F进行的操作是
您最近一年使用:0次



