碘及碘的化合物在生产、生活中有广泛应用。在KI溶液中滴加少量 溶液发生有关反应如下:
溶液发生有关反应如下:
①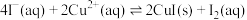
 ;
;
②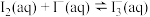 (棕黄色)
(棕黄色)  。
。
回答下列问题:
(1)在碘水中加入 ,萃取、分液得到紫红色液体和水层(M)。
,萃取、分液得到紫红色液体和水层(M)。
①由此可知, 的溶解度:四氯化碳>水,从结构角度分析其原因:
的溶解度:四氯化碳>水,从结构角度分析其原因:___________ ;
②检验M中是否有 的试剂是
的试剂是___________ 。
(2)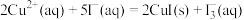

___________ 。
(3)一定温度下,在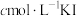 溶液中加入适量的
溶液中加入适量的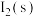 ,只发生反应
,只发生反应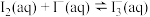
 。测得
。测得 与温度(T)关系如图所示。
与温度(T)关系如图所示。
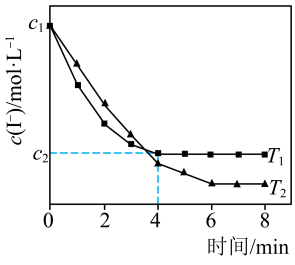
①
___________ (填“>”“<”或“=”)0。
② 温度下,0~4min时间段内
温度下,0~4min时间段内 平均速率
平均速率 为
为___________  。
。
(4)某温度下,起始在反应器中加入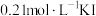 溶液和
溶液和 固体(忽略溶液体积变化),发生上述①②反应。测得
固体(忽略溶液体积变化),发生上述①②反应。测得 、
、 、
、 的平衡浓度与起始
的平衡浓度与起始 关系如图所示。
关系如图所示。
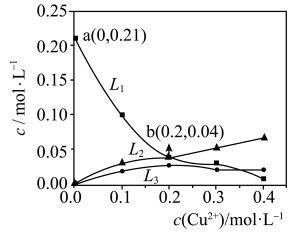
①起始 时,
时, 的平衡转化率为
的平衡转化率为___________ 。
②该温度下,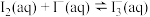 的平衡常数K=
的平衡常数K=___________ 。
(5) 的氧化性比
的氧化性比 的强,但是KI和
的强,但是KI和 发生复分解反应,不发生氧化还原反应,其原因是
发生复分解反应,不发生氧化还原反应,其原因是___________ 。
 溶液发生有关反应如下:
溶液发生有关反应如下:①
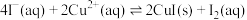
 ;
;②
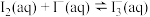 (棕黄色)
(棕黄色)  。
。回答下列问题:
(1)在碘水中加入
 ,萃取、分液得到紫红色液体和水层(M)。
,萃取、分液得到紫红色液体和水层(M)。①由此可知,
 的溶解度:四氯化碳>水,从结构角度分析其原因:
的溶解度:四氯化碳>水,从结构角度分析其原因:②检验M中是否有
 的试剂是
的试剂是(2)
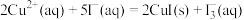

(3)一定温度下,在
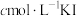 溶液中加入适量的
溶液中加入适量的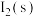 ,只发生反应
,只发生反应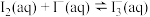
 。测得
。测得 与温度(T)关系如图所示。
与温度(T)关系如图所示。
①

②
 温度下,0~4min时间段内
温度下,0~4min时间段内 平均速率
平均速率 为
为 。
。(4)某温度下,起始在反应器中加入
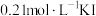 溶液和
溶液和 固体(忽略溶液体积变化),发生上述①②反应。测得
固体(忽略溶液体积变化),发生上述①②反应。测得 、
、 、
、 的平衡浓度与起始
的平衡浓度与起始 关系如图所示。
关系如图所示。
①起始
 时,
时, 的平衡转化率为
的平衡转化率为②该温度下,
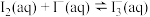 的平衡常数K=
的平衡常数K=(5)
 的氧化性比
的氧化性比 的强,但是KI和
的强,但是KI和 发生复分解反应,不发生氧化还原反应,其原因是
发生复分解反应,不发生氧化还原反应,其原因是
更新时间:2024-03-08 17:28:10
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】(12分)新型洁净能源能够解决环境污染、能源短缺等问题,真正把“绿水青山就是金山银山”落实到我国的各个角落。氢气作为清洁高效、可持续“零碳”能源被广泛研究,而水煤气变换反应(WGSR)是一个重要的制氢手段。
(1)WGSR的氧化还原机理和羧基机理如图所示。则热化学方程式CO(g)+H2O(g)=CO2(g)+H2(g) ΔH中,对ΔH表述错误的是________ (填字母)。

A.氧化还原机理途径:ΔH=ΔH1+ΔH2+ΔH5a+ΔH7
B.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5d+ΔH7
C.氧化还原机理途径:ΔH=ΔH1+ΔH3+ΔH5a+ΔH7
D.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5c+ΔH7
E.ΔH=ΔH1+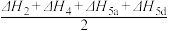 +ΔH7
+ΔH7
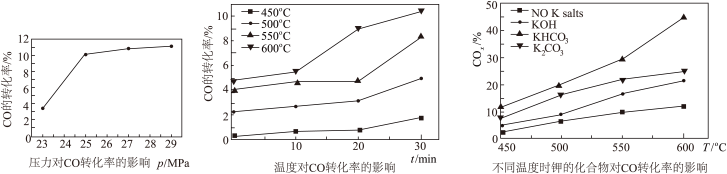
(2)水煤气变换反应在不同条件时CO的转化率不同,下图为压力、温度、不同温度时钾的化合物对CO的转化率的影响关系图,请认真观察图中信息,结合自己所学知识及生产实际,写出水煤气变换反应的条件:温度选择________ ℃;钾的化合物中_______ 催化效果最明显;压力选择______ Mpa,选用此压力的原因为________ 。
(3)如图是Au12Cu、Au12Pt、Au12Ni三种催化剂在合金团簇上WGSR最佳反应路径的基元反应能量图,反应能垒(活化能)最_______ (填“高”或“低”)的步骤,为整个反应的速控步骤;三种催化剂催化反应的速控步骤__________ (填“相同”或“不相同”);三种催化剂中,___________ 在合金团簇上的WGSR各基元反应能垒较小,对WGSR表现出较好的催化活性。

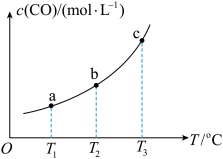
(4)已知某密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。若T1、T2、T3时的平衡常数分别为K1、K2、K3,则K1、K2、K3由小到大的关系为
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。若T1、T2、T3时的平衡常数分别为K1、K2、K3,则K1、K2、K3由小到大的关系为____________ 。
(1)WGSR的氧化还原机理和羧基机理如图所示。则热化学方程式CO(g)+H2O(g)=CO2(g)+H2(g) ΔH中,对ΔH表述错误的是

A.氧化还原机理途径:ΔH=ΔH1+ΔH2+ΔH5a+ΔH7
B.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5d+ΔH7
C.氧化还原机理途径:ΔH=ΔH1+ΔH3+ΔH5a+ΔH7
D.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5c+ΔH7
E.ΔH=ΔH1+
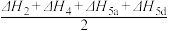 +ΔH7
+ΔH7(2)水煤气变换反应在不同条件时CO的转化率不同,下图为压力、温度、不同温度时钾的化合物对CO的转化率的影响关系图,请认真观察图中信息,结合自己所学知识及生产实际,写出水煤气变换反应的条件:温度选择

(3)如图是Au12Cu、Au12Pt、Au12Ni三种催化剂在合金团簇上WGSR最佳反应路径的基元反应能量图,反应能垒(活化能)最

(4)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)
 CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。若T1、T2、T3时的平衡常数分别为K1、K2、K3,则K1、K2、K3由小到大的关系为
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。若T1、T2、T3时的平衡常数分别为K1、K2、K3,则K1、K2、K3由小到大的关系为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】化学链燃烧( )是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集
)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于 载氧体的甲烷化学链燃烧技术示意图如下。
载氧体的甲烷化学链燃烧技术示意图如下。
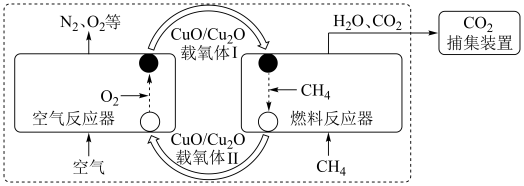
空气反应器与燃料反应器中发生的反应分别为:
①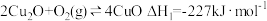
②
(1)反应

_______  。
。
(2)反应②的平衡常数表达式
_______ 。
(3)氧的质量分数:载氧体Ⅰ_______ (填“>”“=”或“<”)载氧体Ⅱ。
(4)往盛有 载氧体的刚性密闭容器中充入空气【氧气的物质的量分数
载氧体的刚性密闭容器中充入空气【氧气的物质的量分数 为21%】,发生反应①。平衡时
为21%】,发生反应①。平衡时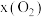 随反应温度T变化的曲线如图所示。
随反应温度T变化的曲线如图所示。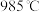 时
时 的平衡转化率
的平衡转化率
_______ (保留2位有效数字)。
(5)根据下图,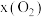 随温度升高而增大的原因是
随温度升高而增大的原因是_______ 。反应温度必须控制在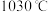 以下,原因是
以下,原因是_______ 。

(6)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的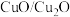 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。
由表中数据判断:使用_______ (填“氧化铝”或“膨润土”)掺杂的载氧体反应较快;使用氧化铝或者膨润土掺杂的载氧体,单位时间内燃料反应器释放的热量分别为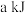 、
、 ,则a
,则a_______ b(填“>”“=”或“<”)。
 )是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集
)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集 。基于
。基于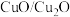 载氧体的甲烷化学链燃烧技术示意图如下。
载氧体的甲烷化学链燃烧技术示意图如下。
空气反应器与燃料反应器中发生的反应分别为:
①
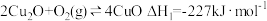
②

(1)反应


 。
。(2)反应②的平衡常数表达式

(3)氧的质量分数:载氧体Ⅰ
(4)往盛有
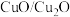 载氧体的刚性密闭容器中充入空气【氧气的物质的量分数
载氧体的刚性密闭容器中充入空气【氧气的物质的量分数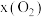 为21%】,发生反应①。平衡时
为21%】,发生反应①。平衡时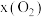 随反应温度T变化的曲线如图所示。
随反应温度T变化的曲线如图所示。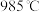 时
时 的平衡转化率
的平衡转化率
(5)根据下图,
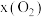 随温度升高而增大的原因是
随温度升高而增大的原因是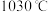 以下,原因是
以下,原因是
(6)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的
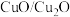 载氧体,反应②活化能如下表所示。
载氧体,反应②活化能如下表所示。| 载氧体掺杂物质 | 氧化铝 | 膨润土 |
活化能/ |  | 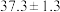 |
 、
、 ,则a
,则a
您最近一年使用:0次
【推荐3】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在 200℃和 10MPa 的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和 CH3OH 的燃烧热分别 784kJ/mol 和 628kJ/mol 则 2CH4(g)+O2(g)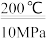 2CH3OH(g) △H=
2CH3OH(g) △H=_____ 。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) ⇌CH3OCH3(g) +H2O(g) △H<0。某温度下,,将 2.0molCO(g)和 6.0molH2(g)充入容积为 2L 的密闭容器中,反应到达平衡时, 改变压强和温度,平衡体系中 CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是_____ 。
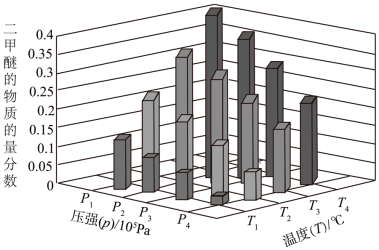
A.p3>p2,T3>T2
B.p1>p3,T1>T3
C.p1>p4,T2>T3
D.p2>p4,T4>T2
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g) +N2(g);
2CO2(g) +N2(g);
①200K、pPa时,在一个容积为 2L的恒温密闭容器中充入 1.5molNO 和 2.0molCO,开始反应至 2min 时测得 CO 转化率为 30%,则用N2表示的平均反应速率为v(N2)=_________ ;反应达到平衡状态时,测得二氧化碳为 0.8mol,则平衡时的压强为起始压强的_________ 倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH_____ 0(填“>”、“<”)
(4)一定温度下,将NO2与SO2以体积比 1:2 置于密闭容器中发生反应NO2(g)+SO2(g)⇌ SO3(g)+NO(g),达到平衡时SO3的体积分数为 25%。该反应的平衡常数K=______ 。
(5)利用原电池反应可实现NO2的无害化,总反应为6NO2+ 8NH3=7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池正极区附近溶液 pH____ (填“变大”、“变小”或“不变”),负极电极反应式为 ____ 。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在 200℃和 10MPa 的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和 CH3OH 的燃烧热分别 784kJ/mol 和 628kJ/mol 则 2CH4(g)+O2(g)
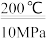 2CH3OH(g) △H=
2CH3OH(g) △H=(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) ⇌CH3OCH3(g) +H2O(g) △H<0。某温度下,,将 2.0molCO(g)和 6.0molH2(g)充入容积为 2L 的密闭容器中,反应到达平衡时, 改变压强和温度,平衡体系中 CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是

A.p3>p2,T3>T2
B.p1>p3,T1>T3
C.p1>p4,T2>T3
D.p2>p4,T4>T2
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g) +N2(g);
2CO2(g) +N2(g);①200K、pPa时,在一个容积为 2L的恒温密闭容器中充入 1.5molNO 和 2.0molCO,开始反应至 2min 时测得 CO 转化率为 30%,则用N2表示的平均反应速率为v(N2)=
②该反应在低温下能自发进行,该反应的ΔH
(4)一定温度下,将NO2与SO2以体积比 1:2 置于密闭容器中发生反应NO2(g)+SO2(g)⇌ SO3(g)+NO(g),达到平衡时SO3的体积分数为 25%。该反应的平衡常数K=
(5)利用原电池反应可实现NO2的无害化,总反应为6NO2+ 8NH3=7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池正极区附近溶液 pH
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】某科研团队利用 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
(1)已知:①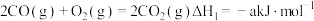
②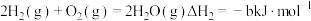
③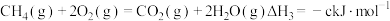
则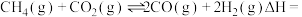
___________ (用含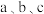 的式子表示)。
的式子表示)。
(2) 均为
均为 的恒容密闭容器,向
的恒容密闭容器,向 容器中充入
容器中充入 和
和 ,向
,向 容器中充入
容器中充入 和
和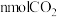 ,在催化剂存在下发生反应:
,在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图甲所示.
的平衡转化率随温度的变化如图甲所示.

① 容器中在温度为
容器中在温度为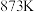 时,
时, 到达
到达 点,用
点,用 表示
表示 内的化学反应速率为
内的化学反应速率为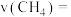
___________ ,此时的化学平衡常数 为
为___________ (保留两位小数),若在此温度下时向 容器的平衡体系中再充入
容器的平衡体系中再充入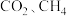 各
各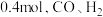 各
各 ,重新达到平衡前,
,重新达到平衡前,
___________  (填“
(填“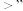 “
“ ”或
”或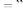 )。
)。
② 点时该反应的平衡常数为
点时该反应的平衡常数为 ,则
,则
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③ 两点处容器内气体总压强分别是
两点处容器内气体总压强分别是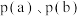 ,则
,则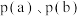 的大小顺序为
的大小顺序为___________ 。
(3)对于反应③: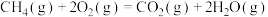 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图乙所示.
的转化率随温度的变化如图乙所示.
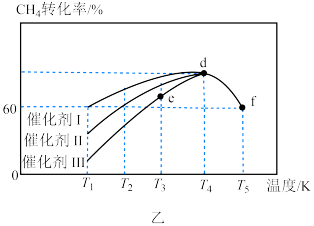
则催化效果最佳的是催化剂___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”).如果 点已经达到平衡状态,则
点已经达到平衡状态,则 点的
点的
___________  (填“>”“<”或“=”),
(填“>”“<”或“=”), 点转化率比
点转化率比 点低的原因是
点低的原因是______________________ 。
 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:(1)已知:①
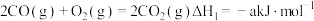
②
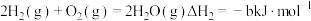
③
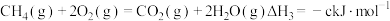
则
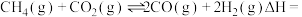
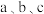 的式子表示)。
的式子表示)。(2)
 均为
均为 的恒容密闭容器,向
的恒容密闭容器,向 容器中充入
容器中充入 和
和 ,向
,向 容器中充入
容器中充入 和
和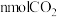 ,在催化剂存在下发生反应:
,在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图甲所示.
的平衡转化率随温度的变化如图甲所示.
①
 容器中在温度为
容器中在温度为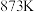 时,
时, 到达
到达 点,用
点,用 表示
表示 内的化学反应速率为
内的化学反应速率为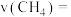
 为
为 容器的平衡体系中再充入
容器的平衡体系中再充入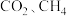 各
各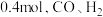 各
各 ,重新达到平衡前,
,重新达到平衡前,
 (填“
(填“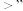 “
“ ”或
”或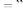 )。
)。②
 点时该反应的平衡常数为
点时该反应的平衡常数为 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③
 两点处容器内气体总压强分别是
两点处容器内气体总压强分别是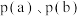 ,则
,则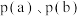 的大小顺序为
的大小顺序为(3)对于反应③:
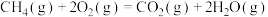 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图乙所示.
的转化率随温度的变化如图乙所示.
则催化效果最佳的是催化剂
 点已经达到平衡状态,则
点已经达到平衡状态,则 点的
点的
 (填“>”“<”或“=”),
(填“>”“<”或“=”), 点转化率比
点转化率比 点低的原因是
点低的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氮的氧化物是大气污染物之一,研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)已知:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.0kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0kJ/mol
写出NH3与NO反应生成N2和H2O(g)的热化学方程式:_______ 。
(2)氢气选择性催化还原NO是一种比NH3还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:
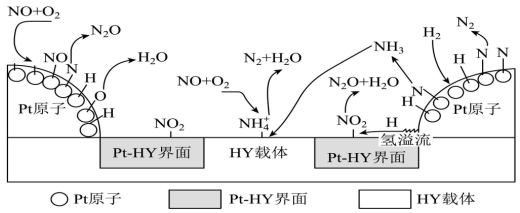
Pt原子表面上发生的反应除N+N=N2、2H+O=H2O外还有_______ 。
(3)在密闭容器中充入4molNO和5molH2,发生反应:2NO(g)+2H2(g) N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
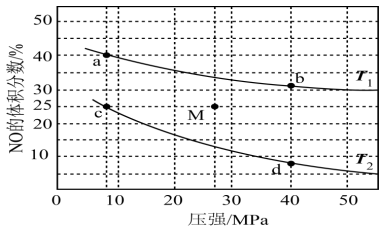
①下列物理量中,图中d点大于b点的是_______ (填字母)。
A.正反应速率 B.H2的转化率
C.N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为_______ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点:_______ 。
(4)T℃时,向容积为2L的恒容容器中充入0.4molNO、0.8molH2发生反应:2NO(g)+2H2(g) N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:
N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:
①0~20min内该反应的平均反应速率v(NO)= _______ mol/(L·min)。
②该温度下反应的平衡常数Kp=_______ kPa-1(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
(1)已知:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.0kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0kJ/mol
写出NH3与NO反应生成N2和H2O(g)的热化学方程式:
(2)氢气选择性催化还原NO是一种比NH3还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:

Pt原子表面上发生的反应除N+N=N2、2H+O=H2O外还有
(3)在密闭容器中充入4molNO和5molH2,发生反应:2NO(g)+2H2(g)
 N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.H2的转化率
C.N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点:
(4)T℃时,向容积为2L的恒容容器中充入0.4molNO、0.8molH2发生反应:2NO(g)+2H2(g)
 N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:
N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:| t/min | 0 | 10 | 20 | 30 | 40 |
| p/kPa | 240 | 226 | 216 | 210 | 210 |
②该温度下反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】 是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
(1)已知利用合成气(主要成分 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为_____________________ (填“放热”或“吸热”)反应。 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收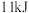 热量,请写出热化学方程式:
热量,请写出热化学方程式:_____________________________________________________ 。
(3)现在实验室中用 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内, 时发生反应:
时发生反应: ,体系中
,体系中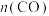 随时间的变化如表:
随时间的变化如表:
①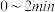 内,以
内,以 表示的该反应速率
表示的该反应速率
_____________________ 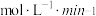 ;
;
②下列措施不能提高反应速率的有_____________________ (请用相应字母填空);
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂
③下列叙述能说明反应达到平衡状态的是_____________________ (请用相应字母填空);
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成
 容器内气体密度保持不变
容器内气体密度保持不变
 容器内质量保持不变
容器内质量保持不变
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。(1)已知利用合成气(主要成分
 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为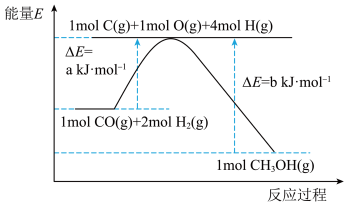
 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收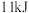 热量,请写出热化学方程式:
热量,请写出热化学方程式:(3)现在实验室中用
 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内,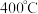 时发生反应:
时发生反应: ,体系中
,体系中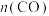 随时间的变化如表:
随时间的变化如表:时间 | 0 | 1 | 2 | 3 | 5 |
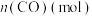 | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
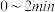 内,以
内,以 表示的该反应速率
表示的该反应速率
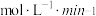 ;
;②下列措施不能提高反应速率的有
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂③下列叙述能说明反应达到平衡状态的是
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成 容器内气体密度保持不变
容器内气体密度保持不变 容器内质量保持不变
容器内质量保持不变
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】 是一种重要的化工品,一定温度下发生分解反应:
是一种重要的化工品,一定温度下发生分解反应:
①

②

③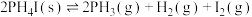

回答下列问题:
(1)
_____ (用含 和
和 的式子表示),
的式子表示),
_______ ((填“ ”“
”“ ”或“
”或“ ”)0。
”)0。
(2)向一恒温恒容密闭容器中投入足量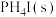 ,只发生反应①,下列叙述正确的是
,只发生反应①,下列叙述正确的是_______ (填标号)。
A.平衡后,再充入少量 ,
, 质量增大
质量增大
B. 体积分数不变时,该反应达到平衡状态
体积分数不变时,该反应达到平衡状态
C.再投入一定量的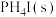 ,反应速率明显增大
,反应速率明显增大
(3) 的速率方程为
的速率方程为 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
①某温度下, ,
,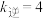 ,则
,则
_______ 。
②已知: (R为常数,
(R为常数,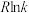 的单位为
的单位为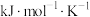 ,温度T的单位为K,E的单位为
,温度T的单位为K,E的单位为 )。速率常数
)。速率常数 与活化能(
与活化能( )、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。
)、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。
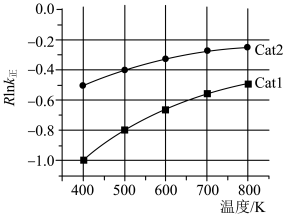
相同条件下,催化效率较高的是_______ (填“Cat1”或“Cat2”),判断依据是_______ 。在催化剂Cat2作用下,正反应的活化能为_______  。
。
(4)一定温度下,向一体积为1L的恒容密闭容器中充入足量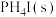 ,达到平衡时测得生成1mol
,达到平衡时测得生成1mol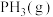 和0.4mol
和0.4mol ,则
,则 的平衡常数
的平衡常数
_______ 。
(5)向甲、乙两个体积相等的容器中都充入2molHI,发生反应: 。测得
。测得 的物质的量与时间的关系如图。
的物质的量与时间的关系如图。

①相对甲,乙仅改变一个条件,该条件是_______ 。
②甲容器中,在恒容条件下18min时再充入少量HI,HI的平衡转化率将_______ (填“增大”“减小”或“不变”)。
 是一种重要的化工品,一定温度下发生分解反应:
是一种重要的化工品,一定温度下发生分解反应:①


②


③
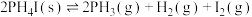

回答下列问题:
(1)

 和
和 的式子表示),
的式子表示),
 ”“
”“ ”或“
”或“ ”)0。
”)0。(2)向一恒温恒容密闭容器中投入足量
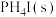 ,只发生反应①,下列叙述正确的是
,只发生反应①,下列叙述正确的是A.平衡后,再充入少量
 ,
, 质量增大
质量增大B.
 体积分数不变时,该反应达到平衡状态
体积分数不变时,该反应达到平衡状态C.再投入一定量的
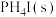 ,反应速率明显增大
,反应速率明显增大(3)
 的速率方程为
的速率方程为 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。①某温度下,
 ,
,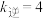 ,则
,则
②已知:
 (R为常数,
(R为常数,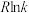 的单位为
的单位为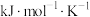 ,温度T的单位为K,E的单位为
,温度T的单位为K,E的单位为 )。速率常数
)。速率常数 与活化能(
与活化能( )、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。
)、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。
相同条件下,催化效率较高的是
 。
。(4)一定温度下,向一体积为1L的恒容密闭容器中充入足量
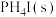 ,达到平衡时测得生成1mol
,达到平衡时测得生成1mol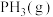 和0.4mol
和0.4mol ,则
,则 的平衡常数
的平衡常数
(5)向甲、乙两个体积相等的容器中都充入2molHI,发生反应:
 。测得
。测得 的物质的量与时间的关系如图。
的物质的量与时间的关系如图。
①相对甲,乙仅改变一个条件,该条件是
②甲容器中,在恒容条件下18min时再充入少量HI,HI的平衡转化率将
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】一种阳极泥的主要成分为Cu、Ag、Pt、Au、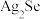 和
和 ,从中回收Se和贵重金属的工艺流程如图所示。
,从中回收Se和贵重金属的工艺流程如图所示。

已知:①该工艺中萃取与反萃取原理为: ;
;
② 在碱性条件下很稳定,有很强的络合能力,与
在碱性条件下很稳定,有很强的络合能力,与 形成配离子
形成配离子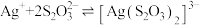 ,常温下该反应的平衡常数
,常温下该反应的平衡常数 。
。
回答下列问题:
(1)试列举可加快“焙烧”速率的措施:_______ (任写一条),写出 焙烧时生成CuO的化学方程式:
焙烧时生成CuO的化学方程式:_______ 。
(2)“滤渣Ⅰ”的主要成分是_______ ;“酸浸氧化”中通入氧气的目的是_______ 。
(3)“沉银”时证明银离子沉淀完全的操作是_______ 。
(4)萃取后得到有机相的操作方法是分液,“反萃取剂”最好选用_______ (填化学式)溶液。
(5)“溶浸”中发生的反应为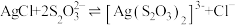 ,该反应中平衡常数K′=
,该反应中平衡常数K′=_______ [已知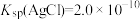 ]。
]。
(6)“滤液Ⅳ”中含有 ,则“还原”中发生反应的离子方程式为
,则“还原”中发生反应的离子方程式为_______ (提示:“滤液Ⅳ”可返回“溶浸”工序循环使用)。
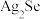 和
和 ,从中回收Se和贵重金属的工艺流程如图所示。
,从中回收Se和贵重金属的工艺流程如图所示。
已知:①该工艺中萃取与反萃取原理为:
 ;
;②
 在碱性条件下很稳定,有很强的络合能力,与
在碱性条件下很稳定,有很强的络合能力,与 形成配离子
形成配离子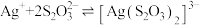 ,常温下该反应的平衡常数
,常温下该反应的平衡常数 。
。回答下列问题:
(1)试列举可加快“焙烧”速率的措施:
 焙烧时生成CuO的化学方程式:
焙烧时生成CuO的化学方程式:(2)“滤渣Ⅰ”的主要成分是
(3)“沉银”时证明银离子沉淀完全的操作是
(4)萃取后得到有机相的操作方法是分液,“反萃取剂”最好选用
(5)“溶浸”中发生的反应为
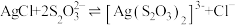 ,该反应中平衡常数K′=
,该反应中平衡常数K′=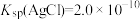 ]。
]。(6)“滤液Ⅳ”中含有
 ,则“还原”中发生反应的离子方程式为
,则“还原”中发生反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】H2和CH3OH都是重要的能源物质,CO2催化加氢合成甲醇是一种有效利用氢气且减少温室气体CO2排放的方法。该反应体系中涉及以下三个反应:
反应Ⅰ:
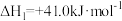
反应Ⅱ:

反应Ⅲ:
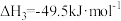
已知:
(1)
_____  ,该反应的活化能
,该反应的活化能 (正)
(正)_____  (逆)(填“大于”或“小于”)。
(逆)(填“大于”或“小于”)。
(2)反应Ⅲ的正、逆反应速率方程为: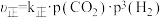 ,
,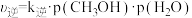 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。恒温恒压密闭容器中,加入
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。恒温恒压密闭容器中,加入 和
和 ,初始压强为
,初始压强为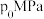 ,反应达平衡时,
,反应达平衡时, 的转化率为60%,容器体积减小25%。则
的转化率为60%,容器体积减小25%。则 的选择性为
的选择性为_______ ,反应Ⅲ的平衡常数 为
为_______ (用平衡分压代替平衡浓度,分压=总压×物质的量分数,用含 的最简分数式表示,下同)。该条件下测得某时刻
的最简分数式表示,下同)。该条件下测得某时刻 ,
,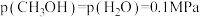 ,
, ,此时
,此时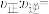
______ 。
(3)恒压下将 和
和 按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内
按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图:
的选择性和产率随温度的变化如图:_______ 。
②保持温度不变,增大压强,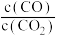
_______ (填“增大”、“减小”或“不变”)。
反应Ⅰ:

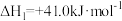
反应Ⅱ:


反应Ⅲ:

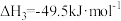
已知:

(1)

 ,该反应的活化能
,该反应的活化能 (正)
(正) (逆)(填“大于”或“小于”)。
(逆)(填“大于”或“小于”)。(2)反应Ⅲ的正、逆反应速率方程为:
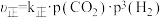 ,
,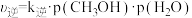 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。恒温恒压密闭容器中,加入
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。恒温恒压密闭容器中,加入 和
和 ,初始压强为
,初始压强为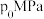 ,反应达平衡时,
,反应达平衡时, 的转化率为60%,容器体积减小25%。则
的转化率为60%,容器体积减小25%。则 的选择性为
的选择性为 为
为 的最简分数式表示,下同)。该条件下测得某时刻
的最简分数式表示,下同)。该条件下测得某时刻 ,
,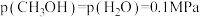 ,
, ,此时
,此时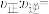
(3)恒压下将
 和
和 按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内
按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图:
的选择性和产率随温度的变化如图: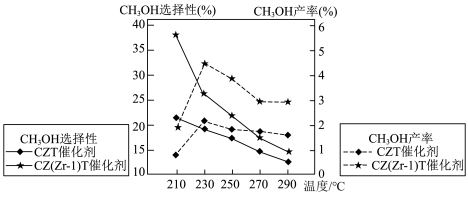
②保持温度不变,增大压强,
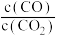
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
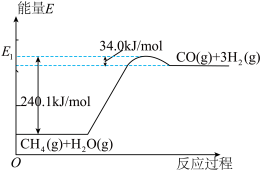
【推荐1】CH4和H2O在一定条件下, 可以转化为合成一系列有机化合物、氨的重要原料(CO+H2),这种方法称作甲烷水蒸气重整法制合成气,其能量变化如图:
(1)甲烷水蒸气重整法制合成气的热化学方程式为_______ ;该反应只有在_____ (填“高温”、“低温”或“常温”)才自发进行。
(2)下列有关甲烷水然气重整法制合成气的说法正确的是_______ (填字母)。
A.相同条件下,该反应的逆反应更易发生
B.恒温恒容时充入一定量CO2,可促进CH4转化并可调节CO和H2的比例
C.若反应的高效催化剂为A,则A一定是CO和H2合成CH4的高效催化剂
D.恒温时向上述平衡体系中充入少量Ar,平衡一定不移动
E.有副反应:H2O+CO CO2+H2
CO2+H2
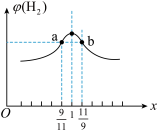
(3)在恒容密闭容器中充入2mol的CH4和H2O(g)混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图所示。请问a、b两点比较(填“>”、“<”、“=”);CH4的转化率a点____ b点,a点CH4的浓度_____ b点H2O(g)的浓度,氢气的产率a点_____ b点。
(4)当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图,则压强由大到小的排序是_____ ;当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是_____________________ 。
(5)在下图左室充入1molCH4和H2O(g)混合气体(物质的量之比为1:1),恒温条件下反应建立平衡,测得CH4的转化率为50%,则其平衡常数为_________ 。
(1)甲烷水蒸气重整法制合成气的热化学方程式为
(2)下列有关甲烷水然气重整法制合成气的说法正确的是
A.相同条件下,该反应的逆反应更易发生
B.恒温恒容时充入一定量CO2,可促进CH4转化并可调节CO和H2的比例
C.若反应的高效催化剂为A,则A一定是CO和H2合成CH4的高效催化剂
D.恒温时向上述平衡体系中充入少量Ar,平衡一定不移动
E.有副反应:H2O+CO
 CO2+H2
CO2+H2(3)在恒容密闭容器中充入2mol的CH4和H2O(g)混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图所示。请问a、b两点比较(填“>”、“<”、“=”);CH4的转化率a点
(4)当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图,则压强由大到小的排序是

(5)在下图左室充入1molCH4和H2O(g)混合气体(物质的量之比为1:1),恒温条件下反应建立平衡,测得CH4的转化率为50%,则其平衡常数为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】长征三号甲运载火箭(CZ—3A)与“嫦娥工程“太空摆渡车”“北斗卫星”“风云卫星”等中国航天大事件紧密相连。它是大型三级液体推进剂火箭,一子级和二子级均使用偏二甲肼(UDMH)-四氧化二氮(NTO)推进剂,反应产物绿色无污染。回答下列问题:
(1)已知(CH3)2NNH2(l)+4O2(g)= 2CO2(g)+4H2O(g)+N2(g) △H=a kJ/mol
N2(g)+O2(g)= 2NO(g) △H=b kJ/mol
2NO(g)+O2(g)= N2O4(l) △H=c kJ/mol
则UDMH-NTO推进剂反应的热化学方程式为________________________ 。
(2)偏二甲肼易溶于水,其一水合物的电离方式与一水合氨(Kb=1.7×10-5)相似但电离常数更小,偏二甲肼一水合物的电离方程式为___________________ ,向偏二甲肼溶液中加入等物质的量的醋酸(Ka=-1.7×10-5),充分反应后溶液呈______ (填“酸性”“碱性”或“中性”)。碱性偏二甲肼—空气燃料电池的电解质溶液是20~30%的KOH溶液,电池工作时正极的电极反应式为__________________________ 。
(3)N2O4是NO2的二聚产物,NO、NO2等氮氧化物是主要的大气污染物,氮氧化物与悬浮在大气中的微粒相互作用时,涉及如下反应:
(I)2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H1<0 K1
NaNO3(s)+ClNO(g) △H1<0 K1
(II)2NO(g)+Cl2(g) 2ClNO(g) △H2<0 K2
2ClNO(g) △H2<0 K2
则4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+C12(g)的平衡常数为
2NaNO3(s)+2NO(g)+C12(g)的平衡常数为_______ (用K1、K2表示);为研究不同条件对反应(Ⅱ)的影响,T℃时,向2L恒容密闭容器中加入0.2mol NO和0.2mol C12,5min时达到平衡,反应过程中容器内的压强减小了10%,则5min内反应的平均速率v(C1NO)=_____ mol/(L·min),NO的平衡转化率α1=_____ %;若其他条件保持不变,使反应(Ⅱ)在初始容积为2L的恒压密闭容器中进行,则NO的平衡转化率α2_______ α1(填“>”“<”或“=”)。
(1)已知(CH3)2NNH2(l)+4O2(g)= 2CO2(g)+4H2O(g)+N2(g) △H=a kJ/mol
N2(g)+O2(g)= 2NO(g) △H=b kJ/mol
2NO(g)+O2(g)= N2O4(l) △H=c kJ/mol
则UDMH-NTO推进剂反应的热化学方程式为
(2)偏二甲肼易溶于水,其一水合物的电离方式与一水合氨(Kb=1.7×10-5)相似但电离常数更小,偏二甲肼一水合物的电离方程式为
(3)N2O4是NO2的二聚产物,NO、NO2等氮氧化物是主要的大气污染物,氮氧化物与悬浮在大气中的微粒相互作用时,涉及如下反应:
(I)2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) △H1<0 K1
NaNO3(s)+ClNO(g) △H1<0 K1(II)2NO(g)+Cl2(g)
 2ClNO(g) △H2<0 K2
2ClNO(g) △H2<0 K2则4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+C12(g)的平衡常数为
2NaNO3(s)+2NO(g)+C12(g)的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性。都有着广泛的用途。已知反应N2H4(g)+2Cl2(g) N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
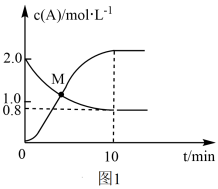
①0~10min内,用N2(g)表示的平均反应速率v(N2)=__ 。
②M点时,N2H4的转化率为__ (精确到0.1)%。
③已知次磷酸钠(NaH2PO2)为正盐,则次磷酸(H3PO2)是__ 元酸。
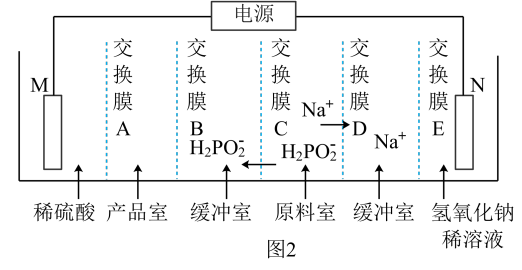
④用次磷酸钠(NaH2PO2)通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于__ (填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为__ ,当电路中流过3.8528×105库仑电量时。制得次磷酸的物质的量为__ (一个电子的电量为1.6×10-19库仑,NA数值约为6.02×1023)。
 N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
①0~10min内,用N2(g)表示的平均反应速率v(N2)=
②M点时,N2H4的转化率为
③已知次磷酸钠(NaH2PO2)为正盐,则次磷酸(H3PO2)是
④用次磷酸钠(NaH2PO2)通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于

您最近一年使用:0次



