TiO2和TiCl4均为重要的工业原料。已知:

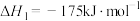 Ⅰ
Ⅰ
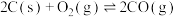
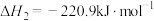 Ⅱ
Ⅱ
请回答下列问题:
(1)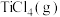 与
与 反应生成
反应生成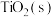 、
、 和氯气的热化学方程式为
和氯气的热化学方程式为___________ ;升高温度对该反应的影响为___________ 。
(2)若反应Ⅱ的逆反应的活化能为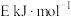 ,则E
,则E___________ (填“>”“<”或“=”)220.9。
(3)t℃时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和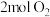 ,发生反应Ⅰ。
,发生反应Ⅰ。 时达到平衡,测得
时达到平衡,测得 的物质的量为
的物质的量为 。
。
①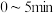 内,用
内,用 表示的反应速率
表示的反应速率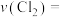
___________ 。
② 的平衡转化率为
的平衡转化率为___________ 。
③该反应的平衡常数为___________ (用分数表示)。
④下列措施,既能加快逆反应速率又能增大 平衡转化率的是
平衡转化率的是___________ (填字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分 D.增大
D.增大 浓度
浓度
(4)实验室各种浓度的硫酸是由浓硫酸稀释而得,
①以下配制过程中各操作的先后顺序是___________ 。
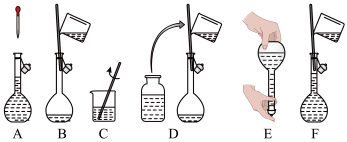
②下列情况会使配制结果偏大的是___________ 。
a.溶解后未冷却即转移、定容
b.定容时仰视容量瓶刻度线
c.用量筒量取一定体积的浓硫酸时俯视
d.将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶

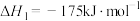 Ⅰ
Ⅰ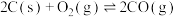
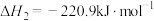 Ⅱ
Ⅱ请回答下列问题:
(1)
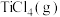 与
与 反应生成
反应生成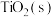 、
、 和氯气的热化学方程式为
和氯气的热化学方程式为(2)若反应Ⅱ的逆反应的活化能为
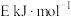 ,则E
,则E(3)t℃时,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和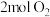 ,发生反应Ⅰ。
,发生反应Ⅰ。 时达到平衡,测得
时达到平衡,测得 的物质的量为
的物质的量为 。
。①
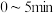 内,用
内,用 表示的反应速率
表示的反应速率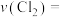
②
 的平衡转化率为
的平衡转化率为③该反应的平衡常数为
④下列措施,既能加快逆反应速率又能增大
 平衡转化率的是
平衡转化率的是A.缩小容器容积 B.加入催化剂 C.分离出部分
 D.增大
D.增大 浓度
浓度(4)实验室各种浓度的硫酸是由浓硫酸稀释而得,
①以下配制过程中各操作的先后顺序是

②下列情况会使配制结果偏大的是
a.溶解后未冷却即转移、定容
b.定容时仰视容量瓶刻度线
c.用量筒量取一定体积的浓硫酸时俯视
d.将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
更新时间:2024-03-16 21:17:18
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】为了实现“将全球温度上升幅度控制在2℃以内”的目标,科学家正在研究温室气体CO2的转化和利用。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和_________ (填离子符号)。
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为__________________ 。

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g) CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
3FeO(s)+H2O(g) Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
则6FeO(s)+CO2(g) 2Fe3O4(s)+C(s) △H=
2Fe3O4(s)+C(s) △H=_____ kJ·mol-1。
(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。

①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)_______ (填“>”“ <”或“=”)v逆(CO2)。
②0~3min内,氢气的平均反应速率v(H2)_______________ 。
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g) CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________ 。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)O。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g)
 CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1 3FeO(s)+H2O(g)
 Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1则6FeO(s)+CO2(g)
 2Fe3O4(s)+C(s) △H=
2Fe3O4(s)+C(s) △H=(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)
②0~3min内,氢气的平均反应速率v(H2)
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g)
 CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】从衣食住行到探索浩瀚宇宙,都有氮及其化合物的参与,但同时有毒含氮化合物的排放,也对环境产生污染。如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。
(1)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
①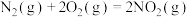 △H1
△H1
② △H2
△H2
③ △H3
△H3
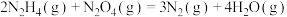 的反应热△H=
的反应热△H=______ (写出表达式)。
(2) N2H4的水溶液呈弱碱性,室温下其电离常数 ,则0.01 mol∙L-1的N2H4水溶液pH等于
,则0.01 mol∙L-1的N2H4水溶液pH等于______ (忽略N2H4的二级电离和H2O的电离,lg4=0.6)。
(3)利用测压法在刚性密闭容器中研究T1℃时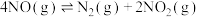 (△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
(△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
①0~20 min时,v(NO2)=______ MPa∙min-1。
②T1℃时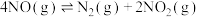 反应的平衡常数Kx=
反应的平衡常数Kx=______ (Kx为以物质的量分数表示的平衡常数)。若升高温度,N2的物质的量分数将______ (填“增大”“减小”或“不变”)。
(4)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应 △H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
△H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
①________________________________________________ ;
②________________________________________________ 。

(1)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备火箭燃料肼(N2H4)。
①
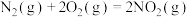 △H1
△H1②
 △H2
△H2③
 △H3
△H3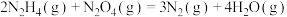 的反应热△H=
的反应热△H=(2) N2H4的水溶液呈弱碱性,室温下其电离常数
 ,则0.01 mol∙L-1的N2H4水溶液pH等于
,则0.01 mol∙L-1的N2H4水溶液pH等于(3)利用测压法在刚性密闭容器中研究T1℃时
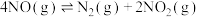 (△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
(△H<0)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| 压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
②T1℃时
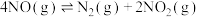 反应的平衡常数Kx=
反应的平衡常数Kx=(4)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应
 △H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):
△H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因是(答2条):①
②

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】世界能源消费的90%以上依靠化学技术。请回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+ O2(g)=CO(g)ΔH1=-110.35kJ·mol-1
O2(g)=CO(g)ΔH1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l)ΔH2=-571.6kJ·mol-1
H2O(l)=H2O(g)ΔH3=+44.0kJ·mol-1
①则反应C(s)+H2O(g) CO(g)+H2(g) ΔH4=
CO(g)+H2(g) ΔH4=__________ 。
②某实验小组在实验室模拟反应C(s)+H2O(g)CO(g)+H2(g),其平衡常数表达式为K=_______ 。一定温度下,在2L盛有足量炭粉的恒容密闭容器(固体所占体积忽略不计)中通入0.8molH2O,6min时生成0.7gH2,则6min内以CO表示的平均反应速率为________ (保留3位有效数字)。
(2)燃料气(流速为1800mL·min-1;体积分数为50%H2,0.98%CO,1.64%O2,47.38%N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。
①160℃、CuO/CeO2作催化剂时,CO优先氧化的化学方程式为__________ 。
②CeO2可由草酸铈[Ce2(C2O4)3]隔绝空气灼烧制得,同时生成两种气体,则发生反应的化学方程式为____________ 。
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
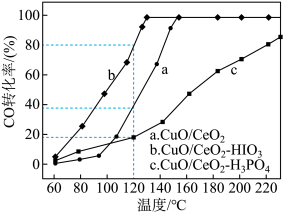
加入________ (填酸的化学式)的CuO/CeO2催化剂催化性能最好。温度为120℃,催化剂为CuO/CeO2HIO3时,反应0.5h后CO的体积为______ mL。
(3)LiOH是制备锂离子电池正极材料的重要原料,采用惰性电极电解制备LiOH的装置如下图所示。
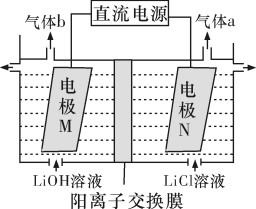
①通电后,Li+通过阳离子交换膜向________ (填“M”或“N”)极区迁移。
②电极N产生的气体a通入淀粉-KI溶液,溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出电极N的电极反应式:___________ ;蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:_______ 。
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+
 O2(g)=CO(g)ΔH1=-110.35kJ·mol-1
O2(g)=CO(g)ΔH1=-110.35kJ·mol-12H2(g)+O2(g)=2H2O(l)ΔH2=-571.6kJ·mol-1
H2O(l)=H2O(g)ΔH3=+44.0kJ·mol-1
①则反应C(s)+H2O(g)
 CO(g)+H2(g) ΔH4=
CO(g)+H2(g) ΔH4=②某实验小组在实验室模拟反应C(s)+H2O(g)CO(g)+H2(g),其平衡常数表达式为K=
(2)燃料气(流速为1800mL·min-1;体积分数为50%H2,0.98%CO,1.64%O2,47.38%N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。
①160℃、CuO/CeO2作催化剂时,CO优先氧化的化学方程式为
②CeO2可由草酸铈[Ce2(C2O4)3]隔绝空气灼烧制得,同时生成两种气体,则发生反应的化学方程式为
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。

加入
(3)LiOH是制备锂离子电池正极材料的重要原料,采用惰性电极电解制备LiOH的装置如下图所示。

①通电后,Li+通过阳离子交换膜向
②电极N产生的气体a通入淀粉-KI溶液,溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出电极N的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】I.载人航天器中,可通过如下反应将航天员呼出的CO2转化为H2O,再通过电解H2O获得O2。
(1)已知:①CO2(g)+ 4H2(g)=CH4(g) +2H2O(l) ΔH= -252. 9 kJ/mol
②2H2O(l)=2H2(g)+O2(g) ΔH =+571.6 kJ/mol
则CH4(g)和O2(g)反应生成CO2(g)和H2O(l)的热化学方程式为_______ 。
II.在一定体积的恒容密闭容器中,进行如下化学反应:CO2(g)+ H2(g)⇌CO(g)+H2O(g) ΔH,其化学平衡常数 K和温度T的关系如下表:
请回答下列问题:
(2)该反应的平衡常数表达式为_______ ,该反应的ΔH_______ 0(填“>”或“<”)。
(3)能判断该反应是否已达到化学平衡状态的依据是_______ (填字母)。
A.混合气体中c(CO2 )保持不变
B.混合气体的密度不变
C.容器中压强不变,
D.容器中CO2、H2、CO、H2O的浓度之比为1:1:1:1
E.生成2 mol H-O键的同时生成1 mol H- H键
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_______ (填字母)。
a.增大CO2的浓度 b.及时分离出CO c.升高温度 d.增大压强 e.选择高效的催化剂
(5)某温度下,在2 L的密闭容器中,加入2 molCO2和2 mol H2充分反应达到平衡时,H2平衡浓度为0.5mol/L,试通过计算判断此时的温度为_______ ℃。
(6)在800℃时,向2 L的密闭容器中,充入2 mol CO2、2 mol H2和2 mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是_______(填字母)。
(1)已知:①CO2(g)+ 4H2(g)=CH4(g) +2H2O(l) ΔH= -252. 9 kJ/mol
②2H2O(l)=2H2(g)+O2(g) ΔH =+571.6 kJ/mol
则CH4(g)和O2(g)反应生成CO2(g)和H2O(l)的热化学方程式为
II.在一定体积的恒容密闭容器中,进行如下化学反应:CO2(g)+ H2(g)⇌CO(g)+H2O(g) ΔH,其化学平衡常数 K和温度T的关系如下表:
| T/℃ | 700 | 750 | 800 | 900 | 1100 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(2)该反应的平衡常数表达式为
(3)能判断该反应是否已达到化学平衡状态的依据是
A.混合气体中c(CO2 )保持不变
B.混合气体的密度不变
C.容器中压强不变,
D.容器中CO2、H2、CO、H2O的浓度之比为1:1:1:1
E.生成2 mol H-O键的同时生成1 mol H- H键
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.增大CO2的浓度 b.及时分离出CO c.升高温度 d.增大压强 e.选择高效的催化剂
(5)某温度下,在2 L的密闭容器中,加入2 molCO2和2 mol H2充分反应达到平衡时,H2平衡浓度为0.5mol/L,试通过计算判断此时的温度为
(6)在800℃时,向2 L的密闭容器中,充入2 mol CO2、2 mol H2和2 mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是_______(填字母)。
| A.16. 67% | B.22.2% | C.33. 3% | D.36.8% |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.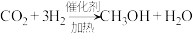
已知: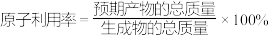
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
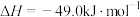 。回答下列问题:
。回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成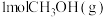 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)_______ Ea(逆)(填“>”、“=”或“<”)
(3)利用CO高温时与磷石膏(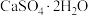 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ (填化学式)。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: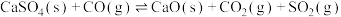 。该反应达到平衡时,
。该反应达到平衡时,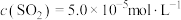 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时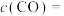
_______ mol/L,该反应的压强平衡常数
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
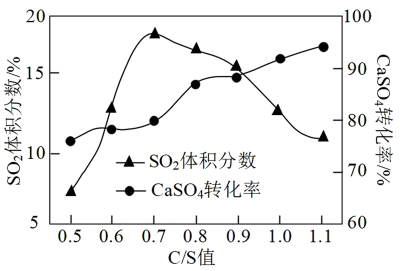
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。
 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.
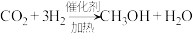
已知:
以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
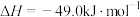 。回答下列问题:
。回答下列问题:①能说明该反应已达平衡状态的是
A.单位时间内生成
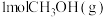 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)
(3)利用CO高温时与磷石膏(
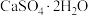 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: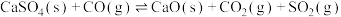 。该反应达到平衡时,
。该反应达到平衡时,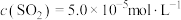 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时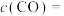

(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
【推荐3】重铬酸钾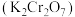 具有强氧化性,在实验室和工业中都有广泛的应用。
具有强氧化性,在实验室和工业中都有广泛的应用。 (黄色)和
(黄色)和 (橙色)在溶液中可相互转化。
(橙色)在溶液中可相互转化。
(1) 中元素铬(Cr)的化合价为
中元素铬(Cr)的化合价为_______ 。
(2)室温下,初始浓度为 的
的 溶液中
溶液中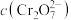 随
随 的变化如图所示。(忽略溶液体积变化)
的变化如图所示。(忽略溶液体积变化)

①用离子方程式表示 溶液中的转化反应
溶液中的转化反应_______ 。
②计算B点时 的转化率为
的转化率为_______ 。
③根据A点数据,计算上述反应的平衡常数_______ 。
(3)向橙色的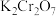 溶液中,滴加
溶液中,滴加 溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_______ ,用平衡移动的原理解释溶液pH变小的原因是_______ 。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定二价铁含量。
用 溶液滴定20.00mL未知浓度的含
溶液滴定20.00mL未知浓度的含 的溶液,恰好完全反应时消耗
的溶液,恰好完全反应时消耗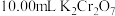 溶液,则溶液中
溶液,则溶液中 的物质的量浓度是
的物质的量浓度是_______ (已知: (未配平)。
(未配平)。
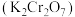 具有强氧化性,在实验室和工业中都有广泛的应用。
具有强氧化性,在实验室和工业中都有广泛的应用。 (黄色)和
(黄色)和 (橙色)在溶液中可相互转化。
(橙色)在溶液中可相互转化。(1)
 中元素铬(Cr)的化合价为
中元素铬(Cr)的化合价为(2)室温下,初始浓度为
 的
的 溶液中
溶液中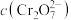 随
随 的变化如图所示。(忽略溶液体积变化)
的变化如图所示。(忽略溶液体积变化)
①用离子方程式表示
 溶液中的转化反应
溶液中的转化反应②计算B点时
 的转化率为
的转化率为③根据A点数据,计算上述反应的平衡常数
(3)向橙色的
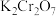 溶液中,滴加
溶液中,滴加 溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是(4)用重铬酸钾法(一种氧化还原滴定法)可测定二价铁含量。
用
 溶液滴定20.00mL未知浓度的含
溶液滴定20.00mL未知浓度的含 的溶液,恰好完全反应时消耗
的溶液,恰好完全反应时消耗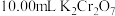 溶液,则溶液中
溶液,则溶液中 的物质的量浓度是
的物质的量浓度是 (未配平)。
(未配平)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为
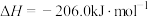 。
。
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应: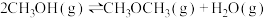
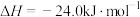
(1)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率___________ 。
(2)请写出甲醇合成反应的热化学方程式;___________ 。
(3)生产甲醚的过程中还存在以下副反应,与甲醇脱水反应形成竞争: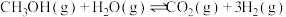
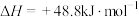 ,将反应物混合气按进料比
,将反应物混合气按进料比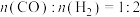 通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。

资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
①图1中,温度一定,压强增大,甲醚选择性增大的原因是___________ 。
②图2中,温度高于265℃后,甲醚选择性降低的原因是___________ 。

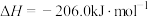 。
。该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:
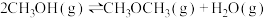
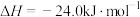
(1)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率
(2)请写出甲醇合成反应的热化学方程式;
(3)生产甲醚的过程中还存在以下副反应,与甲醇脱水反应形成竞争:
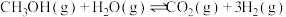
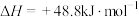 ,将反应物混合气按进料比
,将反应物混合气按进料比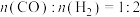 通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
①图1中,温度一定,压强增大,甲醚选择性增大的原因是
②图2中,温度高于265℃后,甲醚选择性降低的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为___ 。
(2)已知反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为___ kJ。
(3)一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
①在0~20min时段,反应速率v(N2O)为___ mol·(L·min)-1。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=___ 。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___ (填“>”“=”或“<”)T2。当温度为T1、起始压强为p0时,反应至t1min时,体系压强p=___ (用p0表示)。

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)=2I(g)(快反应)
第二步 I(g)+N2O(g) N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步 IO(g)+N2O(g) N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___ (填标号)。
A.温度升高,k值增大
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2的浓度与N2O分解速率无关
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为
(2)已知反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为
(3)一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol·L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)=2I(g)(快反应)
第二步 I(g)+N2O(g)
 N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)第三步 IO(g)+N2O(g)
 N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是
A.温度升高,k值增大
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2的浓度与N2O分解速率无关
您最近一年使用:0次
【推荐3】氮的氧化物在生产、生活中有广泛应用。
Ⅰ.已知汽车气缸中氮及其化合物发生如下反应:
 (常温下平衡常数为K1)
(常温下平衡常数为K1)
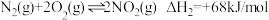 (常温下平衡常数为K2)
(常温下平衡常数为K2)
(1)则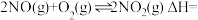
_______  ;常温下平衡常数K=
;常温下平衡常数K=_______ (用K1、K2来表示)
Ⅱ.四氧化二氮(N2O4)可作为运载火箭的推进剂,将4 mol N2O4放入2 L恒容密闭容器中发生反应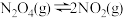 ,平衡体系中N2O4的体积分数(
,平衡体系中N2O4的体积分数( )随温度的变化如图所示:
)随温度的变化如图所示:
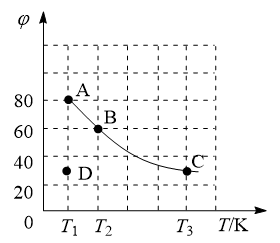
(2)D点v(正)_______ v(逆)(填“>”“=”或“<”)。
(3)A、B、C点中平衡常数K的值最大的是_______ 点。T2时,N2O4的平衡转化率为_______ ;若达平衡时间为5 s,则此时间内的N2O4平均反应速率为_______ 。
(4)若其条件不变,在 原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数
原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数_______ (填“增大”“不变”或“减小”)。
Ⅲ.碳的很多化合物在生产、生活中有广泛应用,对其进行综合利用是目前研究的热点之一。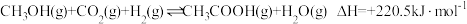 ;中科院化学所研究了该反应的反应历程,如图所示:
;中科院化学所研究了该反应的反应历程,如图所示:
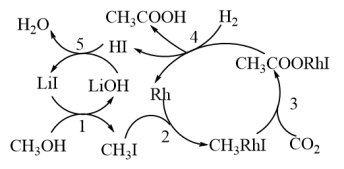
(5)反应历程中,能降低反应活化能的物质有_______ (填化学式);中间产物有_______ 种。
(6)第4步反应的化学方程式为_______ 。
Ⅰ.已知汽车气缸中氮及其化合物发生如下反应:
 (常温下平衡常数为K1)
(常温下平衡常数为K1)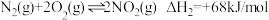 (常温下平衡常数为K2)
(常温下平衡常数为K2)(1)则
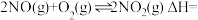
 ;常温下平衡常数K=
;常温下平衡常数K=Ⅱ.四氧化二氮(N2O4)可作为运载火箭的推进剂,将4 mol N2O4放入2 L恒容密闭容器中发生反应
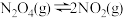 ,平衡体系中N2O4的体积分数(
,平衡体系中N2O4的体积分数( )随温度的变化如图所示:
)随温度的变化如图所示:
(2)D点v(正)
(3)A、B、C点中平衡常数K的值最大的是
(4)若其条件不变,在
 原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数
原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数Ⅲ.碳的很多化合物在生产、生活中有广泛应用,对其进行综合利用是目前研究的热点之一。
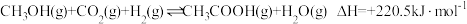 ;中科院化学所研究了该反应的反应历程,如图所示:
;中科院化学所研究了该反应的反应历程,如图所示:
(5)反应历程中,能降低反应活化能的物质有
(6)第4步反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
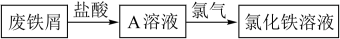
【推荐1】某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液。实验操作过程如下:
根据要求回答问题:
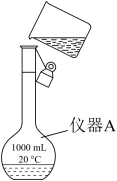
(1)用浓盐酸配制250mL 0.2mol•L-1稀盐酸,右图是某同学转移溶液的示意图,写出仪器 A的名称:___________________ 。
(2)图中有两处错误分别是_____________ ,______________ 。
(3)废铁屑用盐酸处理后,还含有不溶性杂质,为获取澄清的A溶液,进行物质分离的操作名称是___________ 。


根据要求回答问题:
(1)用浓盐酸配制250mL 0.2mol•L-1稀盐酸,右图是某同学转移溶液的示意图,写出仪器 A的名称:
(2)图中有两处错误分别是
(3)废铁屑用盐酸处理后,还含有不溶性杂质,为获取澄清的A溶液,进行物质分离的操作名称是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】(1)实验室用氢氧化钠晶体,配制100mL 0.1mol/L的氢氧化钠溶液,正确的操作顺序是:_______ (填序号①②…)。
①计算所用氢氧化钠晶体的质量。
②将称好的氢氧化钠晶体放在小烧杯中,加30mL水搅拌溶解,并冷却至室温
③用天平称取所需氢氧化钠晶体
④将溶液转入容量瓶中
⑤改用胶头滴管小心加水至刻度
⑥继续向容量瓶中加水至页面接近刻度线2-3厘米处
⑦用蒸馏水洗涤烧杯2-3次,洗涤液全部转入容量瓶中
⑧盖上瓶塞,振荡摇匀。
(2)在配制一定物质的量浓度的氢氧化钠溶液时,若称取的固体氢氧化钠潮解,则溶液的浓度___ ;若烧杯没有洗涤,则溶液的浓度___ ;若转移溶液时,有部分溶液溅出,则溶液的浓度____ ;定容时若俯视刻度线,则溶液的浓度____ 。(填“偏大”、“偏小”、“不变”)
①计算所用氢氧化钠晶体的质量。
②将称好的氢氧化钠晶体放在小烧杯中,加30mL水搅拌溶解,并冷却至室温
③用天平称取所需氢氧化钠晶体
④将溶液转入容量瓶中
⑤改用胶头滴管小心加水至刻度
⑥继续向容量瓶中加水至页面接近刻度线2-3厘米处
⑦用蒸馏水洗涤烧杯2-3次,洗涤液全部转入容量瓶中
⑧盖上瓶塞,振荡摇匀。
(2)在配制一定物质的量浓度的氢氧化钠溶液时,若称取的固体氢氧化钠潮解,则溶液的浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】二氧化氯消毒剂是国际公认的高效消毒灭菌剂。二氧化氯漂白液中常含有ClO2和Cl2两种主要成分。化学兴趣小组同学为测定某二氧化氯漂白液中ClO2的浓度,进行如下实验:
【实验Ⅰ】需要480 mL 0.10 mol/L的Na2S2O3溶液,步骤如下:
① 用天平准确称取一定质量的Na2S2O3·5H2O固体,放入烧杯,用适量蒸馏水溶解;
② 将烧杯中的溶液小心的注入容量瓶中;
③ 用蒸馏水洗涤烧杯内壁和玻璃棒_______,并将每次洗涤的溶液转入容量瓶中,振荡;
④ 继续向容量瓶中加水至距刻度线_______处,改用胶头滴管加水至刻度线;
⑤ 将容量瓶塞盖好,充分摇匀。
回答下列问题:
(1)将【实验Ⅰ】③、④步补充完整_______ ,_______ ;
(2)需要的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、_______ ;
(3)配制溶液过程中需称量Na2S2O3·5H2O固体的质量为_______ ;
(4)配制溶液过程中,下列操作对最终结果的影响是: (填“偏高”、“偏低”或“无影响”)
i、若未进行步骤③操作,则配制的溶液浓度_______ ;
ii、定容时仰视刻度,则配制的溶液浓度_______ ;
iii、配制前容量瓶用蒸馏水洗涤,则配制的溶液浓度_______ ;
【实验Ⅱ】测定二氧化氯漂白液中ClO2浓度,步骤如下:
①量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再向其中加入过量KI溶液,二氧化氯漂白液中的两种成分分别发生反应:2ClO2+2KI=2KClO2+I2、Cl2+2KI=2KCl+I2。
②加入淀粉作指示剂(指示剂的作用是通过颜色变化,可以提示Na2S2O3与I2反应完全),向其中逐滴加入0.10 mol/L的Na2S2O3溶液至反应恰好完全进行,过程中发生的反应为:2Na2S2O3+I2=Na2S4O6+2NaI
③加入稀硫酸调节溶液pH=3,发生反应:KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O
④再逐滴加入0.10 mol/L的Na2S2O3溶液,反应恰好完全进行时,该步消耗Na2S2O3溶液20mL。回答下列问题:
(5)该二氧化氯漂白液中ClO2的物质的量浓度为_______ 。(请写出计算过程,没有过程不得分)
【实验Ⅰ】需要480 mL 0.10 mol/L的Na2S2O3溶液,步骤如下:
① 用天平准确称取一定质量的Na2S2O3·5H2O固体,放入烧杯,用适量蒸馏水溶解;
② 将烧杯中的溶液小心的注入容量瓶中;
③ 用蒸馏水洗涤烧杯内壁和玻璃棒_______,并将每次洗涤的溶液转入容量瓶中,振荡;
④ 继续向容量瓶中加水至距刻度线_______处,改用胶头滴管加水至刻度线;
⑤ 将容量瓶塞盖好,充分摇匀。
回答下列问题:
(1)将【实验Ⅰ】③、④步补充完整
(2)需要的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
(3)配制溶液过程中需称量Na2S2O3·5H2O固体的质量为
(4)配制溶液过程中,下列操作对最终结果的影响是: (填“偏高”、“偏低”或“无影响”)
i、若未进行步骤③操作,则配制的溶液浓度
ii、定容时仰视刻度,则配制的溶液浓度
iii、配制前容量瓶用蒸馏水洗涤,则配制的溶液浓度
【实验Ⅱ】测定二氧化氯漂白液中ClO2浓度,步骤如下:
①量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再向其中加入过量KI溶液,二氧化氯漂白液中的两种成分分别发生反应:2ClO2+2KI=2KClO2+I2、Cl2+2KI=2KCl+I2。
②加入淀粉作指示剂(指示剂的作用是通过颜色变化,可以提示Na2S2O3与I2反应完全),向其中逐滴加入0.10 mol/L的Na2S2O3溶液至反应恰好完全进行,过程中发生的反应为:2Na2S2O3+I2=Na2S4O6+2NaI
③加入稀硫酸调节溶液pH=3,发生反应:KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O
④再逐滴加入0.10 mol/L的Na2S2O3溶液,反应恰好完全进行时,该步消耗Na2S2O3溶液20mL。回答下列问题:
(5)该二氧化氯漂白液中ClO2的物质的量浓度为
您最近一年使用:0次



