氧泡泡是一种多功能新型漂白剂,其有效成分是过碳酸钠(xNa2CO3•yH2O2)。
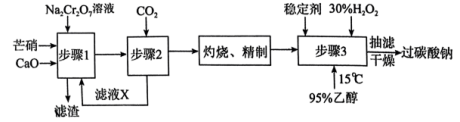
I.以芒硝(Na2SO4•10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如图:
Ⅱ.测定过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①用电子天平称取两份质量均为mg的样品。
②将一份置于锥形瓶中,加水溶解,加催化剂使H2O2充分快速分解(催化剂不参与其它反应),然后加酚酞作指示剂,用0.0500mol•L-1H2SO4溶液滴定至终点,消耗硫酸V1mL。
③将另一份置于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2.0mol•L-1H3PO4溶液,再加入过量KI固体,摇匀后于暗处放置10min,加入适量指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
过碳酸钠制备的流程中,下列说法错误的是
I.以芒硝(Na2SO4•10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如图:

Ⅱ.测定过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
①用电子天平称取两份质量均为mg的样品。
②将一份置于锥形瓶中,加水溶解,加催化剂使H2O2充分快速分解(催化剂不参与其它反应),然后加酚酞作指示剂,用0.0500mol•L-1H2SO4溶液滴定至终点,消耗硫酸V1mL。
③将另一份置于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2.0mol•L-1H3PO4溶液,再加入过量KI固体,摇匀后于暗处放置10min,加入适量指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V2mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
过碳酸钠制备的流程中,下列说法错误的是
| A.步骤1中2mol芒硝参与反应时,消耗1molNa2Cr2O7 |
| B.滤渣的主要成分为CaSO4 |
C.步骤2的方程式为2Na2CrO4+2CO2+H2O Na2Cr2O7+2NaHCO3↓ Na2Cr2O7+2NaHCO3↓ |
| D.稳定剂的作用是阻止微量杂质金属离子的催化作用,减少双氧水的分解 |
更新时间:2024-03-23 07:00:16
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
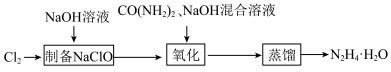
【推荐1】水合肼(N2H4·H2O)是一种重要的化工原料,其沸点约为118℃,具有强还原性。实验室制备水合肼的流程如图所示。
下列说法正确的是

下列说法正确的是
| A.“制备NaClO”过程中每消耗标准状况下2.24LCl2,转移0.2mol电子 |
| B.“氧化”步骤中发生反应的离子方程式为ClO-+CO(NH2)2+H2O=Cl-+CO2↑+N2H4·H2O |
| C.“氧化”时,应将CO(NH2)2和NaOH的混合溶液缓慢滴加到NaClO稀溶液中 |
| D.Cl2与热的NaOH溶液反应会生成NaClO3,所以制备NaClO应在冷水浴中进行 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】利用含硫物质热化学循环实现太阳能的转化与存储的过程如下图所示。下列说法中,不正确 的是
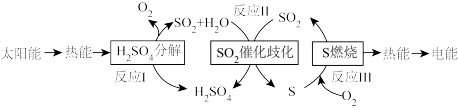

| A.实现了将太阳能转化为电能 |
| B.反应Ⅰ为放热反应 |
C.反应Ⅱ的化学方程式为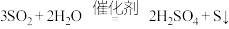 |
D. 可循环使用 可循环使用 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】二氯化二硫(S2C12)是一种黄红色液体,沸点为137℃ ,在空气中剧烈水解而发烟,实验室可用S与Cl2在120℃下反应制得,实验时使用的部分装置如图所示。下列说法正确的是
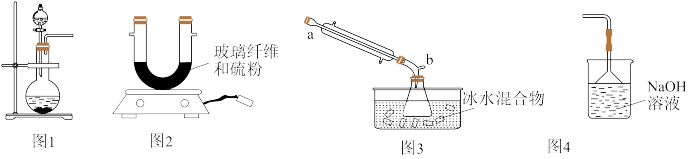

| A.图1中进行的是 MnO2和0.1mol·L-1盐酸反应制取 C12 |
| B.图2中S与 Cl2反应生成S2Cl2,S作氧化剂 |
| C.图3的锥形瓶中能收集到少量黄红色液体 |
| D.图4的玻璃导管与图3的b接口直接相连,用于吸收多余的 C12 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】硫酸亚铁是一种重要的化工原料,可以制备多种物质。有关下列制备方法错误的是
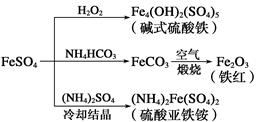

| A.制备碱式硫酸铁利用了过氧化氢的氧化性 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】以下工业流程制备无机功能材料MnO2,粗MnO2的提纯是工业生产的重要环节,某研究性学习小组设计了将相MnO2 (含有较多MnO和MnCO3)样品转化为纯MnO2实验。以下工业流程制备无机功能材料MnO2,粗MnO2的提纯是工业生产的重要环节,某研究性学习小组设计了将相MnO2 (含有较多MnO和MnCO3)样品转化为纯MnO2实验。
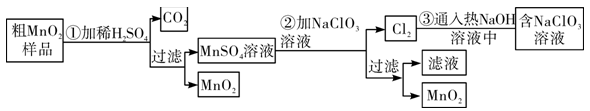
针对上述工业流程,下列选项错误的是

针对上述工业流程,下列选项错误的是
| A.第①步加稀H2SO4时,粗MnO2样品中的MnO和MnCO3转化为可溶性物质 |
| B.不考虑操作过程中的损失,本流程中的NaClO3固体能全部循环,不需额外补充 |
C.第②步反应的离子方程式5Mn2++2 +4H2O=5MnO2↓+Cl2↑+8H+ +4H2O=5MnO2↓+Cl2↑+8H+ |
| D.实验室模拟上述工业流程中得到MnO2固体的操作必须用到的玻璃仪器有玻璃棒、烧杯、 漏斗 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】用含铁废铜制备胆矾的流程如图所示:
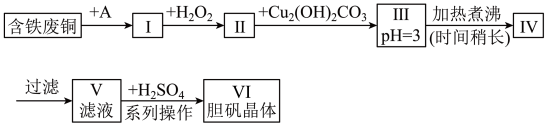
下列说法错误的是

下列说法错误的是
| A.物质A可选用盐酸 |
B.Ⅰ中加 的目的是溶解铜并将 的目的是溶解铜并将 氧化 氧化 |
C.长时间加热煮沸Ⅲ中悬浊液的目的是充分聚沉 |
| D.“系列操作”包括蒸发浓缩,冷却结晶,过滤,洗涤 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)


| 选项 | A | B | C | D |
| X中试剂 | 浓盐酸 | 双氧水 | 浓硫酸 | 浓氨水 |
| Y中试剂 |  |  | Cu | NaOH |
| 气体 |  |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列物质在给定条件下的转化不能一步实现的是
A.Fe2O3 Fe Fe FeCl2 FeCl2 | B.H2O2 O2 O2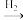 H2O H2O |
C.CaCl2溶液 CaCO3 CaCO3 CO2 CO2 | D.CuSO4溶液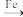 Cu Cu CuO CuO |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
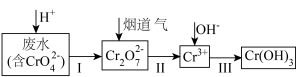
【推荐1】以下是工业上利用烟道气中的二氧化硫处理含铬(Ⅵ)废水的工艺流程: 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法不正确 的是
 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法A. 转化过程中,溶液颜色由黄色变为橙色 转化过程中,溶液颜色由黄色变为橙色 |
B.过程Ⅱ中 是还原剂, 是还原剂, 为还原产物 为还原产物 |
C.处理废水中的 (不考虑其它氧化剂存在),转移电子数为 (不考虑其它氧化剂存在),转移电子数为 |
D.烟道气可以用 或 或 代替 代替 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】NA为阿伏加德罗常数的值。下列说法正确的是
A.18g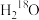 含有的中子数为10NA 含有的中子数为10NA |
B.11.2LCH4和22.4LCl2(均为标准状况 在光照下充分反应后的分子数为1.5NA 在光照下充分反应后的分子数为1.5NA |
| C.2molNO与1molO2在密闭容器中充分反应后的分子数为2NA |
D.1L0.2 mol∙L-1K2CrO4溶液中加入足量稀硫酸,生成的 数目为0.1NA 数目为0.1NA |
您最近一年使用:0次

 +2H+ =H2SiO3↓
+2H+ =H2SiO3↓ +4
+4
 + H2O
+ H2O 、
、 为气流控制开关)。
为气流控制开关)。

 气体有毒,遇水发生水解产生两种酸性气体。下列说法正确的是
气体有毒,遇水发生水解产生两种酸性气体。下列说法正确的是
 ,且目的相同
,且目的相同

