前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子简化电子排布式为___________ ;F元素价层电子轨道表示式为___________ ;
(2)A、B、C、D四种元素第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3)B、C、D三种元素的简单离子的半径由大到小顺序为___________ (用离子符号表示)。
(4)元素B的简单气态氢化物的沸点___________ (填“高于”或“低于”)元素D的简单气态氢化物的沸点;
(5)元素A的简单气态氢化物分子的空间结构为___________ ,分子中A原子的杂化类型为___________ 。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子价电子排布式为 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态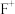 各能级电子全充满 各能级电子全充满 |
(1)E元素基态原子简化电子排布式为
(2)A、B、C、D四种元素第一电离能由大到小的顺序为
(3)B、C、D三种元素的简单离子的半径由大到小顺序为
(4)元素B的简单气态氢化物的沸点
(5)元素A的简单气态氢化物分子的空间结构为
更新时间:2024-03-23 14:49:59
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】性质比较:
(1)半径比较Al___________ S、Al3+___________ S2-(填“大于”、“等于”或“小于”,下同)
(2)第一电离能比较Mg___________ Al,解释原因___________
(3)稳定性比较NH3、H2O、HF,___________ ,解释原因___________
(4)酸性强弱比较HClO4、HClO3___________ ,解释原因___________
(1)半径比较Al
(2)第一电离能比较Mg
(3)稳定性比较NH3、H2O、HF,
(4)酸性强弱比较HClO4、HClO3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】如图是元素周期表的一部分,其中所列的字母分别代表某一化学元素。
(1)硒是人体的微量元素之一,可保护细胞组织,请在周期表中标出元素符号_______ 。
(2)比较元素c、d、e、f的离子半径,由大到小的顺序是_______ (填离子符号)。
(3)根据核外电子的排布分区,字母g属于_______ 区元素,该区的价层电子通式为_______ 。
(4)位于金属元素与非金属元素分界线上的元素常被称为半金属或类金属,其单质及化合物有一定特殊性,如ef3为_______ (填“离子化合物”或“共价化合物”),元素e的最高价氧化物对应的水化物与强碱反应的离子方程式是_______ 。
(5)第VIIA的元素组成的单质,从上到下熔沸点逐渐升高,其原因是_______ 。
| a | |||||||||||||||||
| b | c | ||||||||||||||||
| d | e | f | g | ||||||||||||||
(2)比较元素c、d、e、f的离子半径,由大到小的顺序是
(3)根据核外电子的排布分区,字母g属于
(4)位于金属元素与非金属元素分界线上的元素常被称为半金属或类金属,其单质及化合物有一定特殊性,如ef3为
(5)第VIIA的元素组成的单质,从上到下熔沸点逐渐升高,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响。如氧气、水、臭氧、二氧化硫等。
(1)在氧、硫、硒、碲元素原子形成的简单阴离子中,其离子半径由大到小的顺序为_________ (用离子符号表示)。与硫元素同周期且在本周期中非金属性最强的元素在周期表中的位置_______ 。
(2)氧族元素的单质及其化合物的性质存在着相似性和递变性。下列有关说法正确的是________
A.氧族元素气态氢化物的稳定性按H2O、H2S、H2Se、H2Te的顺序依次减弱
B.其氢化物中的键长按O—H、S—H、Se—H、Te—H的顺序依次减小
C.其阴离子的还原性按O2–、S2–、Se2–、Te2–的顺序依次增强
D.其最高价氧化物的水化物酸性按H2SO4、H2SeO4、H2TeO4顺序依次增强
(3)火山喷发时会释放出许多H2S气体,请写出H2S分子的电子式____________ 。在H2S分子中, 两个H—S键之间的夹角_____________ (填“大于”、“小于”或“等于”)180°,H2S分子属_____ (填“极性”或“非极性”)分子。
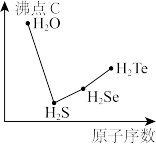
(4)从图可知氧族元素氢化物的沸点变化规律是____________________ 。
(1)在氧、硫、硒、碲元素原子形成的简单阴离子中,其离子半径由大到小的顺序为
(2)氧族元素的单质及其化合物的性质存在着相似性和递变性。下列有关说法正确的是
A.氧族元素气态氢化物的稳定性按H2O、H2S、H2Se、H2Te的顺序依次减弱
B.其氢化物中的键长按O—H、S—H、Se—H、Te—H的顺序依次减小
C.其阴离子的还原性按O2–、S2–、Se2–、Te2–的顺序依次增强
D.其最高价氧化物的水化物酸性按H2SO4、H2SeO4、H2TeO4顺序依次增强
(3)火山喷发时会释放出许多H2S气体,请写出H2S分子的电子式

(4)从图可知氧族元素氢化物的沸点变化规律是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)①元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为___________ nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
②基态K原子中,核外电子占据最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 。
(2)①氮原子价层电子的轨道表达式(电子排布图)为___________ 。
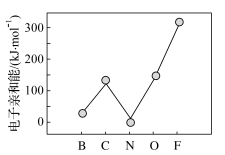
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________ ;氮元素的E1呈现异常的原因是___________
(3)①Fe3+基态核外电子排布式为___________
②C、H、O三种元素的电负性由小到大的顺序为___________ 。
(1)①元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
②基态K原子中,核外电子占据最高能层的符号是
(2)①氮原子价层电子的轨道表达式(电子排布图)为
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是

(3)①Fe3+基态核外电子排布式为
②C、H、O三种元素的电负性由小到大的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】写出下列元素原子的电子排布式
P.____________________________ ,Cr.____________________________ ,
Al._________________________ ,Cu.____________________________ 。
P.
Al.
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为___________ 。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B-的结构示意图为___________ ,C元素在元素周期表的___________ 区,写出常温下B的单质与C的最高价氧化物对应水化物反应的化学方程式:___________ 。
(3)D元素的正三价离子的3d能级为半充满状态,其基态原子的电子排布式为___________ 。
试根据原子核外电子排布所遵循的原理解释D的二价阳离子具有较强的还原性,易被氧化为正三价离子的原因:___________ 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的价电子排布式为___________ 。
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B-的结构示意图为
(3)D元素的正三价离子的3d能级为半充满状态,其基态原子的电子排布式为
试根据原子核外电子排布所遵循的原理解释D的二价阳离子具有较强的还原性,易被氧化为正三价离子的原因:
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的价电子排布式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】硫、钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价层电子排布图为________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______ ,VO 的空间结构为
的空间结构为________ 。
 的空间结构为
的空间结构为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】过渡元素 等在生活、科研中有广泛用途和重要研究价值。回答下列问题:
等在生活、科研中有广泛用途和重要研究价值。回答下列问题:
(1) 分子作为配体时,碳原子和氧原子均能够提供孤电子对。
分子作为配体时,碳原子和氧原子均能够提供孤电子对。 与钴形成配位化合物时,提供孤电子对的为
与钴形成配位化合物时,提供孤电子对的为_______ (填元素名称)原子。
(2)高氯酸六氨合钴(Ⅱ)的结构为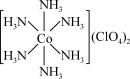 ,其外界离子的空间构型为
,其外界离子的空间构型为_______ 。
(3)下列对 的中心原子采取的杂化类型判断合理的是_______(填标号)。
的中心原子采取的杂化类型判断合理的是_______(填标号)。
 等在生活、科研中有广泛用途和重要研究价值。回答下列问题:
等在生活、科研中有广泛用途和重要研究价值。回答下列问题:(1)
 分子作为配体时,碳原子和氧原子均能够提供孤电子对。
分子作为配体时,碳原子和氧原子均能够提供孤电子对。 与钴形成配位化合物时,提供孤电子对的为
与钴形成配位化合物时,提供孤电子对的为(2)高氯酸六氨合钴(Ⅱ)的结构为
 ,其外界离子的空间构型为
,其外界离子的空间构型为(3)下列对
 的中心原子采取的杂化类型判断合理的是_______(填标号)。
的中心原子采取的杂化类型判断合理的是_______(填标号)。A. | B. | C. | D. |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】 、
、 、
、 、NaClO和
、NaClO和 都是重要的氧化剂。
都是重要的氧化剂。
(1)Mn位于元素周期表第_______ 周期_______ 族,基态Mn原子未成对的电子数为_______ 。
(2)基态Cr原子的核外电子排布式为_______ ,第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为_______ 。
(3) 中,电负性最低的元素是
中,电负性最低的元素是_______ (填元素符号);硝酸根中N的_______ 杂化轨道与O的2p轨道形成_______ 键(填“ ”或“
”或“ ”)。
”)。
(4)NaClO的电子式为_______ ,NaClO在水溶液中会水解产生HClO分子,该分子的立体构型为_______ 。
(5)铁的各级电离能数据为:第一电离能 、第二电离能
、第二电离能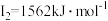 、第三电离能
、第三电离能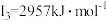 、第四电离能
、第四电离能 、第五电离能
、第五电离能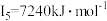 …,
…, 明显大于
明显大于 的原因是
的原因是_______ 。
(6)与CO2相同,COS中所有原子最外层也都满足8电子结构,COS属于_______ 分子(填“极性”或“非极性”),COS沸点_______ CO2沸点(填“>”、“=”或“<”)。
 、
、 、
、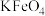 、NaClO和
、NaClO和 都是重要的氧化剂。
都是重要的氧化剂。(1)Mn位于元素周期表第
(2)基态Cr原子的核外电子排布式为
(3)
 中,电负性最低的元素是
中,电负性最低的元素是 ”或“
”或“ ”)。
”)。(4)NaClO的电子式为
(5)铁的各级电离能数据为:第一电离能
 、第二电离能
、第二电离能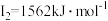 、第三电离能
、第三电离能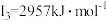 、第四电离能
、第四电离能 、第五电离能
、第五电离能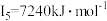 …,
…, 明显大于
明显大于 的原因是
的原因是(6)与CO2相同,COS中所有原子最外层也都满足8电子结构,COS属于
您最近一年使用:0次
【推荐1】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
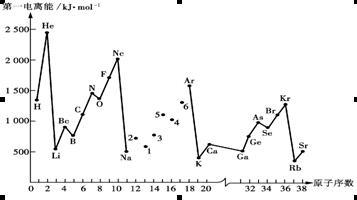
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图象______ 。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______ ;
(3)上图中5号元素在周期表中的位置是______ ;
(4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:______ 。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是______ 。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键______

请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图象
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是
(3)上图中5号元素在周期表中的位置是
(4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】A、B、C、D四种元素处于同一周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻。
(1)C原子的价电子排布式为_____________ 。
(2)A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号)_____________ 。
(3)B的单质分子中存在_____________ 个 键。
键。
(4)D和B形成一种超硬、耐磨、耐高温的新型化合物,该化合物属于_____________ 晶体,其硬度比金刚石_____________ (填“大”或“小”)。
(5)A的气态氢化物的沸点在同族中最高的原因是_____________ 。
(1)C原子的价电子排布式为
(2)A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号)
(3)B的单质分子中存在
 键。
键。(4)D和B形成一种超硬、耐磨、耐高温的新型化合物,该化合物属于
(5)A的气态氢化物的沸点在同族中最高的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】实验室制备溴代烃的反应如下: ①
①
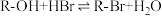 ②
②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下;
请回答下列问题:
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是______ 。
a.圆底烧瓶 b. 容量瓶 c.锥形瓶 d.量筒
(2)溴代烃的水溶性_____ (填“大于”、“等于”或“小于”)相应的醇;其原因是___________________________ 。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________ (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的不正确的是___________ 。
a. 水是反应的催化剂 b.减少 的生成
的生成
c.减少HBr的挥发 d. 减少副产物烯和醚的生成
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其原因是_____________ ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是______________________________ 。
 ①
①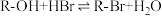 ②
②可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是
a.圆底烧瓶 b. 容量瓶 c.锥形瓶 d.量筒
(2)溴代烃的水溶性
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的不正确的是
a. 水是反应的催化剂 b.减少
 的生成
的生成 c.减少HBr的挥发 d. 减少副产物烯和醚的生成
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其原因是
您最近一年使用:0次



