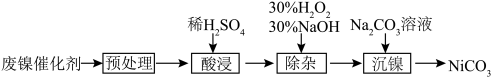
碳酸镍具有良好的催化性能,在化学和工业领域广泛应用。利用废镍催化剂(主要成分为 Ni及其氧化物、Al和 Fe的氧化物)获得碳酸镍的过程如下:
回答下列问题:
(1)“酸浸”时,稀硫酸比稀硝酸更合理,理由是_______ 。
(2)“除杂”时,先加入30% H2O2溶液,再用30% NaOH溶液调pH, 适当升温,反应2 h。
①若除杂后溶液中Ni2+浓度为0.10 mol/L,需控制溶液的pH范围是_______ 。
②加入30% H2O2的目的为_______ 。
③该过程还可用NaClO替代H2O2, 调节pH 为3.5,其反应的离子方程式为_______ 。
(3)“沉镍”后获得产品的一系列操作为_______ 。
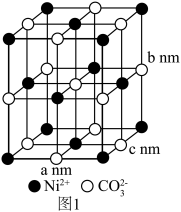
(4)碳酸镍的晶胞如图1所示,Ni2+的配位数为_______ ,晶胞密度为_______ g/cm³(列出计算式,阿伏加德罗常数的值为NA)。_______ 。
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 2.2 | 3.7 | 7.2 | 7.5 |
| 完全沉淀pH | 3.2 | 4.7 | 8.7 | 9.0 |
(1)“酸浸”时,稀硫酸比稀硝酸更合理,理由是
(2)“除杂”时,先加入30% H2O2溶液,再用30% NaOH溶液调pH, 适当升温,反应2 h。
①若除杂后溶液中Ni2+浓度为0.10 mol/L,需控制溶液的pH范围是
②加入30% H2O2的目的为
③该过程还可用NaClO替代H2O2, 调节pH 为3.5,其反应的离子方程式为
(3)“沉镍”后获得产品的一系列操作为
(4)碳酸镍的晶胞如图1所示,Ni2+的配位数为
2024·辽宁·一模 查看更多[4]
东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2023-2024学年高三下学期第一次联合模拟考化学试卷(已下线)化学(辽宁卷03)-2024年高考押题预测卷河北省石家庄市河北正定中学2023-2024学年高三下学期4月模拟考试化学试题(已下线)江苏省南京师范大学附属中学2024届高三下学期5月模拟化学试题
更新时间:2024-03-22 16:19:28
|
相似题推荐
解答题-原理综合题
|
困难
(0.15)
【推荐1】氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。
(1)“ 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
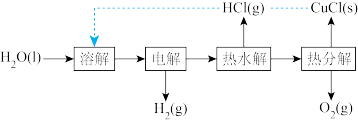
①电解在质子交换膜电解池中进行。阳极区为酸性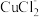 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为_______ (用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有_______ (填元素符号)。
(2)“ 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的 溶液反应,生成
溶液反应,生成 、
、 和
和 ;
; 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。
①实验中发现,在 时,密闭容器中
时,密闭容器中 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
②随着反应进行, 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是 转化为
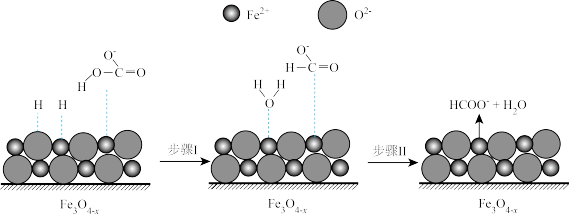
转化为 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为_______ 。
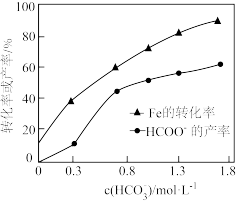
③在其他条件相同时,测得Fe的转化率、 的产率随
的产率随 变化如题图所示。
变化如题图所示。 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是_______ 。
(3)从物质转化与资源综合利用角度分析,“ 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是_______ 。
(1)“
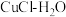 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
①电解在质子交换膜电解池中进行。阳极区为酸性
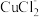 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有
(2)“
 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的 溶液反应,生成
溶液反应,生成 、
、 和
和 ;
; 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。①实验中发现,在
 时,密闭容器中
时,密闭容器中 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为②随着反应进行,
 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
③在其他条件相同时,测得Fe的转化率、
 的产率随
的产率随 变化如题图所示。
变化如题图所示。 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是
(3)从物质转化与资源综合利用角度分析,“
 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐2】用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
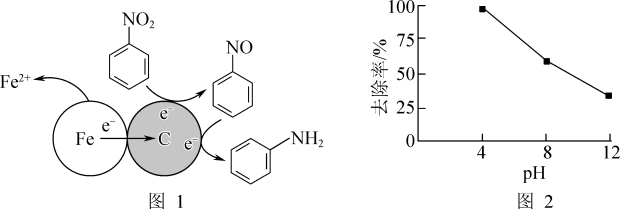
①该物质转化示意图可以描述为_______ 。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(2)向含Fe2+和苯胺(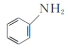 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:_______ 。
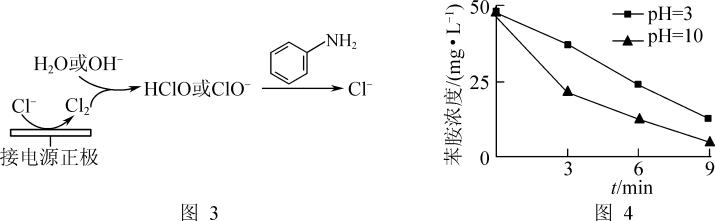
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是
(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐3】下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题:
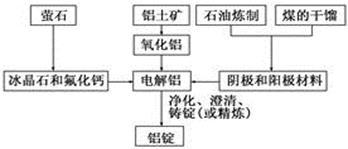
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________ (填化学式)。石油炼制和煤的干馏产品__________ (填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________ 。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为
3CO2+4Al,则阳极的电极反应式为_______________ 。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________ 。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________ 。(热回收效率= 回收能量/生产耗能x100%)

(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式
 3CO2+4Al,则阳极的电极反应式为
3CO2+4Al,则阳极的电极反应式为(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐1】四川省钙芒硝矿(主要成分CaSO4•Na2SO4)资源丰富。钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),其简要生产流程如下图所示。
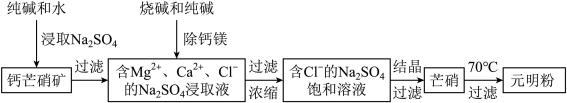
请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是_________________________ 。
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①________ 、②_________ (填化学式)被过滤除去。
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是___________________________________________________________________________ 。

(4)已知:25℃、101kPa时,
2C(s) + O2(g) ==2CO(g) ΔH1 = —222kJ/mol
4Na2SO3(s) == 3Na2SO4(s) + Na2S(s) ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) == 2Na2SO4(s) ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是__________________________________________________ 。
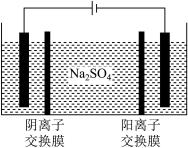
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:______________________________ 。
(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是________ kg。

请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是

(4)已知:25℃、101kPa时,
2C(s) + O2(g) ==2CO(g) ΔH1 = —222kJ/mol
4Na2SO3(s) == 3Na2SO4(s) + Na2S(s) ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) == 2Na2SO4(s) ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:

(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐2】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。

(1)操作1的名称为________________ 。
(2)沉淀A为______________________________ (用电子式表示)。
(3)试剂B的名称为____________________________ ,沉镍后,滤液中C2O42-的浓度为0.01mol/L,则残留在滤液中的 c(Ni2+)=_______________ (已知Ksp[NiC2O4]= 4×10-10)。
(4)NiC2O4·2H2O 高温煅烧制取三氧化二镍的热重曲线如图所示:
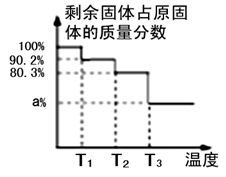
①T3温度后,草酸镍全部转化为三氧化二镍,则a为____________ (保留一位小数)。
②T2温度发生反应的化学方程式为________________________ 。
(5)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体 现象
现象 澄清石灰水变浑浊
澄清石灰水变浑浊
①试剂1的化学式为____________________ 。
②碱石灰的作用是_____________________________________ 。

(1)操作1的名称为
(2)沉淀A为
(3)试剂B的名称为
(4)NiC2O4·2H2O 高温煅烧制取三氧化二镍的热重曲线如图所示:

①T3温度后,草酸镍全部转化为三氧化二镍,则a为
②T2温度发生反应的化学方程式为
(5)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体
 现象
现象 澄清石灰水变浑浊
澄清石灰水变浑浊①试剂1的化学式为
②碱石灰的作用是
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐3】CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO +5C2O
+5C2O +16H+= 2Mn2++8H2O+10CO2↑
+16H+= 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O = 2I-+S4O
= 2I-+S4O
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥________ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为_______________ ;若无该操作,则测定的Cu2+的含量将会__________ (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为_____________________ 。
(4)通过计算确定样品晶体的组成_____________________ 。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO
 +5C2O
+5C2O +16H+= 2Mn2++8H2O+10CO2↑
+16H+= 2Mn2++8H2O+10CO2↑步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O
 = 2I-+S4O
= 2I-+S4O
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为
(4)通过计算确定样品晶体的组成
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
【推荐1】锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用 、
、 、LiCl及苯胺(
、LiCl及苯胺(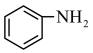 )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为_______ ,其在元素周期表中的位置为_______ ,O、N、P的电负性由大到小的顺序为_______ 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
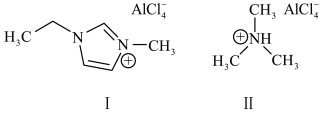
化合物Ⅰ中碳原子的杂化轨道类型为_______ ,1mol化合物Ⅰ中含有_______ 个σ键;化合物Ⅱ中阳离子的空间构型为_______ 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_______ 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
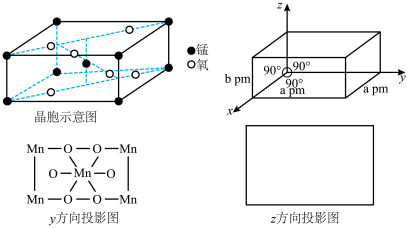
该锰的氧化物中Mn的化合价为_______ ,请画出z方向投影图_______ 。
(1)工业上用
 、
、 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。

化合物Ⅰ中碳原子的杂化轨道类型为
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。

该锰的氧化物中Mn的化合价为
您最近一年使用:0次
【推荐2】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第_________ 周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为_______ 。铁离子的电子排布式__________________
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:

①分子中A1原子采取____ 杂化。Al2Cl6属于____ 分子(填“极性”或“非极性”)。
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________ (填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为______________ ;用物质结构知识说明Fe2+容易被氧化成Fe3+的原因:________________________ 。
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为_____ 。

(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加 德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________ ;Fe2+与O2—的最短核间距为_____________ pm。
(1)钕(Nd)为60号元素,在周期表中位于第
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:

①分子中A1原子采取
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为

(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加 德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
【推荐3】原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________ 。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______ (填化学式),呈现如此递变规律的原因是________________________________ 。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___ ,另一种的晶胞如图二所示,该晶胞的空间利用率为________________ (保留两位有效数字)。( )
)
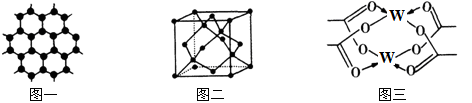
(4)W元素形成的单质,其晶体的堆积模型为___________ ,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________ 。请写出上述过程的离子方程式___________________________ ,___________________________________ 。
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为
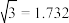 )
)
(4)W元素形成的单质,其晶体的堆积模型为
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
【推荐1】氧化镓(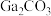 )是一种常用的无机催化剂.某兴趣小组设计以砷化镓废料(主要成分为GaAs、
)是一种常用的无机催化剂.某兴趣小组设计以砷化镓废料(主要成分为GaAs、 、
、 )为原料生产
)为原料生产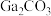 的工业流程如图所示:
的工业流程如图所示:
ⅱ. 对硝酸参与的氧化还原反应有催化作用。
对硝酸参与的氧化还原反应有催化作用。
回答下列问题:
(1)Ga元素的价电子排布式为_______ 。
(2)滤渣1的主要成分为_______ 。
(3)①“浸取”时GaAs发生反应的化学方程式_______ 。
②若取A、B两组样品分别进行“浸取”实验,向A中不断通入 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:___________ B(填>、=或<),其可能原因是___________ 。
(4)“沉镓”时的离子方程式为___________ ,需要控制硝酸用量的原因___________ 。
(5)查阅资料后发现,实际工业生产中,在“浸取”步骤除了加硝酸外,还需要加入 ,从绿色化学角度分析加入
,从绿色化学角度分析加入 的优点
的优点___________ 。
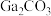 )是一种常用的无机催化剂.某兴趣小组设计以砷化镓废料(主要成分为GaAs、
)是一种常用的无机催化剂.某兴趣小组设计以砷化镓废料(主要成分为GaAs、 、
、 )为原料生产
)为原料生产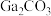 的工业流程如图所示:
的工业流程如图所示: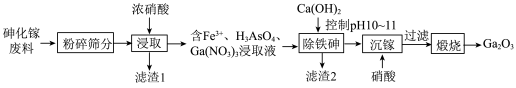
ⅱ.
 对硝酸参与的氧化还原反应有催化作用。
对硝酸参与的氧化还原反应有催化作用。回答下列问题:
(1)Ga元素的价电子排布式为
(2)滤渣1的主要成分为
(3)①“浸取”时GaAs发生反应的化学方程式
②若取A、B两组样品分别进行“浸取”实验,向A中不断通入
 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示: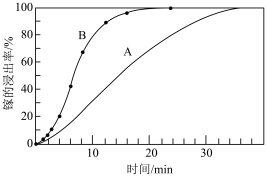
(4)“沉镓”时的离子方程式为
(5)查阅资料后发现,实际工业生产中,在“浸取”步骤除了加硝酸外,还需要加入
 ,从绿色化学角度分析加入
,从绿色化学角度分析加入 的优点
的优点
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐2】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
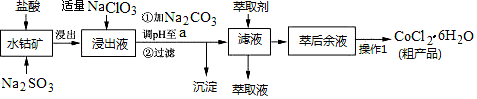
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式______________ 。
(2)写出NaClO3发生反应的主要离子方程式______________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________ 。
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为___________ 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________ ;其使用的最佳pH范围是________________ 。
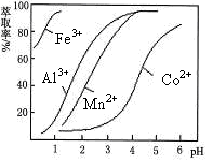
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是________________ 。(答一条即可)

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐3】(一)下图是氮循环示意图,请回答下列问题。
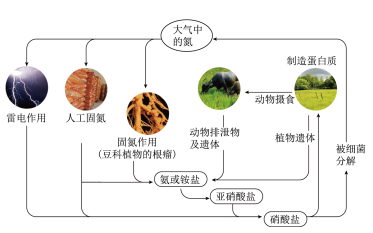
(1)①自然界中的固氮和人工固氮的共同点是将氮元素由游离态转化为__________ 。
②雷电固氮反应的化学方程式是__________ ,其中氮元素被__________ (填“氧化”或“还原”)。
③根据循环图判断下列说法不正确的是__________ 。
a.氮元素均被氧化
b.工业合成氨属于人工固氮
c.含氮无机物和含氮有机物可相互转化
d.碳、氢、氧三种元素也参与了氮循环
(二)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
低温
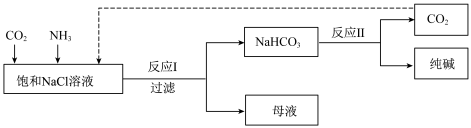
已知反应I为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
(2)工业生产中,制备NH3的化学方程式是___________ .
(3)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO 等离子.
等离子.
①为得到纯净的饱和NaCl溶液,进行了如下操作.请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中___________ ,过滤;
c.向滤液中___________ ,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液.
②步骤c中反应的离子方程式是___________ .
(4)碳酸氢钠加热生成碳酸钠、水和二氧化碳,化学方程式是___________ .
(5)制得的纯碱中含有少量NaCl.取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL CO2.则样品中纯碱的质量分数是___________ %(保留1位小数).

(1)①自然界中的固氮和人工固氮的共同点是将氮元素由游离态转化为
②雷电固氮反应的化学方程式是
③根据循环图判断下列说法不正确的是
a.氮元素均被氧化
b.工业合成氨属于人工固氮
c.含氮无机物和含氮有机物可相互转化
d.碳、氢、氧三种元素也参与了氮循环
(二)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
低温

已知反应I为:NaCl+CO2+NH3+H2O
 NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl(2)工业生产中,制备NH3的化学方程式是
(3)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO
 等离子.
等离子.①为得到纯净的饱和NaCl溶液,进行了如下操作.请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中
c.向滤液中
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液.
②步骤c中反应的离子方程式是
(4)碳酸氢钠加热生成碳酸钠、水和二氧化碳,化学方程式是
(5)制得的纯碱中含有少量NaCl.取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL CO2.则样品中纯碱的质量分数是
您最近一年使用:0次



