锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)元素Zn位于元素周期表的___________ 区,基态Zn原子核外电子占据的最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 形。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。其中,第一电离能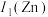
___________  (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是___________ 。
(3) 形成的某种化合物M是很好的补锌剂,其键线式如图所示。
形成的某种化合物M是很好的补锌剂,其键线式如图所示。___________ 。
②常见含氮的配体有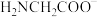 、
、 、
、 等,
等, 分子的空间构型为
分子的空间构型为___________ ,叠氮化钠( )用于汽车的安全气囊,结构如图甲。
)用于汽车的安全气囊,结构如图甲。 中存在的两个大π键可用符号
中存在的两个大π键可用符号 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为___________ 。叠氮酸( )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为___________ 。 最近的4个
最近的4个 所围成的空间构型为
所围成的空间构型为___________ ,距离 最近且等距离的
最近且等距离的 有
有___________ 个。若晶胞参数为apm,则 与
与 最近距离为
最近距离为___________ pm(用含a的代数式表示)。
(1)元素Zn位于元素周期表的
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。其中,第一电离能
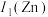
 (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是(3)
 形成的某种化合物M是很好的补锌剂,其键线式如图所示。
形成的某种化合物M是很好的补锌剂,其键线式如图所示。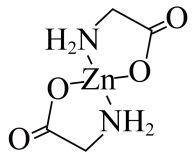
②常见含氮的配体有
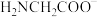 、
、 、
、 等,
等, 分子的空间构型为
分子的空间构型为 )用于汽车的安全气囊,结构如图甲。
)用于汽车的安全气囊,结构如图甲。 中存在的两个大π键可用符号
中存在的两个大π键可用符号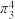 表示,一个
表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为 )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为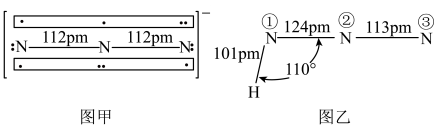
 最近的4个
最近的4个 所围成的空间构型为
所围成的空间构型为 最近且等距离的
最近且等距离的 有
有 与
与 最近距离为
最近距离为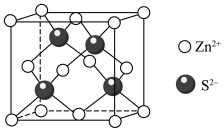
更新时间:2024-04-15 10:36:40
|
相似题推荐
【推荐1】卤族元素(F、Cl、Br、I)是典型的非金属元素,它们的单质及化合物在生产生活中用途广泛。请回答下列问题:
(1)氟原子的价电子排布式为___ ,其原子核外电子能量最高轨道的电子云形状为__ 。
(2)同主族元素的第一电离能大小存在一定的规律,卤族元素(F、Cl、Br、I)中,第一电离能由大到小的顺序是___ 。
(3)氯元素价态多样,可以与氧元素形成多种阴离子,其中ClO3−的空间构型为__ ,ClO4−中氯原子的杂化方式为____ ,请写出一种与ClO4−互为等电子体的微粒____ 。
(4)HF的相对分子质量小于HCl,但沸点却高于HCl,原因是____ 。
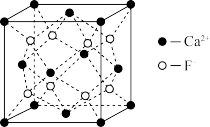
(5)CaF2的晶胞结构如图所示,其中氟离子的配位数是___ 。已知晶胞中相邻最近的两个Ca2+的核间距为anm,NA为阿伏加 德罗常数的值,则晶胞的密度为___ g·cm−3。(列出计算式)
(1)氟原子的价电子排布式为
(2)同主族元素的第一电离能大小存在一定的规律,卤族元素(F、Cl、Br、I)中,第一电离能由大到小的顺序是
(3)氯元素价态多样,可以与氧元素形成多种阴离子,其中ClO3−的空间构型为
(4)HF的相对分子质量小于HCl,但沸点却高于HCl,原因是
(5)CaF2的晶胞结构如图所示,其中氟离子的配位数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】碱土金属指元素周期表中第ⅡA族元素,它们的单质和化合物用途较为广泛。
(1)铍元素能形成一种价格昂贵的宝石——祖母绿,其化学式为Be3Al2(SiO3)6,其中铍元素的化合价是________ ,基态铍原子的价电子排布式为________ 。
(2)镁是航天工业的重要材料。镁元素和相邻元素钠、铝的第一电离能的大小顺序为________ 。
(3)钙元素在自然界以化合物CaCl2、CaCO3、CaSO4、Ca(OH)2等形式存在。上述四种物质中只含有一种类型化学键的是________ ;CO32-的中心原子的杂化类型是________ ,空间构型是________ 。

(4)钡元素与氧元素能够形成一种化合物,其晶胞结构如图所示,该物质的化学式为________ ,Ba2+的配位数是________ ,若阿伏加 德罗常数的值为NA,晶胞边长为a cm,则晶体的密度为________ g·cm−3。
(1)铍元素能形成一种价格昂贵的宝石——祖母绿,其化学式为Be3Al2(SiO3)6,其中铍元素的化合价是
(2)镁是航天工业的重要材料。镁元素和相邻元素钠、铝的第一电离能的大小顺序为
(3)钙元素在自然界以化合物CaCl2、CaCO3、CaSO4、Ca(OH)2等形式存在。上述四种物质中只含有一种类型化学键的是

(4)钡元素与氧元素能够形成一种化合物,其晶胞结构如图所示,该物质的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】Zn、Cu、Mn等元素是人体必需的微量元素。
(1)基态Zn2+的价层电子排布式为___________ ,Zn、Cu均位于元素周期表___________ 区(填s、p、d或ds);比较Zn和Cu的第一电离能I1(Zn)___________ I1(Cu)(填“>”、“<”或“=”)。
(2)在碱性环境下,Cu2+可与双缩脲(NH2CONHCONH2)发生显色反应,产物结构如下:
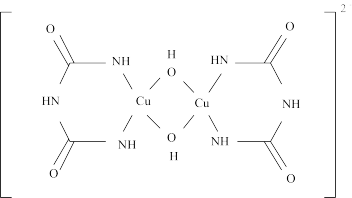
该物质中C的杂化方式为___________ ;Cu2+的配位数为___________ 。
(3)咔唑(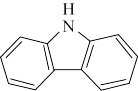 )用于制备靶向Zn2+荧光探针,咔唑沸点比
)用于制备靶向Zn2+荧光探针,咔唑沸点比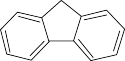 高的主要原因是
高的主要原因是___________ 。
(4)氮化铜(tricoppernitride)是一种新型电极材料,其晶体属于立方晶系,沿晶胞体对角线投影如图(黑球均代表Cu)。
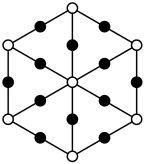
已知该晶胞中原子的分数坐标如下:Cu。(0,0, ):(0,
):(0, ,0);(
,0);( ,0,0);N:(0,0,0),
,0,0);N:(0,0,0),

①氮化铜的晶胞为___________ (填字母标号);
②Cu原子最近的Cu原子有___________ 个;
③NA为阿伏伽德罗常数的值,铜和氮原子的最近距离为anm,则该晶体的密度为___________ g/cm3。
(1)基态Zn2+的价层电子排布式为
(2)在碱性环境下,Cu2+可与双缩脲(NH2CONHCONH2)发生显色反应,产物结构如下:

该物质中C的杂化方式为
(3)咔唑(
 )用于制备靶向Zn2+荧光探针,咔唑沸点比
)用于制备靶向Zn2+荧光探针,咔唑沸点比 高的主要原因是
高的主要原因是(4)氮化铜(tricoppernitride)是一种新型电极材料,其晶体属于立方晶系,沿晶胞体对角线投影如图(黑球均代表Cu)。

已知该晶胞中原子的分数坐标如下:Cu。(0,0,
 ):(0,
):(0, ,0);(
,0);( ,0,0);N:(0,0,0),
,0,0);N:(0,0,0),
①氮化铜的晶胞为
②Cu原子最近的Cu原子有
③NA为阿伏伽德罗常数的值,铜和氮原子的最近距离为anm,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)门捷列夫按元素的相对原子质量大小排列,获得了元素周期律,但他发现钴的相对原子质量(58.93)和镍的相对原子质量(58.69)顺序是颠倒的。回答下列问题:
①Co在元素周期表中的位置为___________ ;基态Ni原子价层电子排布式为:___________ ;Ni基态原子的3d能级上未成对电子数为 ___________ ;
②钴和镍的相对原子质量顺序颠倒的原因可能是___________ 。
(2)两种有机物的相关数据如表:
常温下,邻羟基苯甲酸在水中的溶解性比对羟基苯甲酸小,而邻羟基苯甲酸的酸性比对羟基苯甲酸强,原因是:___________ 。
(3)磷酸盐在微生物作用下可转化为PH3,PH3的中心原子的杂化方式为___________ 。PH3键角为93.6°,小于VSEPR模型的预测值,原因为 ___________ 。
(1)门捷列夫按元素的相对原子质量大小排列,获得了元素周期律,但他发现钴的相对原子质量(58.93)和镍的相对原子质量(58.69)顺序是颠倒的。回答下列问题:
①Co在元素周期表中的位置为
②钴和镍的相对原子质量顺序颠倒的原因可能是
(2)两种有机物的相关数据如表:
| 物质 | 邻羟基苯甲酸 | 对羟基苯甲酸 |
| 水中溶解性(20℃) | <1g/L | 5g/L |
| pKa(20℃) | 3.91 | 4.48 |
(3)磷酸盐在微生物作用下可转化为PH3,PH3的中心原子的杂化方式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是__________ 。
(2)E、G、M三种元素的第一电离能由大到小的顺序为________ (用元素符号表示),其原因为________ 。
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为________ (用分子式表示),其中G的最简单氢化物的分子立体构型名称为_____________________ ,M的最简单氢化物的分子中中心原子的杂化类型为 ____________ 。M和Q的最简单氢化物的沸点大小顺序为__________ (写化学式)。
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示)。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:________________ 。
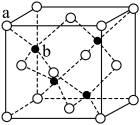
(5) TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm-3。如果TQ的摩尔质量为Mg.mol-1,阿伏加德罗常数为NA mol-1,则a、b之间的距离为_______ cm。
(1)T元素原子的价电子排布式是
(2)E、G、M三种元素的第一电离能由大到小的顺序为
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示)。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:
(5) TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm-3。如果TQ的摩尔质量为Mg.mol-1,阿伏加德罗常数为NA mol-1,则a、b之间的距离为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为______ ;在熔点很高的两种常见单质中,X的杂化方式分别为______ 、______ 。
(2)14g乙的单质分子中π键的个数为______ 。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第______ 电离能。
(4)戊的基态原子有______ 种形状不同的原子轨道;
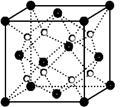
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为______ 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为______ 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=______ cm。 (用含ρ、NA的计算式表示)
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为______
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为
(2)14g乙的单质分子中π键的个数为
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第
(4)戊的基态原子有
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为

(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物在医药化工领域应用十分厂泛。
I、配合物顺铂 是临床使用的第一代铂类抗癌药物,其抗癌机理是在
是临床使用的第一代铂类抗癌药物,其抗癌机理是在 转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的
转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的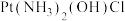 与DNA结合,破坏DNA的结构阻止癌细胞增殖,如图所示:
与DNA结合,破坏DNA的结构阻止癌细胞增殖,如图所示:

请回答:
(1)基态N原子价层电子排布式为_______ 。
(2)鸟嘌呤分子中N原子杂化方式为_______ 。
(3) 中配体与铂(Ⅱ)的结合能力:
中配体与铂(Ⅱ)的结合能力:
_______  (填“>”或“<”)
(填“>”或“<”)
(4)已知顺铂和反铂互为同分异构体,两者的结构和性质如下表。
①推测 中Pt的杂化轨道类型不是
中Pt的杂化轨道类型不是 ,依据是
,依据是_______ 。
②顺铂在水中的溶解度大于反铂的原因是_______ 。
Ⅱ﹑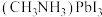 是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示,已知
是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示,已知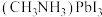 摩尔质量为
摩尔质量为 ,晶胞边长为anm,
,晶胞边长为anm, 为阿佛加德罗常数的值。
为阿佛加德罗常数的值。
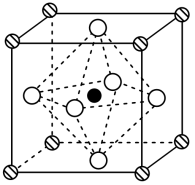
(5)中心小黑球的配位数为_______ 。
(6)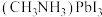 晶体的密度为
晶体的密度为_______  。
。
I、配合物顺铂
 是临床使用的第一代铂类抗癌药物,其抗癌机理是在
是临床使用的第一代铂类抗癌药物,其抗癌机理是在 转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的
转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的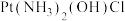 与DNA结合,破坏DNA的结构阻止癌细胞增殖,如图所示:
与DNA结合,破坏DNA的结构阻止癌细胞增殖,如图所示:
请回答:
(1)基态N原子价层电子排布式为
(2)鸟嘌呤分子中N原子杂化方式为
(3)
 中配体与铂(Ⅱ)的结合能力:
中配体与铂(Ⅱ)的结合能力:
 (填“>”或“<”)
(填“>”或“<”)(4)已知顺铂和反铂互为同分异构体,两者的结构和性质如下表。
| 顺铂 | 反铂 | |
| 结构 | 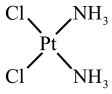 | 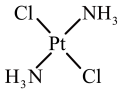 |
| 25℃时溶解度/g | 0.2577 | 0.0366 |
 中Pt的杂化轨道类型不是
中Pt的杂化轨道类型不是 ,依据是
,依据是②顺铂在水中的溶解度大于反铂的原因是
Ⅱ﹑
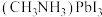 是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示,已知
是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示,已知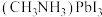 摩尔质量为
摩尔质量为 ,晶胞边长为anm,
,晶胞边长为anm, 为阿佛加德罗常数的值。
为阿佛加德罗常数的值。
(5)中心小黑球的配位数为
(6)
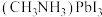 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】臭氧(O3)在[Fe(H2O)6]2+在催化下能将烟气中的SO2、NOx分别氧化为SO 和NO
和NO ,NOx,也可在其他条件下被还原为N2。
,NOx,也可在其他条件下被还原为N2。
(1)SO 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为____ ;NO 的空间构型为
的空间构型为____ (用文字描述)。
(2)写出一种与O3分子互为等电子体的分子____ (填化学式)。
(3)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+,NO以N原子与Fe2+形成配位键,请在指出[Fe(NO)(H2O)5]2+的配位体是____ ,配位数为____ 。
(4)C、N、O元素的性质由大到小的顺序为:电负性____ ;第一电离能____ 。
 和NO
和NO ,NOx,也可在其他条件下被还原为N2。
,NOx,也可在其他条件下被还原为N2。(1)SO
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(2)写出一种与O3分子互为等电子体的分子
(3)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+,NO以N原子与Fe2+形成配位键,请在指出[Fe(NO)(H2O)5]2+的配位体是
(4)C、N、O元素的性质由大到小的顺序为:电负性
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】1985年,Rousssin研究发现了第一个金属原子簇类配位化合物,其结构如图1,金属原子簇类化合物与金属原子表面性质相似,具有良好的催化活性等功能。请回答下列问题:

(1)Fe3+的基态核外价电子排布式为___________ 。
(2)上述化合物中含有三种非金属元素,试比较三种元素原子第一电离能由大到小顺序为_________ ;硫可以形成SOCl2化合物,则该化合物的空间构型为__________ 。
(3)除了氮的氧化物之外,氮还可以形成NO2+。请写出氮原子杂化方式____________ 。
(4)上述原子簇类配合物,中心原子铁的配位原子是___________ 。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如下图所示。下列关于Fe(CO)5说法正确的是_________ 。
A. Fe(CO)5是非极性分子,CO是极性分子
B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C. 1mol Fe(CO)5含有10 mol配位键
D. Fe(CO)5 = Fe+5 CO反应中没有新化学键生成
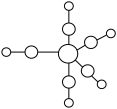 。
。

(1)Fe3+的基态核外价电子排布式为
(2)上述化合物中含有三种非金属元素,试比较三种元素原子第一电离能由大到小顺序为
(3)除了氮的氧化物之外,氮还可以形成NO2+。请写出氮原子杂化方式
(4)上述原子簇类配合物,中心原子铁的配位原子是
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如下图所示。下列关于Fe(CO)5说法正确的是
A. Fe(CO)5是非极性分子,CO是极性分子
B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C. 1mol Fe(CO)5含有10 mol配位键
D. Fe(CO)5 = Fe+5 CO反应中没有新化学键生成
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】某笼形包合物Ni(CN)a(NH3)b(C6H6)c的晶胞如图所示。回答下列有关问题。
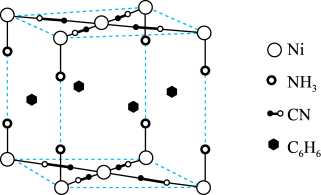
(1)基态镍原子的价层电子排布式为_______ ;该物质中非金属元素电负性由大到小是_______ 。
(2)NH3中N的杂化轨道类型为_______ ;从结构角度分析C、P原子之间不易形成π键的原因是_______ 。
(3)在晶胞中,镍离子与CN-之间产生配位键,配体CN-提供的配位原子有_______ ;镍离子的配位数为_______ 。
(4)推测该包合物中氨与苯分子数目比,即b:c为_______ ,其中Ni的平均化合价为_______ 。
(5)若此晶胞体积为Vnm3,阿伏加德罗常数为NAmol-1,晶胞的摩尔质量为Mg/mol,则晶体密度为_______ g/cm3(列出计算表达式)。

(1)基态镍原子的价层电子排布式为
(2)NH3中N的杂化轨道类型为
(3)在晶胞中,镍离子与CN-之间产生配位键,配体CN-提供的配位原子有
(4)推测该包合物中氨与苯分子数目比,即b:c为
(5)若此晶胞体积为Vnm3,阿伏加德罗常数为NAmol-1,晶胞的摩尔质量为Mg/mol,则晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】硼及其化合物在科研、工业等方面有许多用途。
(1)基态B原子价层电子排布式是___________ 。
(2)六方氮化硼晶体也被称为“白石墨”,具有和石墨晶体相似的层状结构,如图所示。___________ 。
②分析六方氮化硼晶体层间是否存在化学键并说明依据:___________ 。
(3)氮化硼量子点(粒径大小为2~10nm)可用于检测金属离子,如Fe2+或Fe3+的检测原理如下图。___________ 。
②n=___________ (填数字)。
(4)NaBH4是一种重要的储氢材料,其晶胞结构由Ⅰ、Ⅱ两部分组成,如图所示。___________ 。
②已知阿伏加德罗常数为NA,该晶体的密度为___________ g·cm-3。(1nm=10-7cm)
(1)基态B原子价层电子排布式是
(2)六方氮化硼晶体也被称为“白石墨”,具有和石墨晶体相似的层状结构,如图所示。

②分析六方氮化硼晶体层间是否存在化学键并说明依据:
(3)氮化硼量子点(粒径大小为2~10nm)可用于检测金属离子,如Fe2+或Fe3+的检测原理如下图。

②n=
(4)NaBH4是一种重要的储氢材料,其晶胞结构由Ⅰ、Ⅱ两部分组成,如图所示。

②已知阿伏加德罗常数为NA,该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:
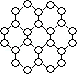
(1)下列有关石墨烯说法正确的是________________ 。
A.键长:石墨烯>金刚石
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为_____________ ;第四周期元素中,最外层电子数与铜相同的元素还有________________________ 。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因______________________________ 。
③下列分子属于非极性分子的是__________________ 。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
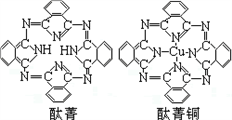
④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是__________ ;酞菁铜分子中心原子的配位数为________________ 。
⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):
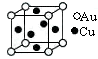
它的化学式可表示为_____ ;在Au周围最近并距离相等的Cu有_____ 个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为___________________ g/cm3。(阿伏伽德罗常数用NA表示)

(1)下列有关石墨烯说法正确的是
A.键长:石墨烯>金刚石
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含
 键数为NA
键数为NAD.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因
③下列分子属于非极性分子的是
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是

⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):

它的化学式可表示为
您最近一年使用:0次



